Bei jährlich ca. 27 Millionen Sprunggelenksverletzungen weltweit und damit assoziierten ca. 1,7 Millionen osteochondralen Läsionen des Talus (Baumhauer et al. Am J Sports Med. 1995; 23 (5): 564 – 570) mit gegebenenfalls Folgeschäden, ist das Interesse der orthopädischen und unfallchirurgischen Gemeinschaft deshalb groß, die postoperativen Ergebnisse nachhaltig zu verbessern.
Zum einen können durch Sprunggelenkstrauma Veränderungen im Sinne eines Knochenmarködems (bone bruise) durch die mechanische Komponente des Verletzungsmechanismus entstehen, zum anderen aber auch durch den Traumahergang Verletzungen am Knorpel des Talus (chondrale Läsionen) oder kombinierte Knochen Knorpelverletzungen (osteochondrale Läsionen). Die osteochondralen Läsionen des Talus können mit subchondrale Zysten einhergehen. Die betroffenen Patienten klagen über Sprunggelenksschmerzen, teilweise belastungsunabhängig, über eine eingeschränkte Sprunggelenksbeweglichkeit, teilweise über Schwellung und Blockierungen und über funktionelle Instabilitätsepisoden [4]. Bei der klinischen Untersuchung der Patienten zeigen sich neben den oben genannten Symptomen gegebenenfalls instabile Syndesmosen, Insuffizienzen im Bereich des medialen und lateralen Kapselbandapparates sowie Achsabweichungen im Rückfuß, welche eine weiterführende Behandlung benötigen [5].
Die bisherigen Behandlungsstrategien bestehen aus konservativen und operativen Maßnahmen. Konservative Maßnahmen beinhalten u. a. Entlastung an Unterarmgehstützen, Einnahme von NSAR, physiotherapeutische Übungsmaßnahmen, Versorgung mittels Sprunggelenksorthesen und Schuheinlagen, ggf. intraartikuläre Injektionen von Kortikosteroiden. Die operativen Behandlungsstrategien werden grob unterteilt in knochenmarkstimulierende, knorpelreparative und knorpelregenerative Maßnahmen. In den letzten Jahren bekommen Injektionen mit Hyaluronsäurepräparaten und plättchenreichem Plasma (Platelet Rich Plasma – PRP) Präparaten eine vermehrte Aufmerksamkeit bei der Behandlung von osteochondralen Läsionen am Talus. Verschiedene Studien konnten eine Verbesserung der Gelenksbeweglichkeit und eine Minderung der postoperativen Schmerzen nachweisen, wenn intraoperativ Wachstumsfaktoren und bioaktive Komponenten, enthalten im PRP, während der Operation am Sprunggelenk injiziert wurden. Interessanterweise zeigten diese Studien, dass die Verbesserung der oben genannten Faktoren unabhängig von der Operationsmethode sind [3]. Im weiteren Verlauf sollen neue Behandlungsmethoden für die Behandlung des Knochenmarksödems, des chondralen und des osteochondralen Defektes am Talus vorgestellt werden.

Biologische Grundlagen
Wie oben bereits beschrieben hat in den letzten 10 Jahren der
Einsatz von PRP bei derartigen Verletzungen durch positive
Ergebnisse an Stellenwert gewonnen. Um den Effekt von PRP besser verstehen zu können, muss die physiologische Geweberegeneration näher betrachtet werden. Der Heilungsmechanismus betrifft in der Regel alle Gewebetypen
gleichermaßen und durchläuft nach erfolgter Hämostase 3 Stadien:
1. Entzündungsreaktion
Thrombozyten und Leukozyten im Blutpfropf setzen Wachstumsfaktoren und zahlreiche
andere Zytokine frei, die die Entzündungsreaktion auslösen. Ebenfalls vorhandene Endothelzellen steuern dann die Entzündungsprozesse zum Ort der Verletzung hin (7). Komplexe metabolische Zyklen, an denen unter anderem auch Neutrophile und Makrophagen beteiligt sind schließen sich an (8). Letztere, rekrutiert durch Signalstoffe der Leukozyten, leiten dann die Freisetzung von
Heilungsfaktoren wie z.B. TGF-ß, bFGF, PDGF und VEGF ein (9).
2. Proliferation
Freigesetztes VEGF stimuliert Plasmaproteine eine temporäre Matrix abzusetzen, in die dann, gesteuert durch Zytokine, die durch die Immunzellen freigesetzt wurden, stromale Progenitorzellen einwachsen. Die Progenitorzellen differenzieren in Abhängigkeit der vorhandenen Wachstumsfaktoren
und Zytokinen und werden so zu dem vorherrschenden gewebespezifischen Zelltypus (etwa 3-5 Tage nach Verletzung). Zusätzlich produzieren diese Zellen, stimuliert durch PDGF, IGF, und TGF ß, Kollagen, Proteoglykane und andere Komponenten der extrazellulären Matrix (10).
3. Remodelling
Die Kollagenablagerung erreicht ihren Maximalwert ca. 2-3 Wochen nach der Verletzung und
der Übergang zur Remodellingphase beginnt. Ein Gleichgewicht aus Synthese, Anlagerung und Abbau entsteht. Kleine Kapilaren schließen sich zu größeren Gefäßen zusammen. Wassergehalt, Zelldichte
und metabolische Aktivitäten gehen zurück. Kollagentypus, Menge, und Organisation verändern sich signifikant, was zu einer erhöhten Festigkeit führt. Aus ursprünglich abgelagerten Kollagen III wird Kollagen I und das physiologische Verhältnis von 4:1 ( Koll 1 zu 3 ) wird wieder hergestellt (11).
Wird nun diese physiologische Heilungskaskade durch intrinsische oder extrinsische Faktoren gestört, kommt es abhängig vom Schweregrad und der Gewebeart zu korrespondierenden Pathologien.
Plättchenreiches Plasma – PRP
PRP, in der Regel durch Zentrifugation aus Vollblut hergestellt, ist durch eine erhöhte Konzentration an Thrombozyten gekennzeichnet und folglich auch einer erhöhten Konzentration der darin enthaltenen Wachstumsfaktoren. Wird PRP in die betroffene Region injiziert, wirkt sich die erhöhte Wachstumsfaktorenkonzentration positiv auf die Zellproliferation, Differenzierung, Chemotaxis, und Angiogenese aus [11]. Beeinträchtigte Heilungsmechanismen kommen wieder in Gang und die Heilung des betroffenen Gewebes wird stimuliert.
Anwendung bei der Knochenregeneration
Wie in anderen Geweben wirkt sich PRP auch bei der Knochenheilung positiv auf die Zellproliferation, Differenzierung, Chemotaxis und Angiogenese aus. Bei einer Lebenszeit der Thrombozyten von 7 – 10 Tagen geht man davon aus, dass PRP eher die frühe Knochenheilung unterstützt, als dass es die späte Knochenformation beeinflusst [12]. Es gibt zunehmend Beweise dafür, dass die thrombozyteninduzierte Entzündung eine tragende Roll bei der Frühphase der Heilung spielt, und dass es ohne sie zu keiner effektiven Regeneration kommen kann [12]. Bei überschießender Entzündung wird die Heilung jedoch negativ beeinflusst. Hier wirkt sich PRP speziell durch die Wachstumsfaktoren TGF-β1, IL-4, HGF und TNF-α positiv, sowohl auf das Ausmaß als auch auf die Dauer der Entzündung aus [12], sodass die Heilung frühzeitig in die richtigen Bahnen gelenkt wird.
Anwendung bei Knorpel-Läsionen
Wird Knorpel beschädigt, verfügt er aufgrund seiner inhärenten Avaskularität nur über ein sehr eingeschränktes Selbstheilungspotenzial, welches dann zu Knorpelläsionen und Osteoarthritis führt. Zahlreiche Wachstumsfaktoren spielen jedoch bei der Entwicklung und der Homeostase des Knorpels eine zentrale Rolle, was den Einsatz von PRP bei der Knorpelregeneration nahelegt. Anabole Faktoren wie z. B. TGF-ß1 oder IGF-I stimulieren die Chondrozyten Proteoglykane, Aggrekane und Kollagen II zu synthetisieren. Sie induzieren die Proliferation von Synovizyten und mesenchymalen Stammzellen. Gleichzeitig werden die katabolen Effekte von beispielsweise Interleukin 1 (IL-1) oder den Matrixmetalloproteasen (MMPs) verringert [13].
Das Knochenmarködem des Talus

Das Knochenmarködem stellt eine pathologische Vermehrung der interstitiellen Flüssigkeit im Knochen dar und kann bereits in der Initialphase im MRT bei unklaren Gelenkschmerzen detektiert werden (Abb. 2). Die Ursachen des Knochenmarködems sind unterschiedlich. Bei persistierenden Gelenkschmerzen spricht man von einem Knochenmarködem-Syndrom (KMÖS), welches mit einer Krankheitsdauer von 3 bis zu 18 Monaten beschrieben wird [14 – 16]. Zu erwähnen ist, dass die Abgrenzung zur Osteonekrose des Talus schwierig ist. Im Regelfall zeigt sich aber bei der Osteonekrose ein fulminanter Krankheitsverlauf. Grob eingeteilt werden die Knochenmarködeme in das ischämische, mechanisch traumatische und reaktive Knochenmarködem. Das Knochenmarködem am Talus wird häufig nach Trauma im MRT sichtbar. Wie und warum aus dem Knochenmarködem ein Knochenmarködemsyndrom entsteht, ist bis dato unklar [17].
Klinische Symptome
Die klinischen Symptome äußern sich mit akutem Schmerz und einer deutlichen Funktionseinschränkung, Schwellungen im oder am Sprunggelenk. Lokale Entzündungszeichen sind meist nicht zu erkennen.
Bildgebende Verfahren
Im Nativröntgenbild lässt sich mitunter eine diffuse Osteopenie im betroffenen Bereich beobachten. Die Skelettszintigrafie mit ihrer nachweisbaren Traceranreicherung bei KMÖ ist ein Hinweis auf das Vorliegen vermehrter Knochenumbauprozesse. Sie ist homogen, die umliegenden Weichteile sind nicht betroffen. Die Sensitivität liegt bei ca. 60 % [18]. Das Mittel der Wahl zur Diagnosesicherung ist die Kernspintomografie. Es wird im MRT eine Sensitivität von 100 % angegeben. Um eine Osteonekrose von einem Knochenmarksödem zu unterscheiden, wird eine Kontrastmittel Applikation mit Gadolinium empfohlen [19].
Therapie
Grundsätzlich steht der konservative Therapieansatz im Vordergrund. Eine symptomatische Behandlung mit Entlastung der betroffenen Seite, Einnahme von entzündungshemmenden Medikamenten sowie manuelle Therapie und Physiotherapie muss zunächst angestrebt werden. Neuere Studien zeigen, dass es durch die i. v. Gabe von Iloprost oder Bisphosphonaten (z. B. Ibandronat) zu einer deutlichen Verbesserung der Symptome kommen kann. Durch die Gabe der oben genannten Medikamente soll eine Verbesserung der Blutzirkulation (Iloprost) entstehen bzw. die Osteoklasten (Bisphosphonate) gehemmt werden [20 – 23]. Kritisch zu bemerken sind die Nebenwirkungen, die durch die i.v. Gabe von Iloprost und Bisphosphonaten auftreten können. Erwähnt seien besonders die lokalisierten Osteonekrosen des Kiefers und atypische Femurfrakturen insbesondere bei der Gabe Bisphosphonaten [26].
Bei der operativen Versorgung wird der betroffene Knochenbereich angebohrt (core decompression) [24, 25]. Durch die Druckentlastung, die bei der Anbohrung entsteht, können die Symptome verbessert werden, eine Schmerzreduktion findet statt. Zudem wird davon ausgegangen, dass durch die Anbohrung eine gesteigerte Blutzirkulation bzw. sogar Revaskularisierung stattfinden kann. In den biologischen Grundlagen wurde der Einfluss von PRP auf die Knochenheilung bereits beschrieben. Dies gilt auch beim Knochenmarksödem. Wie in anderen Geweben wirkt sich PRP auch bei der Knochenheilung positiv auf die Zellproliferation, Differenzierung, Chemotaxis und Angiogenese aus. Diese Zusammenhänge führen uns zu einem neuen Therapieansatz. Neben der bereits beschriebenen operativen Druckentlastung durch Anbohrung des Knochens wird zusätzlich Platelet Rich Fibrin (PRF), hergestellt aus PRP und autologer Thrombinlösung in die betroffenen Knochenareale injiziert. Für die Herstellung des PRF wird ausschließlich patienteneigenes Material verwendet.

Herstellung der biologischen Substanzen (siehe Abb. 3): PRP (ACP Autologes Conditioniertes Plasma). Aus 45ml venösem Blut wird mittels 3 ACP Doppelspritzen (Arthrex GmbH) 15 ml ACP hergestellt. Autologe Thrombin-Lösung: Zur Herstellung der Thrombin-Lösung wird das Thrombinator System (Arthrex GmbH) verwendet. Das Thrombinator-Verfahren nutzt die Prinzipien der Gerinnungskaskade und vermeidet den Einsatz von aggressiven chemischen Reagenzien wie z. B Ethanol. Durch das Design des Thrombinators werden lange Inkubationszeiten und Erhitzung überflüssig. Die autologe Thrombinlösung wird in ca. 15 Minuten aus PRP direkt am Ort der Anwendung hergestellt.
Anwendung der biologischen Substanzen beim Knochenmarködem

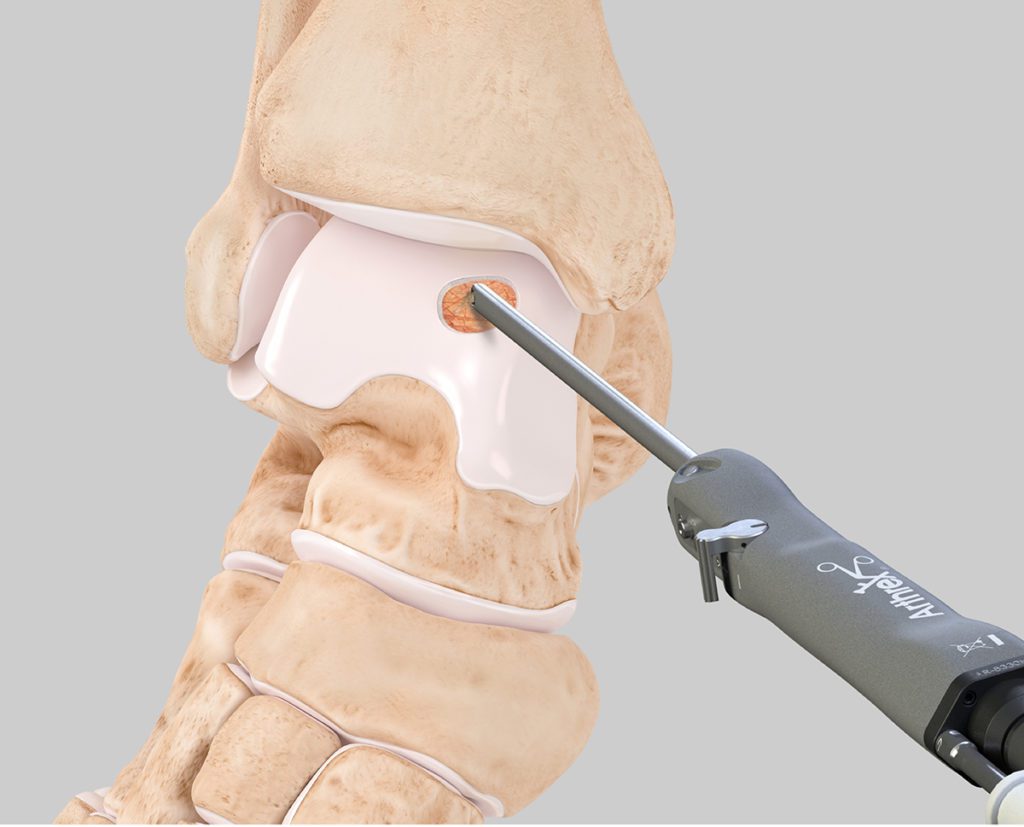
Der Eingriff kann minimal invasiv (arthroskopisch) durchgeführt werden. Für die retrograde Anbohrung empfiehlt es sich, ein Zielgerät intraartikulär über die betroffenen Knorpel-Knochenareale zu setzen, um dann die Anbohrung zielgerichtet durchführen zu können. Bei Bedarf ist der Einsatz von einer intraoperativen Röntgenkontrolle möglich. Zunächst retrogrades Anbohren mit Hilfe des Zielgeräts (GPS System, Arthrex GmbH) (Abb. 4 + 5). In die Bohrung wird anschließend über einen konischen Applikator Platelet Rich Fibrin injiziert. Der Konus, leicht die Bohrung gedrückt, verhindert ein Zurückfließen des PRFs vor dem Gelieren. Zum Abschluss wird das Bohrloch mit Knochenersatzmaterial (Innotere Paste CPC, Arthrex, GmbH) verschlossen. Platelet Rich Fibrin entsteht durch das Mischen von PRP und autologer Thrombinlösung, wobei der letzter Schritt der Koagulationskaskade nachgestellt wird, bei dem aus Fibrinogen (im PRP enthalten) und Thrombin ein stabiler Fibrinklot gebildet wird. Die Patienten entlasten postoperativ bis zur abgeschlossenen Wundheilung im Walker an Unterarmgehstützen. Nach abgeschlossener Wundheilung ist eine sofortige Vollbelastung im Regelfall möglich, sollten keine Begleitverletzungen operativ versorgt worden sein. Bei einer Beobachtungsstudie zeigten die Patienten nach dem kombinierten Eingriff mit Anbohrung des Knochens und Einbringen von PRF intraossär nach 14 Tagen einen Schmerzrückgang auf der visuellen Analogskala von durchschnittlich VAS 9 auf VAS 1.
Chondrale Läsionen und osteochondrale Läsionen des Talus
Zu chondralen oder osteochondralen Läsionen des Talus kommt es insbesondere bei jungen Patienten durch ein traumatisches Ereigniss, in den meisten Fällen durch ein Distorsionstrauma. Basierend auf Flick und Gould`s Untersuchungen von 500 dokumentierten Knorpel-Knochen Verletzungen am Talus zeigt sich eine Verteilung von 98 % lateraler Talusläsionen und 70 % medialer Talusläsionen. Die Autoren konnten zeigen, dass die Ursachen sowohl akute Traumatas als auch repetitive Mikrotraumen, welche auf den Talusknorpel wirken, sein können.
Klinische Symptome
Im Vordergrund stehen erneut Sprunggelenksschmerzen, die auch nach längerer Ruhigstellung und durch physiotherapeutische Maßnahme keine Verbesserung zeigen. Die Schmerzangabe ist entweder medial oder lateral lokalisiert, einige Patienten geben Blockierungsgefühle an, zudem kann sich klinisch eine deutliche Schwellung und Ergussbildung im oberen Sprunggelenk zeigen. In der Anamnese ist fast immer ein nur kurz zurückliegendes Unfallereignis zu erheben.
Bildgebende Verfahren
Zu den bildgebenden Verfahren gehört das Nativ Röntgen in 3 Ebenen unter Belastung (a.p., seitlich, Mortise-Ansicht) [27]. Bei spezieller Fragestellung zur Beurteilung des Rückfußes ist eine Salzmann Aufnahme gegebenenfalls in Ergänzung notwendig. Die CT hat ihren Stellenwert insbesondere bei der Mitbeteiligung ossärer Strukturen und hilft, die Tiefe der Läsion zu bestimmen [28, 29]. Seit einiger Zeit wird die digitale Volumen Tomografie verwendet, um ein belastetes, dreidimensionales Bild des Sprunggelenkes zu bekommen. Diese belasteten Aufnahmen haben den Vorteil, dass die Therapieplanung genauer ist, da sich die Knochenposition in der Belastungssituation verändert. Zum Standardverfahren gehört das MRT, welches mit knorpelsensitiven Pulssequenzen den Gelenkknorpel abbilden kann. Im MRT besteht die Möglichkeit, Knorpelveränderungen und Veränderung am subchondralen Knochen zu zeigen, welche im normalen Röntgen nicht nachzuweisen sind. Die Sensitivität und Spezifität für Knorpelveränderungen am Talus wird mit 96 % angegeben [30]. dGEMRIC Sequenzen geben uns die Möglichkeit, direkt die Konzentration von GAG (Glycosaminoglykan) zu messen. Dieses Verfahren erfordert allerdings eine intravenöse Injektion von gadoliniumbasierten Kontrastmitteln. In den letzten Jahren hat das sogenannte SPECT Verfahren an Aufmerksamkeit gewonnen [31]. SPECT steht für Single Photon Emission Computed Tomographie und ist eine Sonderform der CT-Untersuchung, mit deren Hilfe zwischen aktiven Läsionen des Knorpelknochenkomplexes am Talus und inaktiven Knorpelknochenläsionen am Talus differenziert werden.
Therapie
Die Therapie der chondralen Läsion am Talus richtet sich nach der Größe der Knorpelläsion. Knorpelläsion unter 1,0 cm² und einer Dicke von weniger als 5 mm werden in der Regel durch Mikrofrakturierung oder Nanofrakturierung (Knochenmarkstimulierung) behandelt [27]. Knorpelläsionen größer als 1,5 cm, werden in der Regel durch Autograft Techniken oder wenn möglich durch autologe Chondrozyten Implantation versorgt [5]. Zeigt sich ein intaktes, chondrales Fragment mit mind. 3mm Dicke, kann eine Refixation erfolgen. Die Refixation erfolgt dann mit einer bioresorbierbaren Kompressionsschraube, bioresorbierbaren Darts oder Pins [27]. Die Therapie von osteochondralen Läsionen erfordert im Regelfall sowohl einen Aufbau des verletzten Knochenbereiches als auch eine Versorgung des betroffenen Knorpelareals. Wird Knorpel beschädigt, verfügt er aufgrund seiner inhärenten Avaskularität nur über ein sehr eingeschränktes Selbstheilungspotenzial, welches dann zu Osteoarthritis führen kann. Auch hier ist deshalb die Überlegung, das operative Verfahren mit PRP und Thrombin zu kombinieren.
Operatives Vorgehen
Bei der chondralen Läsion ist darauf zu achten, dass der Knorpeldefekt entsprechend debridiert und vorbereitet wird. Auf steile gesunde Knorpelränder ist zu achten.
AutoCart Prozedur (Abb. 6 – 9)

Knorpelfragmente werden mittels eines 3 mm Shavers (Sabre 3 mm, Arthrex GmbH) aus dem Knorpelrand gewonnen. Alternativ können benötigte Knorpelchips auch von nichtlasttragenden Bereichen am Knie entnommen werden. Gesammelt werden die Fragmente im GraftNet Gewebekollektor (Arthrex GmbH) und anschließend in eine 1 ml Spritze mit Luerlockanschluss überführt. Die Knorpelfragmente werden dann über einen female zu female Adapter mit PRP in einem Verhältnis von 3:1 gemischt. Zum einen entsteht dadurch eine homogene pastöse Masse, zum anderen beinhaltet das ACP das zum Klotten notwendige Fibrinogen. Die 1 ml Spritze wird mit der Applikationskanüle verbunden und die Fragmente werden in die Kanüle überführt. Anschließend werden die Fragmente vorsichtig mit dem Trokar der Kanüle zur Kanülenspitze gedrückt, bis sie in der Öffnung erscheinen. Die Arthroskopieflüssigkeit sollte dann aus dem Sprunggelenk abgesaugt werden und die Läsion so gut wie möglich getrocknet werden. Nun wird mit dem Trokar das Fragmentgemisch vorsichtig nach vorne geschoben und in den Defekt appliziert. Die Fragmentpaste wird anschließend vorsichtig tropfenweise mit der gewonnenen Thrombinlösung überschichtet. Das Thrombinator Verfahren nutzt die Prinzipien der Gerinnungskaskade. Durch die Verbindung des in der Paste enthaltenen Fibrinogen und appliziertem Thrombin entsteht ein stabiler Klot, der das Gemisch in der Läsion hält. Zur Versiegelung das PRP mit Thrombin in einem Verhältnis von 1:1 mischen. Das Gemisch nach dem Mischen zügig tropfenweise auf die Läsion applizieren. Anschließend ca. zwei Minuten warten. Unter Sicht sollte das Gelenk vorsichtig durchbewegt werden, um die Kongruenz der Gelenkpartner zu überprüfen.


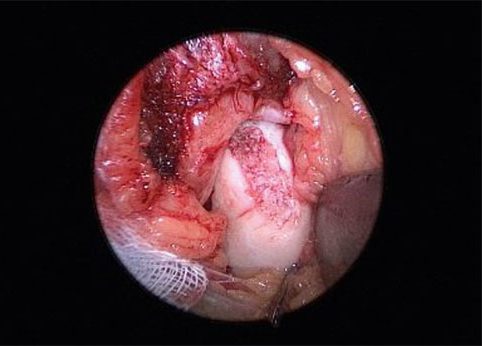
Abbildungen 10 und 11 zeigen Intra- operative Aufnahmen einer chondralen Läsion mit AutoCart versorgt. Bei der Versorgung einer osteochondralen Läsion wird nach der Spongiosaplastik der obengenannte stabile Klot, bestehend aus fragmentiertem Knorpel und PRF auf die Spongiosaplastik aufgelegt und fixiert (Abb. 12 + 13). Auch hier sollte nach dem Einbringen das Gelenk vorsichtig durchbewegt werden, um die Kongruenz der Gelenkpartner zu überprüfen. Der Patient wird postoperativ für sechs Wochen in einem Walker mit 20 kg Teilbelastung versorgt. Eine Bewegungsschiene mit einem Bewegungsausmaß Dorsalfektion/Plantarflexion 20-0-20 wird empfohlen. Lymphdrainage und falls notwendig Schmerzmittel sollten rezeptiert werden. Auf NSAR sollte aufgrund der fibrozystenhemmenden Wirkung verzichtet werden. Ab der 7. Woche kann je nach klinischer Situation der Belastungsaufbau erfolgen. Beide Verfahren (arthroskopisch als auch offen mit Spongiosa-Plastik) haben sich in der Kurzanwendung in einer Beobachtungsstudie als sicher und gut durchführbar gezeigt. Langzeitergebnisse werden zeigen, wie die Geweberegeneration voranschreitet.



Literatur
[1] Gianakos AL, Yasui Y, Hannon CP, Kennedy JG. Current management of talar os- teochondral lesions. World J Orthoped. 2017;8(1):12 – 20.
[2] Shimozono Y, Yasui Y, Ross AW, Kennedy JG. Osteochondral lesions of the talus in the athlete: up to date review. Curr Rev Muscoskel Med. 2017;10(1):131 – 140.
[3] Yausep OE, Madhi I, Trigkilidas D, JOO, Platelet rich plasma for treatment of osteochondral lesions of the talus. J of Orthop., 18(2020) 218 – 225
[4] Gökay Görmeli, MD1, Mustafa Karakaplan, MD1, Cemile Ayşe Görmeli, MD2, Baran Sarıkaya, MD3, Nurzat Elmalı, MD4, and Yüksel Ersoy, MD5, Clinical Effects of Platelet-Rich Plasma and Hyaluronic Acid as an Additional Therapy for Talar Osteochondral Lesions Treated with Microfracture Surgery: A Prospective Randomized Clinical Trial. Foot & Ankle International® 2015, Vol. 36(8) 891–900
[5] Eoghan T. Hurley, MB, BCh1, Christopher D. Murawski, MD2, Jochen Paul, MD3, Alberto Marangon, MD4, Marcelo P. Prado, MD5, Xiangyang Xu, MD6, Laszlo Hangody, MD7,8, John G. Kennedy, MD, MCh, MMSc, FRCS (Orth)9, and the International Consensus Group on Cartilage Repair of the Ankle, Osteochondral Autograft: Proceedings of the International Consensus Meeting on Cartilage Repair of the Ankle. Foot & Ankle International®2018, Vol. 39(1S) 28S–34S
[6] Ahmed Aly Elghawy, Carlos Sesin, Michael Rosselli, Osteochondral defects of the talus with a focus on platelet-rich plasma as a potential treatment option: a review. BMJ Open Sport & Exercise Medicine 2018;4:e000318. doi:10.1136/
[7] Verhamme P, Hoylaerts MF: Hemostasis and inflammation: Two of a kind? Thromb J 7:15, 2009
[8] Borregaard N, Sørensen OE, Theilgaard-Wnchl K: Neutrophil granules: A library of innate immunity proteins.Trends Immunol 28:340-345, 2007
[9] Krysko DV, D’Herde K, Vandenabeele P: Clearance of apoptotic and necrotic cells and its immunological consequences. Apoptosis 11:1709-1726, 2006
[10] Magra M, Maffulli N: Matrix metalloproteases: A role in overuse tendinopathies. Br J Sports Med 39:189-191, 2005
[11] Andia I, Sánchez M, Maffulli N: Basic Science: Molecular and Biological Aspects of Platelet-Rich Plasma Therapies, Operative Technique in Orthopedics, 22:3 – 9 © 2012
[12] Oryan A, Alidadi, Moshiri A: Platelet-rich plasma for bone healing and regeneration Expert Opinion on biological therapy, 2016
[13] Fortier L, Barker J, Strauss E.J, McCarrel T, Cole B: The role of growth factors in cartilage repair, Clin. Orthop Relat Res, DOI 10.1007/s1 1999-011-1857-3
[14] Aigner N, Maizer R, Meraner D et al (2009) Bone marrow edema syn- drome in postpartal women: tre- atment with iloprost. Orthop Clin North Am 40(2):241 – 247
[15] Guerra JJ, Steinberg ME (1995) Dis- tinguishing transient osteoporosis from avascular necrosis of the hip. JBone Joint Surg Am 77(4):616–624
[16] Disch AC, Matziolis G, Perka C (2005) The management of necro- sis-associated and idiopathic bone- marrow oedema of the proximal fe- mur by intravenous iloprost. J Bone Joint Surg Br 87(4):560–564
[17] Plenk H Jr, Hofmann S, Eschberger J et al (1997) Histomorphology and bone morphometry of the bone marrow edema syndrome of the hip. Clin Orthop Relat Res 334:73–84
[18] Lai K-A, Shen WJ, Yang CY et al (2005) The use of alendronate to prevent early collapse of the femo- ral head in patients with nontrau- matic osteonecrosis. A randomized clinical study. J Bone Joint Surg Am87(10):2155–2159
[19] Thiryayi WA, Thiryayi SA, Freemont AJ (2008) Histopathological per- spective on bone marrow oede- ma, reactive bone change and hae- morrhage. Eur J Radiol 67(1):62–67
[20] Meizer R, Radda C, Stolz G et al (2005) MRI-controlled analysis of 104 patients with painful bone marrow edema in different joint lo- calizations treated with the prosta- cyclin analogue iloprost. Wien KlinWochenschr 117(7–8):278–286
[21] Aigner N, Petje G, Schneider W et al (2005) Bone marrow edema syn- drome of the femoral head: treat- ment with the prostacyclin analo- gue iloprost vs. core decompressi- on: an MRI-controlled study. Wienin Wochenschr 117(4):130–135
[22] Baier C, Schaumburger J, Götz J et al (2012) Bisphosphonates or pro- stacycline in the treatment of bo- ne-marrow oedema syndrome of the knee and foot. Rheum Int Nov10
[23] Radke S, Kirschner S, Seipel V et al (2003) Treatment of transient bo- ne marrow oedema of the hip – a comparative study. Int Orthop27(3):149–152
[24] Plenk H Jr, Hofmann S, Eschberger J et al (1997) Histomorphology and bone morphometry of the bone marrow edema syndrome of the hip. Clin Orthop Relat Res 334:73–84
[25] Wilson AJ, Murphy WA, Hardy DC, Totty WG (1988) Transient osteoporosis: transient bone mar- row edema? Radiology 167(3):757–760
[26] www.aerzteblatt/archiv/53506
[27] Charles P. Hannon, MD‘, Steve Bayer, BA7, Christopher D. Murawski, MD, Gian Luigi Canata, MD, Thomas O. Clanton, MD‘, Daniel Haverkamp, MD, PhD’, Jin WooLee, MD, PhD‘, Martin J. O’Malley, MD’, Hua Yinghui, MD, PhD®,James W. Stone, MD? and the International Consensus Groupon Cartilage Repair of the Ankle Debridement, Curettage, and Bone Marrow Stimulation: Proceedings of the International Consensus Meeting on Cartilage Repair of the Ankle Foot & Ankle Internationak 2018, Vol. 39(1S) 165-22$
[28] Madry H, van Dijk CN, Mueller-Gerbl M. The basic science of the subchondral bone. Knee Surg Sports Traumatol Arthrosc 2010; 18:419-433 [PMID: 20119671 DOI: 10.1007/s00167-010-1054-z]
[29] Nakasa T, Adachi N, Kato T, Ochi M. Appearance of Subchondral Bone in Computed Tomography Is Related to Cartilage Damage in Osteochondral Lesions of the Talar Dome. Foot Ankle Int 2014; 35: 600-606 [PMID: 24677221 DOI: 10.1177/1071100714528493]
[30] Verhagen RA, Maas M, Dijkgraaf MG, Tol JL, Krips R, van Dijk CN. Prospective study on diagnostic strategies in osteochondral lesions of the talus. Is MRI superior to helical CT? J Bone Joint Surg Br 2005; 87: 41-46 [PMID: 15686236]
[31] Meftah M, Katchis SD, Scharf SC, Mintz DN, Klein DA, Weiner LS. SPECT/CT in the management of osteochondral lesions of the talus. Foot Ankle Int 2011; 32: 233-238 [PMID: 21477540 DOI: 10.3113/FAI.2011.0233]
Autoren
ist seit 2005 Gesellschafter im sporthopaedicum. Sein Schwerpunkt ist die konservative und operative Versorgung von Erkrankungen und Verletzungen des Sprunggelenkes und Fußes. Zudem beschäftigt er sich intensiv mit der Behandlung von Sportverletzungen und ist Mitglied im Vorstand der Gesellschaft für Arthroskopie und offene Gelenkchirurgie (AGA).