Das SARS-CoV-2 verursacht die multisystemische COVID-19 Erkrankung. Es greift zunächst die Atemwege an, schwere Krankheiten beginnen oft mit einer Lungenentzündung. Bei der Influenza ist die Infektion auf die Lunge beschränkt. Extrapulmonale Komplikationen wie Myositis, Rhabdomyolyse und Myoglobinurie sind möglich, aber normalerweise nicht prognostisch. COVID-19 ist anders. Das Virus infiziert und zerstört hauptsächlich die Endothelien und verursacht somit eine systemische Erkrankung.
Kardiales System
Eine für Sportler spezielle Bedeutung besitzt bei einer Infektion mit SARS-CoV-2 eine mögliche Mitbeteiligung des Myokards [4], da die Myokarditis zu den führenden Ursachen des plötzlichen Herztods im Sport bei Sportlern < 35 Jahre zählt [5]. Im Rahmen einer COVID-19 Erkrankung werden im Rahmen schwerer Verläufe fulminante Myokarditiden beschrieben [6] mit einer mit der Prognose korrelierenden deutlichen Erhöhung der Troponin-Werte [4]. Unklar ist weiterhin, ob auch bei milden Verläufen oder asymptomatischen SARS-CoV-2–positiven Patienten das Risiko einer Myokarditis besteht. Puntmann et al., konnten in einem älteren Patientenkollektiv mittels Kardio-MRT in 78 % eine Herzbeteiligung nachweisen sowie eine anhaltende myokardiale Entzündung bei 60 %, unabhängig von bereits bestehenden Vorerkrankungen, Schweregrad und Gesamtverlauf der akuten Krankheit [7]. Eine aktuelle Analyse im High-School Sport zeigte bei jungen Sportlern nach asymptomatischer oder leichter Erkrankung mit Normalbefunden im EKG, hs-cTn-Werten und Echokardiographie in 15 % (nur Männer) myokardiale Entzündungszeichen im Kardio-MRT und eine 46 % Prävalenz milder LGE ohne Hinweise auf eine aktiven Entzündung [8].
Es scheint auch bei leichten COVID-19 Verläufen eine potenzielle Gefahr für Herzmuskelpathologien zu bestehen.
Wilson et al. empfehlen, dass die Bestimmung des kardialen Serum-Troponin auf Sportler mit anhaltenden Symptomen beschränkt werden sollte, die Zeichen einer Myokarditis aufweisen oder eine beeinträchtigte Myokardfunktion in der Bildgebung zeigen [9]. Da die Troponinwerte auch unter Belastung ansteigen können, sollte vor Bestimmung eine Ruhephase von mindestens 48 Stunden bestehen [9, 10]. Eine routinemäßige Bestimmung wird nicht empfohlen, da es keine validierten Cut-Off Werte für eine Herzbeteiligung gibt [9]. Nieß et al. empfehlen bereits bei symptomfreien SARS-CoV-2–positiven Sportlern die Durchführung eines Ruhe-EKG. Bei symptomatischen Athleten mit und ohne Pneumonie sollte zusätzlich eine Echokardiographie und ein Belastungs-EKG durchgeführt werden [11]. Bei Hinweisen auf eine myokardiale Beteiligung im Sinne eines erhöhten Troponin-Wertes oder Auffälligkeiten in den o. g. Untersuchungen sollte die Indikation für ein Kardio-MRT großzügig gestellt werden [12]. Neben der myokardialen Beteiligung können auch akute Koronarsyndrome, Myokardinfarkte sowie thrombo-embolische Ereignisse in der Peripherie und der Lunge eintreten [6].
Generell ist für Sportler mit grippeähnlichen Symptomen bekannt, dass es nach viraler Infektion zu einer Myokarditis kommen kann. Auch bei der COVID-19 Erkrankung bestehen Hinweise, dass Herzmuskelzellen-Nekrosen bei fast jedem fünften Krankenhauspatienten auftreten können [13, 14]. EKG-Manifestationen können dabei unspezifische ST-Veränderungen sein, Umkehrungen der T-Welle oder ventrikuläre Arrhythmien. Die Herzbildgebung kann globale oder regionale Wandbewegungsstörungen zeigen, zusammen mit variablen Graden eines Perikardergusses. Wilson et al. propagieren deshalb einen kardialen RTP-Pathway [9], basierend auf möglichen Kombinationen aus positiver SARS-CoV 2 Testung und eingetretener Symptomatik. Ein RTP sollte erst nach Normalisierung der ventrikulären Funktion, Fehlen von Biomarker-Anzeichen einer Herzmuskel-Entzündung und Fehlen induzierbarer Arrhythmien erfolgen [15].
Respiratorisches System
Die häufigste Organbeteiligung bei einer Infektion mit SARS CoV-2 betrifft die Lunge. Nieß et al., bemerken, dass unter dem Aspekt der sportlichen Leistungsfähigkeit beachtet werden muss, dass möglicherweise schon geringe restriktive Veränderungen die maximale Ventilation einschränken und/oder die Atemökonomie stören können [11]. Besonders Störungen des Gasaustausches könnten die Leistungsfähigkeit einschränken. Potenzielle Langzeitfolge wäre die mögliche Entwicklung einer Rechtsherzbelastung. Nieß et al. empfehlen aufgrund der möglichen auch subklinischen Mitbeteiligung der Lunge in Abhängigkeit von der klinischen Einordnung Im Rahmen der Abklärung eines RTP bei symptomatischen Sportlern ohne stattgehabte Pneumonie eine Spirometrie und Ergometrie mit Messung der Sauerstoffsättigung, die häufig mit vorbestehenden Routine-Untersuchungen verglichen werden können. Sollte eine Pneumonie vorgelegen haben, wird eine Spiroergometrie möglichst mit Blutgasanalyse (Analyse v.a. der Messgrößen der Atemeffizienz (Atemäquivalente)) und ggf. auch eine Messung der Diffusionskapazität empfohlen [11].
Viele Sportler berichten über anhaltenden Husten und Atemnot nach einer Infektion, vor allem bei intensiver körperlicher Belastung. Es wird angenommen, dass die Symptome in den meisten Fällen vollständig innerhalb von vier Wochen verschwinden. Dementsprechend sollte auf jede Verschlechterung eine sofortige ärztliche Re-Evaluation erfolgen und das RTP-Programm ist bis zur klinischen Aufarbeitung zu unterbrechen. In diesen Fällen werden eine Bildgebung (Thorax Röntgen), D-Dimer-Bestimmung und Lungenfunktionstests empfohlen [9]. Chronische post-COVID-19 Atemwegsbeschwerden können umfassen: Atemnot bei Anstrengung, neues Auftreten oder Fortbestehen eines Post-COVID Husten und Keuchen und/oder Engegefühl in der Brust. Zu berücksichtigen ist, dass bei Leistungssportlern eine hohe Prävalenz von vorbestehenden Atemwegserkrankungen besteht. Etwa jeder 4. Ausdauersportler zeigt Hinweise auf Atemwegsstörungen (z. B. Asthma ± durch körperliche Betätigung hervorgerufene Bronchokonstriktion), die häufig erst im Rahmen von Screening-Untersuchungen identifiziert werden [16, 17]. Entsprechend können diese Begleiterkrankungen unterdiagnostiziert werden. Unbehandelte Atemwegserkrankungen, die durch eine COVID-19-Infektion verschlimmert wurden, sollten nicht übersehen werden. Wilson et al. propagieren deshalb neben dem kardialen RTP-Pathway auch einen respiratorischen RTP-Pathway [9].
Weitere Organmanifestationen: Bei etwa einem Drittel der Erkrankten können neurologische Symptome wie Kopfschmerzen, Schwindel, Beeinträchtigung von Geschmacks- und Riechvermögen aber auch zentrale thromboembolische Komplikationen mit Schlaganfällen auftreten [18, 19]. Daneben treten gehäuft Muskelschmerzen und ein Fatigue-Symptomatik auf [20, 21].
Grundlagen für ein Return-to-Play (RTP)
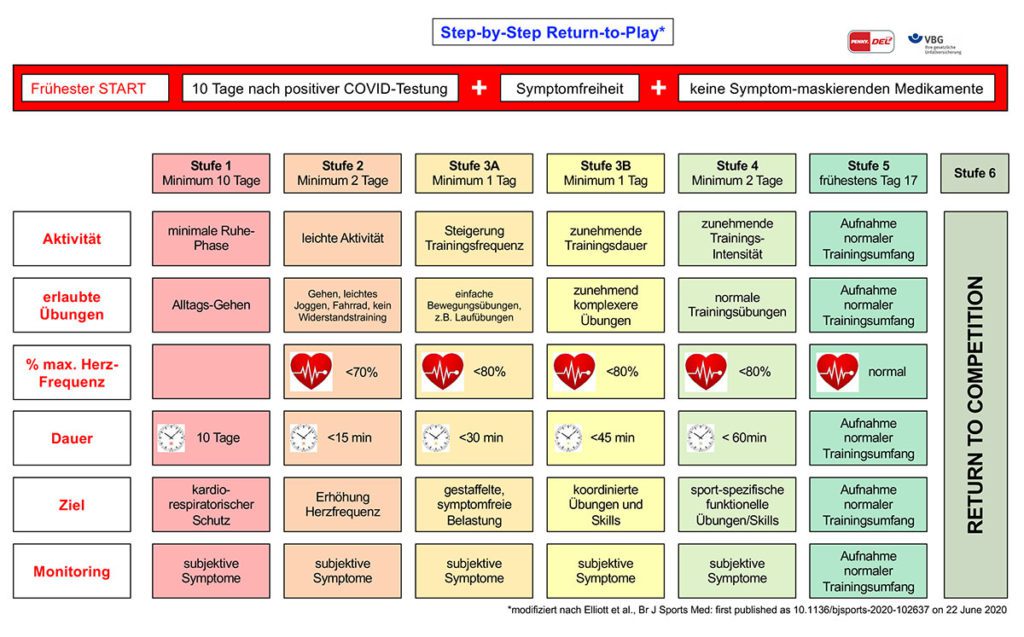
Zwingende Grundlage für ein RTP ist entsprechend der aufgeführten postinfektiösen Risiken eine ärztliche, sportmedizinische Untersuchung [22]. Aus praktischer Sicht scheint eine Kategorisierung der Fälle anhand der klinischen Symptome und der pulmonalen und kardialen Befunde sinnvoll zu sein. Dabei wird zwischen vier und sechs Kategorien unterschieden, wobei letztere auch die sehr schweren Zustände integrieren [9 – 11, 15, 23, 24]. Anhand dieser Kategorien werden unterschiedliche Diagnostiken empfohlen, die schwere-abhängig einzusetzen sind und entsprechend an Invasivität zunehmen. Auch können mit einer derartigen Kategorisierung die Dauer der Sportkarenz angepasst werden. Nieß et al. empfahlen bereits ein abgestuftes RTP, ohne darauf detailliert weiter einzugehen [11]. Elliot et al. publizierten ein entsprechendes Konzept mit einer abgestuften Wiederaufnahme der körperlichen Belastung [25]. Voraussetzung für den Beginn dieser gestaffelten Wiedereingliederung ist, dass der Athlet in der Lage ist, Aktivitäten des täglichen Lebens ohne Symptomverschlechterung durchzuführen und 500 Meter außerhalb der Wohnung zu gehen, ohne dass übermäßige Müdigkeit oder Atemlosigkeit eintritt. Es sollte mindestens zehn Tage Pause eingehalten worden sein und der Athlet sollte sieben Tage beschwerdefrei gewesen sein. Bei Auftreten von Symptomen (einschließlich übermäßiger Müdigkeit) beim Durchlaufen des RTP, soll der Athlet, wie im Concussion-Protokoll, zur vorherigen Stufe zurückkehren und nach einem Minimum von 24 Stunden Ruhezeit ohne Symptome die Belastung wieder aufnehmen. Zusätzlich werden verschiedene Diagnostiken empfohlen: Blutuntersuchung auf Entzündungsmarker (hochempfindliches Troponin, Natriuretisches Peptid und CRP), renale und hämatologische Parameter, 12-Kanal EKG, Echokardiogramm, Belastungstoleranz Test und Kardio-MRT, Spirometrie.
Für ein RTP ist somit einerseits eine gestaffelte Wiedereingliederung gefordert, als auch eine symptom-abhängige Diagnostik.
Return-to-Play Protokolle
Verschiedene RTP-Protokolle wurden mittlerweile publiziert [9 – 11, 15, 24]. Zusätzlich empfehlen Elliot et al. die abgestufte Wiederaufnahme der körperlichen Belastung [25]. Basierend auf den aus diesen Arbeiten ableitbaren Empfehlungen erfolgte eine Patienten-Kategorisierung. Anhand dieser Kategorisierung wurde basierend auf den Empfehlungen auch eine entsprechende Anamneseerhebung, laborchemische Untersuchungen und spezielle Diagnostiken integriert. Ein Schwerpunkt liegt auf der kardiovaskulären Evaluation. Dies ist dadurch mitbegründet, dass Sportler subjektiv eher einfacher erkennen, ob Atmungsstörung unter Belastung vorliegt, während kardiale Symptome nicht unbedingt erkannt werden können. Aus praktischer Sicht ist natürlich ein einheitliches Vorgehen im Mannschaftssport sinnvoll, um auch den Team-Verantwortlichen von vornherein eine klare Aussage zu geben, ab wann mit einem RTP zu rechnen ist.
Fazit
Zusammenfassend ergab die Analyse der angegebenen RTP-Protokolle folgende generelle Empfehlungen:
- ein RTP für Sportler mit positivem SARS-CoV-2 Test ohne COVID-19 Symptomatik ist somit unter
Berücksichtigung der Dauer einer Isolierung/Quarantäne frühestens nach 17 bzw. 21 Tagen sinnvoll. - ein RTP für Sportler mit positivem SARS-CoV-2 Test und temporärer leichter COVID-19 Symptomatik sollte frühestens nach 3 Wochen erfolgen
- bis zum vollständigen RTP vergehen nach Pneumonie im Mittel 5 Wochen
- bei Vorliegen einer Myokarditis erfolgt keine sportliche Belastung für mindestens 3 Monate; für das Management der Myokarditis im Sport sind bereits Handlungsempfehlungen publiziert [12, 26, 27]
Voraussetzung für das RTP ist immer die 72-stündige Symptomfreiheit (da Geruchs- und Geschmacksstörungen oft lange persistieren, müssen diese Symptome nicht zwingend abgeklungen sein) und Normalwerte der kardiorespiratorischen Stresstestung.
Die Beurteilung von Leistungssportlern mit Myokarditis(-Verdacht) sollte durch einen Sport-Kardiologen erfolgen. Ein entsprechendes Netzwerk ist zu etablieren.
Literatur
1. Xie, Y., et al., Comparative evaluation of clinical manifestations and risk of death in patients admitted to hospital with covid-19 and seasonal influenza: cohort study. BMJ. 2020; 371: m4677. Published online 2020 Dec 15. doi: 10.1136/bmj.m4677, 2020.
2. Meinhardt, J., et al., Olfactory transmucosal SARS-CoV-2 invasion as a port of central nervous system entry in individuals with COVID-19. Nat Neurosci, 2020. 2020 Nov 30. doi: 10.1038/s41593-020-00758-5. Online ahead of print.
3. Udelson, J., M. Curtis, and E. Rowin, Return to Play for Athletes After Coronavirus Disease 2019 Infection – Making High-Stakes Recommendations as Data Evolve. JAMA Cardiol; Published online October 26, 2020, 2020. doi:10.1001/jamacardio.2020.5896.
4. Shi, S., et al., Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol, 2020. 5: p. 802-810, doi: 10.1001/jamacardio.2020.0950.
5. Bohm, P., J. Scharhag, and T. Meyer, Data from a nationwide registry on sports-related sudden cardiac deaths in Germany. Eur J Prev Cardiol, 2016. 23: p. 649-656; doi: 10.1177/2047487315594087.
6. Madjid, M., et al., Potential Effects of Coronaviruses on the Cardiovascular System: A Review. JAMA Cardiol, 2020. 5: p. 831-840; doi: 10.1001/jamacardio.2020.1286.
7. Puntmann, V., et al., Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). JAMA Cardiol, 2020. Jul 27:e203557. doi: 10.1001/jamacardio.2020.3557.
8. Rajpal, S., et al., Cardiovascular Magnetic Resonance Findings in Competitive Athletes Recovering From COVID-19 Infection. JAMA Cardiol, 2020. e204916. doi: 10.1001/jamacardio.2020.4916.
9. Wilson, M., et al., Cardiorespiratory considerations for return-to-play in elite athletes after COVID-19 infection: a practical guide for sport and exercise medicine physicians. Br J Sports Med, 2020. 54: p. 1157-1161. doi: 10.1136/bjsports-2020-102710.
10. Kim, J., et al., Coronavirus Disease 2019 and the Athletic Heart: Emerging Perspectives on Pathology, Risks, and Return to Play. JAMA Cardiol, 2020: p. Oct 26. doi: 10.1001/jamacardio.2020.5890.
11. Nieß, A., et al., Position stand: return to sport in the current Coronavirus pandemic (SARSCoV-2 / COVID-19). . Dtsch Z Sportmed. 2020, 2020. 71: p. E1-E4.
12. Halle, M., et al., Myocarditis in athletes: A clinical perspective. Eur J Prev Cardiol, 2020. Mar 3:2047487320909670. doi: 10.1177/2047487320909670.
13. Sala, S., et al., Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J, 2020. 41: p. 1861-1862. doi: 10.1093/eurheartj/ehaa286.
14. Inciardi, R., et al., Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol, 2020. 5: p. 819-824. doi: 10.1001/jamacardio.2020.1096.
15. Phelan, D., J. Kim, and E. Chung, A Game Plan for the Resumption of Sport and Exercise After Coronavirus Disease 2019 (COVID-19) Infection. JAMA Cardiol, 2020(May 13. doi: 10.1001/jamacardio.2020.2136).
16. Hull, J., et al., Managing respiratory problems in athletes. Clin Med (Lond), 2012. 12: p. 351-6. doi: 10.7861/clinmedicine.12-4-351.
17. Ansley, L., et al., Misdiagnosis of exercise-induced bronchoconstriction in professional soccer players. Allergy, 2012. 67: p. 390-395. doi: 10.1111/j.1398-9995.2011.02762.x.
18. Helms, J., et al., Neurologic Features in Severe SARS-CoV-2 Infection. N Engl J Med, 2020. 382: p. 2268-2270. doi: 10.1056/NEJMc2008597.
19. Mao, L., et al., Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol, 2020. 77: p. 683-690. doi: 10.1001/jamaneurol.2020.1127.
20. Borges do Nascimento, I., et al., Novel Coronavirus Infection (COVID-19) in Humans: A Scoping Review and Meta-Analysis. J Clin Med, 2020. 9: p. 941. doi: 10.3390/jcm9040941.
21. Wang , J., M. Zhou, and F. Liu, Reasons for healthcare workers becoming infected with novel coronavirus disease 2019 (COVID-19) in China. J Hosp Infect, 2020. 105: p. 100-101. doi: 10.1016/j.jhin.2020.03.002.
22. Corsini, A., et al., Football cannot restart soon during the COVID-19 emergency! A critical perspective from the Italian experience and a call for action. Br J Sports Med, 2020. 54: p. 1186-1187. doi: 10.1136/bjsports-2020-102306.
23. Barker-Davies, R., et al., The Stanford Hall consensus statement for post-COVID-19 rehabilitation. Br J Sports Med, 2020. 54: p. 949-959. doi: 10.1136/bjsports-2020-102596.
24. Löllgen, H., et al., Recommendations for return to sport during the SARS-CoV-2 pandemic. BMJ Open Sport & Exercise Medicine, 2020. 6:e000858. doi:10.1136/bmjsem-2020-000858.
25. Elliott, N., et al., Infographic. Graduated return to play guidance following COVID-19 infection. Br J Sports Med, 2020. 54: p. 1174-1175. doi: 10.1136/bjsports-2020-102637.
26. Eichhorn, C., et al., STATE-OF-THE-ART REVIEW. Myocarditis in Athletes Is a Challenge. Diagnosis, Risk Stratification, and Uncertainties. J Am Coll Cardiol Img, 2020. 13: p. 494–507. doi.org/10.1016/j.jcmg.2019.01.039.
27. Verwoert, G., et al., Return to sports after COVID-19: a position paper from the Dutch Sports Cardiology Section of the Netherlands Society of Cardiology. Neth Heart J, 20230. 28: p. 391-395. doi: 10.1007/s12471-020-01469-z.
Autoren
ist Facharzt für Chirurgie, Unfallchirurgie und Orthopädie a der Klinik für Unfallchirurgie, Orthopädie und Handchirurgie, Klinikum Wolfsburg. Außerdem ist er Mannschaftsarzt des DEL Eishockeyteams „EHC Grizzlys Wolfsburg“.
ist Facharzt für Allgemeinmedizin und Mannschaftsarzt der EHC Grizzlys Wolfsburg.
ist Facharzt für Innere Medizin und Kardiologie mit Zusatzbezeichnungen Sportmedizin und Präventivmedizin. Er leitet mit seinem Partner Dr. Kleinschrot eine Gemeinschaftspraxis mit Schwerpunktbezeichnung Kardiologie in Würzburg.
ist Facharzt für Allgemeinmedizin mit Zusatzbezeichnungen Sportmedizin, Chirotherapie
und Präventivmedizin mit eigener Praxis (gemeinsam mit Frank Emschermann) in Nordwalde. Außerdem ist er Teamarzt der Iserlohn Roosters (Eishockey DEL).