Zentrales Anliegen der Injektionstherapie bei Osteoarthrose ist die Verzögerung der zellulären Destruktion wie auch des Verlustes der funktionellen Gelenkintegrität. Schmerzlinderung, Funktionsverbesserung und Entzündungshemmung sind Erfolgsparameter der Therapie. Sogenannte Biologika haben neben analgetischer und antiinflammatorischer Wirkung Einfluss auf funktionell/strukturell reparative Prozesse und verzögern so den Gelenkersatz.
Biologika sind Produkte humanen, tierischen oder auch mikrobiellen Ursprungs. Vollblutprodukte, Zellen, Gentherapie und rekombinante Proteine werden dazu gezählt [1 – 3]. Platelet Rich Plasma (PRP), Hyaluronate (HS als Bioäquivalent) und immunomodulatorische Moleküle wie Autologous Conditioned Serum (ACS), – Synonym: Blood-Cell Secretome (BCS) gelten als Injektate der ersten Wahl. In zweiter Linie folgen Bone Marrow Aspirate Concentrate (BMAC), mikrofragmentierte Fettpräparationen (MF), Stromal Vascular Fraction (SVF), mesenchymal stem cells (MSCs) und das sogenannte amniotic membrane product (AM). Diese Produkte vermitteln physiologische Aktivitäten durch immunmodulierende Prozesse und Beeinflussung der Gewebetrophik. Entzündungshemmung innerhalb geschädigter Gewebe sowie die Aktivierung von Wachstumsfaktoren und anderer regulatorischen Proteine können den Gewebeerhalt respektive die -reparatur fördern [4]. Im Folgenden werden allgemein verwendete Biologika vorgestellt und eine Bewertung der gegenwärtigen klinischen Evidenz der Effektivität der Behandlung von Gonarthrosen und chondralen Läsionen vorgenommen. Kurzgefasst erfolgt eine Beschreibung des Wirkmechanismus.
Intraartikuläre Hyaluronsäure (IAHS)
Intraartikuläre Viskosupplementation mit HS ist seit Dekaden Standard der klinischen Osteoarthrosebehandlung. Ihre Bedeutung leitet sich von der zunehmenden Anzahl hochwertiger Publikationen der letzten fünf Jahre ab. In der Vergangenheit wurde der rheologische und mechanische Pufferungseffekt als Haupteigenschaft der Substanz propagiert. Aktuelle Erkenntnisse über molekulare Interaktionen der IAHS mit zellulären Rezeptormolekülen machen das antiinflammatorische Potenzial der Substanz verständlich. Die Degradation der nativen hochmolekularen HS als Folge der fortschreitenden Osteoarthrose führt zum Anfall vieler kleinfragmentierter linearer HS-Stränge, die als Liganden zellulärer Rezeptoren (CD 44; ICAM 1; RHAM; TLR; LAYN) dienen, welche die proinflammatorischen Prozesse der Arthrose befeuern. Therapeutische IAHS wird nach Molekulargewicht eingeteilt (Abb. 1 [26] Hochmolekulare HS (HMHS), die insbesondere durch Stabilisierung oder Cross-Linking vor beschleunigtem Abbau durch Hyaluronidasen geschützt ist, ist hier therapeutisch besonders geeignet. HMHS kann mehrere Bindungsstellen der CD 44 Rezeptoren belegen und somit deren antiinflammatorische Aktivierung innerhalb der Zelle anregen. Kurze HS-Fragmente (< 10 Subeinheiten) gehen nur eine suboptimale Bindung zu einer begrenzten Anzahl CD 44 Rezeptoren ein. Zur optimalen divalenten Rezeptorbindung zwischen mehreren Rezeptoren werden mindestens 20 Einheiten benötigt [8]. HMHS sind in der Lage, proinflammatorische Zytokine zu supprimieren [9 – 12], auch Matrix Metalloproteinasen (MMP) und Proteoglykane [11] sowie die Prostaglandin E2 (PGE2) Synthese [13 – 17] und -Produktion werden beeinflusst [18 – 20]. HMHS unterdrückt die PGE2 Bildung via CD44 über eine Downregulation des NF-κB – Komplexes [21]. Die Absenkung der MMP-Levels erfolgt über eine indirekte Anhebung der „Tissue Inhibitor of Metalloproteinase-1 (TIMP-1) [22]. Mit überlegener Wirkung durch HMHS werden Effektormoleküle der Entzündung signifikant gesenkt und die Arthrosekrankheit in ihrer Radikalität gebremst. Einige Autoren sprechen von krankheitsmodifizierendem Potenzial der stabilisierten HMHS [5 – 7].

IAHS und Gonarthrose
Sicherheit und Wirksamkeit der HS als Therapieoption bei der GA bestätigen sich in einer Vielzahl von RCTs [23, 6]. Auch die Überlegenheit im Vergleich zu anderen Behandlungsmethoden rechtfertigt den lokalen Einsatz im Vergleich zur systemischen Therapie mit NSAR oder Opioden [24, 25]. Auch im Vergleich mit anderen i.a.-Injektaten schneiden IAHS besser ab, wenngleich dies explizit für HMHS im Vergleich zu niedermolekularen HS gilt [26, 27]. Einzelinjektionen mit hohem Intervall zeigen keinen Nachteil gegenüber Multiinjektionsprotokollen. Für die Single-Injektion bedeutet die verlängerte intraartikuläre Persistenz der stabilisierten HMHS eine Risikominimierung für das invasive Vorgehen [28]. Im Vergleich zu intraartikulären Kortikosteroiden (IAKS) liegt der initiale Vorteil, was Schmerzreduktion und Funktionsgewinn betrifft, auf Seiten der IAKS; nach drei Wochen überragen jedoch die HS [29]. In der Gonarthrose-Therapie liegen ähnliche Wirksamkeiten für HS und PRP vor, HMHS zeigt jedoch sowohl klinisch als auch statistisch signifikante Überlegenheit, PRP erscheint in der GA-Therapie mit hohen Standardabweichungen, was die klinische Vorhersagbarkeit der Anwendung deutlich einschränkt [25, 26].
Platelet-Rich Plasma (PRP)
PRP ist autologes in Plasma gelöstes Thrombozytenkonzentrat [30]. Durch PRP Injektion an den Zielort erfolgt die Rekrutierung, Proliferation und Aktivierung von regenerativen Zellen über die Freisetzung von Wachstumsfaktoren [31]. Auch adhäsive Proteine, Gerinnungsfaktoren, fibrinolytische Faktoren, Proteasen, Cytokine, antimikrobiale Proteine und Membranoglykoproteine dienen dieser Mission [32]. Direkt nach Injektion der PRP-Suspension kommt es zur Thrombozytenaktivierung und 70 % der Wachstumsfaktoren werden innerhalb von zehn Minuten freigesetzt [30]. Bemerkenswerte Variationen in der Herstellung der PRP-Suspension machen die Vergleichbarkeit einzelner Produkte schwierig, da keine stabile Reproduzierbarkeit der Einzelanwendung zu erzielen ist. So steht die Leukozytenkonzentration – leukozytenreiche (LR-PRP) und leukozytenarme (LP-PRP) – als variable Größe der einzelnen Zubereitungen von PRP zur Diskussion [33]. LR-PRP enthält mehr proinflammatorische Zytokine [34], weswegen LP-PRP für die intraartikuläre Anwendung besser geeignet zu sein scheint. Oh et al. stellte diese Ergebnisse durch eigene Befunde in Frage [35]. Weitere Unterschiede finden sich in der Thrombozytenkonzentration und deren variabler Aktivierung bei verschiedenen Produkten. Technisch erfolgt die Gewinnung der verschiedenen PRPs auf dem Prinzip der Zentrifugierung zur Separation der einzelnen Bestandteile. Eine Standardisierung der Herstellungsverfahren sowie der Diagnosen-bezogenen Anwendung erscheint sinnvoll. Auch die Behandlung mit PRP findet überwiegend auf molekularer und Zellrezeptorebene statt und reguliert im Wesentlichen antiinflammatorische und proliferative Prozesse des Zellstoffwechsels [36].
PRP bei Gonarthrose
Intraartikuläre Anwendungen von PRP Anwendungen zur Behandlung von Gelenk- und Knorpelpathologien können nach Studienlage den Progress chondraler Läsionen verhindern oder zumindest verzögern [37, 38]. In vitro zeigten Braun et al. erhöhte synoviale Zelltotraten bei Verwendung von LR-PRP im Vergleich zu LP-PRP [39]. Klinisch konnten Riboh et al. in einer Metaanalyse den Vorteil von LP-PRP bei Gonarthrose bezüglich des funktionellen Outcomes bestätigen [33]. Cole et al. berichteten in ihrer prospektiven randomisierten kontrollierten Doppelblindstudie bei 111 Patienten mit milder bis moderater GA, die PRP oder HS erhielten, keinen Unterschied im WOMAC Score; im IKDC- und im VAS-Score schnitt die mit PRP behandelte Gruppe besser ab [40]. Cherza et al. zeigten im direkten Vergleich zwischen ACP (LP-PRP) und Hyaluronsäure signifikante Überlegenheit von ACP [41]. Der Nachweis der Überlegenheit von PRP gegenüber HS steht letztlich bei Chondropathien des Kniegelenkes aus [42, 43].
Kombinierte IAHS – und PRP – Therapie bei Gonarthrose
PRP und IAHS gewinnt zunehmend als Konjugattherapie der GA an Bedeutung. Der intraartikulären Therapie wird hierbei ein synergistischer Effekt zugeschrieben, welcher sich mutmaßlich in einer signifikanten Verbesserung klinischer Erfolgsparameter wie Schmerz und Funktion ausdrücken soll [44 – 46]. Jedoch liegt bisher nur eine sehr limitierte Anzahl von Studien zur Anwendung von PRP/IAHS Kombinationen vor. So gibt es zurzeit nur eine Metaanalyse zum Vergleich PRP/IAHS vs. PRP [48]. Eine weitere evaluierte die klinische Wirksamkeit von PRP/IAHS gegen IAHS in der GA-Behandlung [47]. In dieser Analyse konnten bessere Ergebnisse auf Seiten der PRP/IAHS Kombination nachgewiesen werden, jedoch fanden nur 4/386 Studien die Eingangsberechtigung. Der Autor diskutierte weitere Schwächen der Studie, so ergaben sich Inkonsistenzen bei den verwendeten PRP Zubereitungen (LR vs. LP-PRP) sowie bei der Kontrollgruppe der IAHS (Molekularstruktur und -gewicht differierten weit) [47]. Die Kombination aus PRP und IAHS kann zusammenfassend als eine interessante Option in der GA-Therapie aufgefasst werden. Dennoch bleibt der wissenschaftliche Nachweis der überlegenen Synergie beider Komponenten abzuwarten, bis Studien in entsprechender Qualität die angeführten Kritikpunkte ausräumen. Eine Qualität sichernde Standardisierung des PRP / IAHS Protokolls könnte so eine günstige Bereicherung des intraartikulären Therapiespektrums in der Hand des konservativen Spezialisten sein.
Autologous Conditioned Serum (ACS) / Blood-Cell Secretome (BCS)
BCS ist definiert als autologes Serum, welches mit Produkten der Thrombozyten- und Leukozytendegranulation angereichert ist [49]. Die Behandlung ist azellulär und Produkt einer Inkubation von venösem Blut in speziellen BCS-Spritzensystemen [50]. Nach Exposition des Blutes mit den inneren Oberflächen des Spritzensystems produzieren die Blutzellen antiinflammatorische Zytokine, wie z. B. Interleukin (IL)-1 Rezeptorantagonisten (IL-1RA), IL-4 oder IL10 [51]. Im Gegensatz zu PRP enthält BCS keine Additive (z. B. Antikoagulantien) und benötigt nur eine Blutabnahme [50]. Als wichtigsten Unterschied zur PRP hat BCS ein anderes Zytokinprofil. Es zeigen sich hohe Konzentrationen von IL-1 RA, was dem Serum ein ausgesprochen antiiflammatorisches Profil verleiht [50]. Bei Patienten mit erhöhten CRP (C-reaktives Protein) Leveln als Hinweis auf ein vorbestehendes Entzündungsgeschehen zum Zeitpunkt der Blutabnahme sollte eine BCS-Behandlung nicht durchgeführt werden, da es hier zum Zytokinshift in Richtung proinflammatorischer Faktoren kommen kann [52]. Dies kann zu einer verstärkten Immunreaktion mit Verstärkung der inflammatorischen Antwort nach BCS-Injektion führen [51,52].
ACS/BCS bei Gonarthrose
Zwei verwertbare RCTs berichten über die ACS / BCS Therapie bei GA. Eine Studie randomisierte drei Patientengruppen mit GA zu i. a. Injektionen mit ACS, HS oder Kochsalzlösung. Im Vergleich zu HS und NaCl 0.9 % zeigte ACS anhand des WOMAC Index, des Global Patient Assessment und der VAS Scores nach 7, 13, und 26 Wochen follow-up eine bessere Wirksamkeit, die klinisch bedeutsam war [53]. Unterstützung fanden diese Ergebnisse durch einen weiteren RCT, in welchem ACS Injektionen Kochsalzinjektionen (Placebo) gegenübergestellt wurden. Hier zeigte die Gruppe der mit ACS behandelten Patienten eine deutliche Verbesserung der KOOS Symptome und Sport Parameter, jedoch zeigte sich kein Unterschied im primären Endpunkt des WOMAC Scores [54].
Diskussion
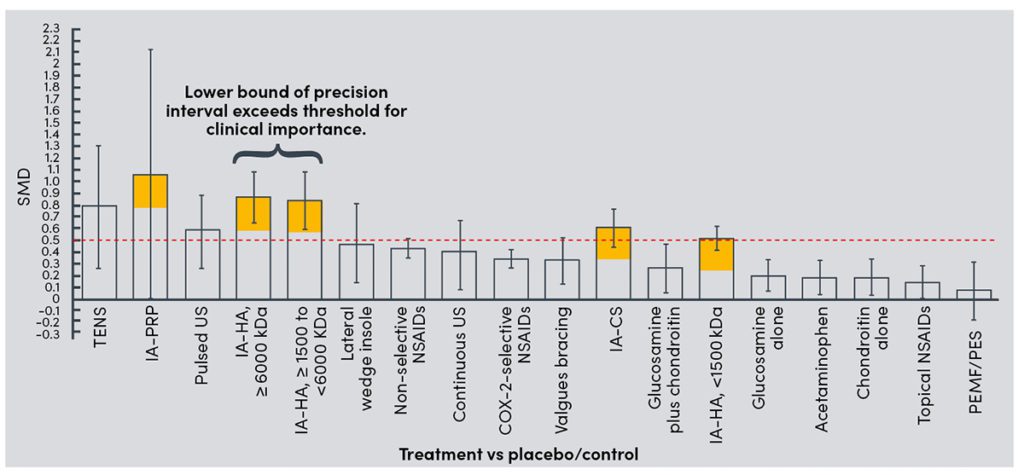
In der konservativen Therapie der GA ist ein einheitliches leitliniengerechtes Handeln nicht möglich (Anmerkung der Redaktion: Gemeinsam mit seinen Autoren möchte die sportärztezeitung in diesem Bereich Ordnung und Struktur schaffen. Dazu sind in den vergangenen Ausgaben einige Artikel erschienen, z. B. Dr. Catalá-Lehnen / Juliane Wieber „HA bei Gonarthrose“ oder Dr. Ralf Doyscher / Dr. Martin Barsch „Injizierbare Blutderivate“, beide erschienen in der sportärztezeitung 01/21. Alle weiteren Artikel zu dieser Thematik finden Sie ebenfalls auf der Homepage). Bei zunehmenden Hinweise auf komplikationsreiche Konsequenzen der oralen Arthrosetherapie (NSAR, COX-2 Inh., Opiode) sowie altersbedingter Komorbidität der Patienten rücken nebenwirkungsärmere Alternativen (Anmerkung der Redaktion: Siehe dazu nebenwirkungsfreie Optionen: Alternative Nutrizeutika, Enzymtherapie etc., u.a. Dr. Klaus Pöttgen / PD Dr. Thilo Hotfiel „Alternative zu NSAR/Schmerzmittel“ (sportärztezeitung 01/19), Dr. Christoph Michlmayr/ Dr. Pietro Lercher „Enzymtherapie“ (sportärztezeitung 04/ 20) und Dr. Paul Klein „Regenerative Optionen bei Gonarthrose – Nutrizeutika (Ernährung), orale Medikation & invasive Therapie (Injektion)“ Vortrag im Rahmen unserer Fortbildungsreihe „when therapy becomes training“) in den Vordergrund, besonders werden dann lokale therapeutische Strategie präferiert. Nach langen Erfahrungen und guter wissenschaftlicher Evidenz gilt die Hyaluronsäure als wirksam und sicher. Verschiedene HS unterscheiden sich in der GA-Therapie durch ihre Effektgrößen (EG) verglichen zur Placebo-Therapie (NaCl 0.9 %). So bleiben NMHS unterhalb der minimalen klinischen Wirksamkeit (MICD < 0.5). Höchste EG erreichen HMHS > 6000 kDa. Bowman [55] empfiehlt die fermentative Herstellung gegenüber avianen Produkten wegen der kostengünstigeren Herstellung und geringerer Nebenwirkungen. Im Übrigen gibt es Hinweise auf eine gute Wirksamkeit der HMHS auch bei höhergradigen GA (Grad 4) [56]. In großen Metaanalysen zeigt sich die klare Überlegenheit gegenüber oralen Therapien (s.o.) und allen anderen konservativen Verfahren. Nur PRP zeigte eine überragende EG. Wegen großer Standardabweichungen relativierte sich jedoch die Empfehlungsstärke, was die Vorhersagbarkeit des klinischen Effektes betrifft (siehe dazu Abb. 2). PRP unterliegt einer Vielzahl von Produktionsvarianten, womit die Inkohärenz der Studienlage erklärt wird. Allgemeine Standards im PRP-Protokoll könnten mit dieser Schwäche aufräumen. So scheint nach aktueller Literatur LP-PRP von günstigerer Wirkung in der GA-Therapie zu zeigen. Auch alters- und geschlechtsabhängige Variationen der Wachstumsfaktorenkonzentration bei PRP sollten bei der Behandlung unterschiedlicher Entitäten berücksichtigt werden. Ferner entscheiden auch intraindividuelle Schwankungen der PRP-Zusammensetzung bei wiederholten Injektionen über das klinische Ergebnis. Die Zubereitung von PRP ist einfach, vor allem das Doppelspritzenentnahmesystem bei ACP erleichtert das Prozedere enorm.
Die Kombinationstherapie PRP/IAHS erfreut sich zunehmender Anwenderbeliebtheit, jedoch sind fixe Therapiekombinationen kritisch zu sehen. Die Betrachtung der Einzelkomponenten sollte ebenso nach evidenzbasierten Kriterien erfolgen wie der wissenschaftliche Vergleich der Kombination mit verfügbaren intraartikulären Alternativen. Insbesondere wären hier RCTs gegen stabilisierte HMHS oder auch ein Vergleich mit PRP-Zubereitungen mit guter Studienlage bei GA hilfreich. Kritisch ist auch die niedrige Thrombozytenkonzentration in Konjugaten, welche durch zusätzliche Verwendung von LMHS noch eine weitere intraartikuläre Verdünnung erfährt. Es bleiben viele Fragen offen und klärende Studien sind notwendig. BCS ist ein gut untersuchtes Bioinjektat mit hoher antiinflammatorischer Wirksamkeit und als solches besonders für den Einsatz bei aktivierter Arthrose bzw. Arthrosen mit stark inflammatorischer Komponente geeignet [57]. Es gibt nur eine Blutentnahme, Tiefkühlung für die Wiederholungsinjektionen ist notwendig. In der Hand des Geübten steht eine gute Alternative in der i.a. Arthrosetherapie zu Verfügung.
Unter Berücksichtigung des Gesagten gibt der Autor eine Handlungsempfehlung (siehe Abb.1).
Literatur
1. Revers L, Furczon E: An introduction to biologics and biosimilars. Part I: biologics: what are they and where do they come from? Can Pharm J 2010;143:134–9
2. FDA: Framework for the Regulation of Regenerative Medicine Products. Available at: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/ framework-regulation-regenerative-medicine-products. Published 2019. Accessed May 21, 2019
3. FDA: Regulatory Considerations for Human Cells, Tissues, and Cellular and Tissue-Based Products: Minimal Manipulation and Homologous Use. Available at: https://www.fda.gov/ media/109176/download. Published 2017. Accessed July 2019
4. Marx RE: Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant Dent 2001;10:225
5.Altman R. Anti-Inflammatory Effects of Intra-Articular Hyaluronic Acid: A Systematic Review Cartilage 2019, Vol. 10(1) 43–52)
6. Maheu E et al. Why we should definitely include intra-articular hyaluronic acid as a therapeutic option in the management of knee osteoarthritis: Results of an extensive critical literature review; Seminars in Arthritis and Rheumatism Volume 48, Issue 4, February 2019, Pages 563-572
7. Gupta C et al. Hyaluronic Acid: Molecular Mechanisms and Therapeutic Trajectory Front Vet Sci 2019; 6: 192.
8. Lesley J, Hascall VC, Tammi M, Hyman R. Hyaluronan binding by cell surface CD44. J Biol Chem. 2000;275:26967-75.
9. Campo GM, Avenoso A, D’Ascola A, Prestipino V, Scuruchi M, Natashi G, et al. Inhibition of hyaluronan synthesis reduced inflammatory response in mouse synovial fibroblasts subjected to collagen-induced arthritis. Arch Biochem Biophys. 2012;518:42-52.
10. Goto H, Onodera T, Hirano H, Shimamura T. Hyaluronic acid suppresses the reduction of α2(VI) collagen gene expression caused by interleukin-1β in cultured rabbit articular chondrocytes. Tohoku J Exp Med. 1999;187:1-13.
11. Kataoka Y, Ariyoshi W, Okinaga T, Kaneuji T, Mitsugi S, Takahashi T, et al. Mechanisms involved in suppression of ADAMTS4 expression in synoviocytes by high molecular weight hyaluronic acid. Biochem Biophys Res Commun. 2013;432:580-5.
12. Sundman E, Cole B, Karas V, Della Valle C, Tetreault MW, Mohammed HO, et al. The anti-inflammatory and matrix restorative mechanisms of platelet-rich plasma in osteoarthritis. Am J Sports Med. 2014;42:35-41
13. Greenberg DD, Stoker A, Kane S, Cockrell M, Cook JL. Biochemical effects of two different hyaluronic acid products in a co-culture model of osteoarthritis. Osteoarthritis Cartilage. 2006;14:814-22.
14. Hiraiwa H, Sakai T, Mitsuyama H, Hamada T, Yamamoto R, Omachi T, et al. Inflammatory effect of advanced glycation end products on human meniscal cells from osteoarthritic knees. Inflamm Res. 2011;60:1039-48.
15. Santangelo KS, Johnson AL, Ruppert AS, Bertone AL. Effects of hyaluronan treatment on lipopolysaccharide-challenged fibroblast-like synovial cells. Arthritis Res Ther. 2007;9:R1.
16. Sasaki A, Sasaki K, Konttinen YT. Hyaluronate inhibits the interleukin-1β-induced expression of matrix metalloproteinase (MMP)-1 and MMP-3 in human synovial cells. Tohoku J Exp Med. 2004;204:99-107.
17. Yasuda T. Hyaluronan inhibits prostaglandin E2 production via CD44 in U937 human macrophages. Tohoku J Exp Med. 2010;220:229-35.
18. Hashizume M, Koike N, Yoshida H, Suzuki M, Mihara M. High molecular weight hyaluronic acid relieved joint pain and prevented the progression of cartilage degeneration in a rabbit osteoarthritis model after onset of arthritis. Mod Rheumatol. 2010;20:432-8.
19. Yasui T, Akatsuka M, Tobetto K, Hayaishi M, Ando T. The effect of hyaluronan on interleukin-1α-induced prostaglandin E2 production in human osteoarthritic synovial cells. Agents Actions. 1992;37:155-6.
20. Yoshioka K, Yasuda Y, Kisukeda T, Nodera R, Tanaka Y, Miyamoto K. Pharmacological effects of novel cross-linked hyaluronate, Gel-200, in experimental animal models of osteoarthritis and human cell lines. Osteoarthritis Cartilage. 2014;22:879-87.
21. Yasuda T. Hyaluronan inhibits prostaglandin E2 production via CD44 in U937 human macrophages. Tohoku J Exp Med. 2010;220:229-35.
22. Yasui T, Akatsuka M, Tobetto K, Hayakawa T. Effects of hyaluronan on the production of stromelysin and tissue inhibitor of metalloproteinase-1 (TIMP-1) in bovine articular chondrocytes. Biomed Res. 1992;13:343-8.
23. Cooper C, et al. Use of Intraarticular Hyaluronic Acid in the Management of Knee Osteoarthritis in Clinical PracticeArthritis Care & Research Vol. 69, No. 9, September 2017, pp 1287–1296 DOI 10.1002/acr.23204
24. Bannuru RR, Schmid CH, Kent DM, Vaysbrot EE, Wong JB, McAlindon TE. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis. Ann Intern Med. 2015;162(1):46‐54. doi:10.7326/M14-1231
25. Miller LE, Fredericson M, Altman RD. Hyaluronic acid injections or oral nonsteroidal anti-inflammatory drugs for knee osteoarthritis: systematic review and meta-analysis of randomized trials. Orthop J Sports Med. 2020;8(1):2325967119897909. doi:10.1177/2325967119897909
26. Vannabouathong C, Bhandari M, Bedi A, et al. Nonoperative treatments for knee osteoarthritis: an evaluation of treatment characteristics and the intra-articular placebo effect: a systematic review. JBJS Rev. 2018;6(7):e5. doi:10.2106/JBJS.RVW.17.00167
27. Phillips M, Vannabouathong C, Devji T, et al. Differentiating factors of intra-articular injectables have a meaningful impact on knee osteoarthritis outcomes: a network meta-analysis. Knee Surg Sports Traumatol Arthrosc. 2020;10.1007/s00167-019-05763-1. doi:10.1007/s00167-019-05763-1
28. Vincent P. Intra-articular hyaluronic acid in the symptomatic treatment of knee osteoarthritis: a meta-analysis of single-injection products. Curr Ther Res Clin Exp. 2019;90:39‐51. doi:10.1016/j.curtheres.2019.02.003
29. Bannuru RR, Natov NS, Obadan IE, Price LL, Schmid CH, McAlindon TE. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum. 2009;61(12):1704‐11. doi:10.1002/art.2492529.
30. Marx RE: Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant Dent 2001;10:225–8
31. Caplan AI, Correa D: The MSC: an injury drugstore. Cell Stem Cell 2011;9:11–5
32. Anitua E, Andia I, Ardanza B, et al: Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost 2004;91:4–15
33. Riboh JC, Saltzman BM, Yanke AB, et al: Effect of leukocyte concentration on the efficacy of platelet-rich plasma in the treatment of knee osteoarthritis. Am J Sports Med 44:792-800, 2016
34. Xu Z, Yin W, Zhang Y, et al: Comparative evaluation of leukocyte- and platelet-rich plasma and pure platelet-rich plasma for cartilage regeneration. Sci Rep 7:43301, 2017
35. Oh JH, Kim W, Park KU, et al: Comparison of the cellular composition and cytokine-release kinetics of various platelet-rich plasma preparations. Am J Sports Med 43:3062-3070, 2015
36 Kuffler DP: Variables affecting the potential efficacy of PRP in providing chronic pain relief, Journal of Pain Research 2019:12 109–116]
37. LaPrade RF, Dragoo JL, Koh JL, et al: AAOS research symposium updates and consensus: biologic treatment of orthopaedic injuries. J Am Acad Orthop Surg 24:e62-e78, 2016
38. Zlotnicki JP, Geeslin AG, Murray IR, et al: Biologic treatments for sports injuries II think tank-current concepts, future research, and barriers to advancement, part 3: articular cartlage. Orthop J Sports Med 4: 2325967116642433, 2016
39. Braun HJ, Kim HJ, Chu CR, et al: The effect of platelet-rich plasma formulations and blood products on human synoviocytes: implications for intra-articular injury and therapy. Am J Sports Med 42:1204-1210, 2014
40. Cole BJ, Karas V, Hussey K, et al: Hyaluronic acid versus platelet-rich plasma: a prospective, double-blind randomized controlled trial comparing clinical outcomes and effects on intra-articular biology for the treatment of knee osteoarthritis. Am J Sports Med 45:339-346, 2017
41. Cerza F, Carnì S, Carcangiu A, et al: Comparison between hyaluronic acid and platelet-rich plasma, intra-articular infiltration in the treatment of gonarthrosis. Am J Sports Med 40:2822-2827, 2012
42. Filardo G, Di Matteo B, Di Martino A, et al: Platelet-rich plasma intraarticular knee injections show no superiority versus viscosupplementation: a randomized controlled trial. Am J Sports Med 43:1575-1582, 2015
43. Filardo G, Kon E, Pereira Ruiz MT, et al: Platelet-rich plasma intra-articular injections for cartilage degeneration and osteoarthritis: single- versus double-spinning approach. Knee Surg Sports Traumatol Arthrosc 20:2082-2091, 2012
44. Russo F, D’Este M, Vadalà G, et al. Platelet rich plasma and hyaluronic acid blend for the treatment of osteoarthritis: Rheological and biological evaluation. PLoS One 2016;11:e0157048.
45. Lana JFSD, Weglein A, Sampson SE, et al. Randomized controlled trial comparing hyaluronic acid, platelet-rich plasma and the combination of both in the treatment of mild and moderate osteoarthritis of the knee. J Stem Cells Regen Med 2016;12:69-78.
46. Chahla J, Cinque ME, Piuzzi NS, et al. A call for standardization in platelet-rich plasma preparation protocols and composition reporting: A systematic review of the clinical orthopaedic literature. J Bone Joint Surg Am 2017;99:1769-1779.
47. Karasavvidis T. et al. Platelet-Rich Plasma Combined With Hyaluronic Acid Improves Pain and Function Compared With Hyaluronic Acid Alone in Knee Osteoarthritis: A Systematic Review and Meta-analysis. Arthroscopy: The Journal of Arthroscopic and Related Surgery, Vol -, No – (Month), 2020: pp 1-11 (in press)
48. Zhao J, Huang H, Liang G, Zeng L-F, Yang W, Liu J. Effects and safety of the combination of platelet-rich plasma (PRP) and hyaluronic acid (HA) in the treatment of knee osteoarthritis: A systematic review and meta-analysis. BMC Musculoskelet Disord 2020;21:224.
49. Evans CH, Chevalier X, Wehling P: Autologous conditioned serum. Phys Med Rehabil Clin N Am 2016;27:893–908
50. Wehling P, Evans C, Wehling J, et al: Effectiveness of intra-articular therapies in osteoarthritis: a literature review. Ther Adv Musculoskelet Dis 2017;9:183–96
51. Meijer H, Reinecke J, Becker C, et al: The production of anti-inflammatory cytokines in whole blood by physico-chemical induction. Inflamm Res 2003;52:404–7
52. Crnogaca K, Bicanic G, Delimar D: Elevated CRP level could herald less efficient autologous conditioned serum (ACS) treatment. Med Hypotheses 2016;86:135–7
53. Baltzer AW, Moser C, Jansen SA, et al: Autologous conditioned serum (Orthokine) is an effective treatment for knee osteoarthritis. Osteoarthr Cartil 2009;17:152–60
54. Auw Yang KG, Raijmakers NJ, van Arkel ER, et al: Autologous interleukin-1 receptor antagonist improves function and symptoms in osteoarthritis when compared to placebo in a prospective randomized controlled trial. Osteoarthr Cartil 2008;16:498–505
55. Bowman S et al.: Recent advances in hyaluronic acid based therapy for osteoarthritis; Clin Trans Med (2018) 7:6-17
56. Neustadt D et al.: Clinical Effects of Intraarticular Injection of High Molecular Weight Hyaluronan (Orthovisc®) in Osteoarthritis of the Knee: A Randomized, Controlled, Multicenter Trial. J Rheumatol 2005;32;1928-1936
57. Takanori Wakayama et al.; Quality comparison between two different types of platelet-rich plasma for knee osteoarthritis. Regen Med Res 2020; 8:1-7
Autoren
ist Facharzt für Orthopädie und Unfallchirurgie sowie Allgemeinchirurgie und leitet die Orthopädische Praxis Hannover/Kleefeld. Er ist seit Jahren als Referent im Rahmen der Sportmedizin tätig und widmet sich mit Schwerpunkt in der Betreuung von Freizeit und Leistungstänzern einem besonders interessanten Gebiet der Sportmedizin.



