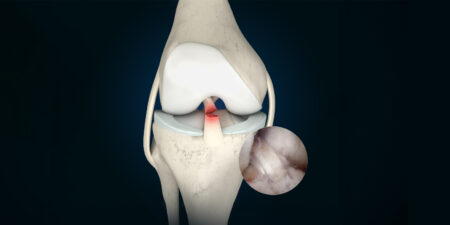
Das femoroacetabuläres Impingement (FAI) beschreibt ein Bewegungsmechanismus, bei dem es durch repetitives Anschlagen des Kopf-Schenkelhals-Überganges an den Azetabulumrand zu Schäden an dem Gelenkknorpel und am Labrum acetabulare kommt. Man unterscheidet zwischen zwei Arten des FAI (Cam-FAI und Pincer-FAI (Abb.1)), die isoliert oder, in etwa 70 % der Fälle, kombiniert auftreten können.
Das FAI von Cam-Typ ist die Folge einer anatomischen Veränderung am Kopf-Schenkelhals-Übergang des Femurs. Es zeigt sich typischerweise ein asphärischer Femurkopf mit einem verminderten Kopf-Schenkelhals-Offset, der auch als „Schenkelhals-Bump“ bezeichnet wird. Durch das repetitive Anschlagen dieses „Bumps“ an dem antero-lateralen Pfannenrand des Azetabulums, kommt es zu einer Erhöhung der Scher- und Abriebkräfte an dem chondro-labralen Komplex und in der Folge zur Ruptur. Diese Separation macht den Knorpel vulnerabel und insbesondere bei dem FAI vom Cam-Typ führt dies zu Knorpeldelaminationen (Abb. 2), die bei ausgeprägten Befunden auch bis weit nach postero-lateral reichen können.
Bei der Pincer-Deformität kommt es durch eine vermehrte Pfannenrandüberdachung des Hüftkopfes zum verfrühten Anschlagen des Schenkelhalses am Pfannenrand und in der Folge zu einer Quetschung des labrum acetabulare, bei länger anhaltenden Befunden kann es ossifizieren. Die Knorpelschäden sind dabei meistens auf den Bereich der Pincer-Komponente begrenzt, dorso-inferior tritt durch das Hebeln des Schenkelhalses über den Pfannenrand eine sogenannte „Contre-coup“-Läsion auf. Weitere Ursachen, die zu einer Pincer-Symptomatik führen können, sind die Coxa profunda, Protusio acetabuli und Pfannenretroversion. In der radiologischen Diagnostik zeigt sich häufig ein Crossing-over sign. Bei einer vermehrten Beckenkippung („pelvc-tilt“) nach vorne kann es ebenfalls zu einer vermehrten ventralen Überdachung des Femurkopfes kommen und so ein „funktionelles“ Pincer FAI auslösen. Es kann dabei zu einer vermehrten Lordosierung der LWS kommen, durch einen verstärkten Druck im lumbo-pelvinen Übergang. Einige Autoren empfehlen deswegen bei einem funktionellen-FAI, die Hyperlordosierung durch gezieltes muskuläres Training zu reduzieren und somit die vordere Beckenkippung zu normalisieren [1]. Ob Sport einen Einfluss auf die Entstehung des Pincer-FAI hat, konnte bisher nicht geklärt werden.
Einfluss von Sport auf die Entwicklung des FAI
Es gibt zunehmende Evidenz darüber, dass starke Belastungen der Epiphysenfuge während der Adoleszenz und/oder eine Epyphysiolysis capitis femoris (ECF) (lenta Form) die Entwicklung eines Cam-Impingements ebenso begünstigen, wie sportliche Aktivität. Zudem scheint es eine sogenannte „critical period“ kurz vor dem Schluss der Epiphysenfuge zu geben, die prädisponierend zur Entwicklung des Cam-Typ FAI ist. Dies erklärt auch, warum nur sehr vereinzelt Fälle von Cam-FAI bei Jugendlichen unter 13 Jahren beschrieben sind und nach Schluss der Epiphysenfuge die Prävalenz auch nicht weiter steigt [2]. Am Beispiel des Eishockey-Sports als high-impact Sportart konnte kürzlich gezeigt werden, welchen Einfluss der Sport auf die Entwicklung des FAI hat. In einer kürzlich veröffentlichten Arbeit an 74 adoleszenten männlichen Eishockey-Spielern, zeigte zwei Drittel der Spieler im MRT Zeichen eines FAI und 21 % zeigten klinische Auffälligkeiten. Interessanterweise hatten die Spieler mit klinischen und radiologischen FAI keine funktionellen Defizite (Muskelkraft, Performance auf dem Eis) im Vergleich zu der Gruppe, die keine FAI Morphologie zeigten [3]. Eine weitere Arbeit, in der 210 adoleszente Jugendliche in high-impact Sportarten untersucht wurden, konnte zeigen, dass die Intensität des Sports während dieser Phase eine deutliche Prävalenz zur Entwicklung eines Cam-FAI zeigte [4]. Kann in Folge dieser Erkenntnisse die Frage gestellt werden, ob sich die Entwicklung des FAI während der Adoleszenz durch Anpassung der Aktivität und Reduzierung der Trainingsstunden verlangsamt? Bisher gibt es noch zu wenige Daten, um diese Frage eindeutig zu beantworten, sodass eine klare Empfehlung, in welcher Art und Weise das Training und die Belastung angepasst werden können, zum jetzigen Zeitpunkt nicht ausgesprochen werden kann.
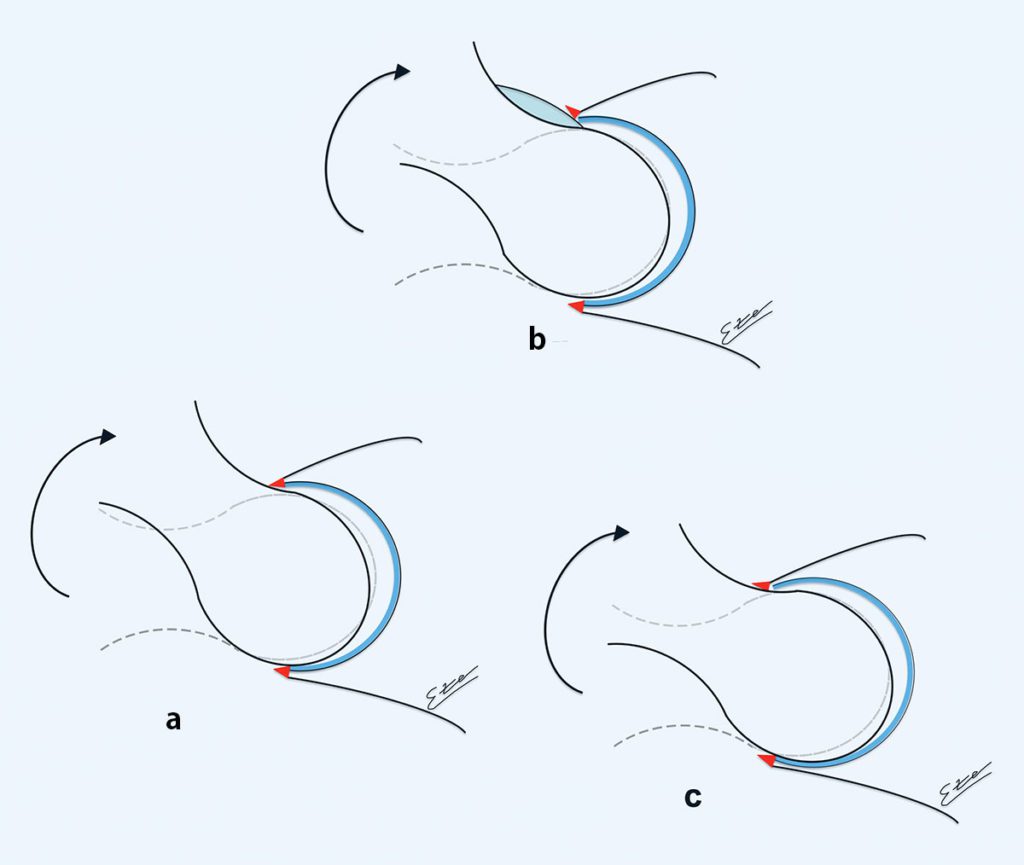
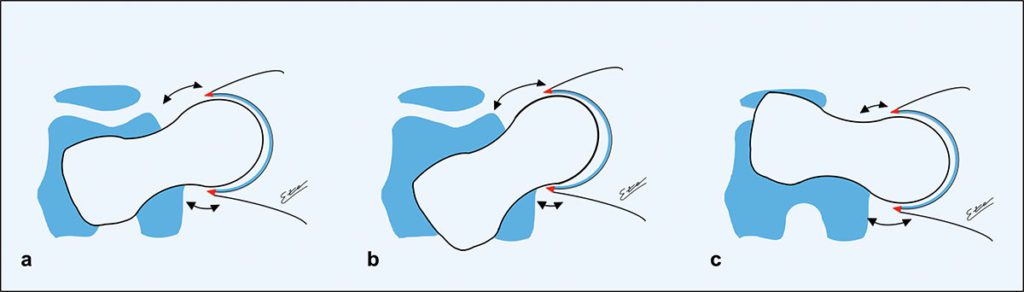
In der letzten Dekade konnte durch verschiedene Arbeiten und zunehmenden Wissen über das FAI gezeigt werden, dass die femorale Torsion ebenfalls Einfluss auf die Entwicklung des FAI hat. Die physiologische Anteversion des Schenkelhalses beim Erwachsenen gegenüber den Femurkondylen beträgt 10 bis 24°. Ca. 17 % der symptomatischen FAI-Patienten zeigten schwere Torsionsfehlstellung des Schenkelhalses. Abb. 3 zeigt die verschiedenen Deformitäten. Es treten unterschiedliche Torsionsfehlstellungen bei Cam- oder Pincer-FAI Morphologien auf. Einige führen zu deutlicher Bewegungslimitierung, andere sind hingegen eher unproblematisch [7]. Bei dem Cam-FAI tritt häufig eine verminderte Antetorsion des Schenkelhalses auf, was die Innenrotation noch zusätzlich einschränkt. Gerade weil viele Hüftpathologien (FAI, Hüftdysplasie, Morbus Perthes, Coxa valga) mit Torsionsfehlern einhergehen, ist es umso wichtiger, diese Patienten genauer zu untersuchen und die Diagnostik hier zu erweitern. Häufig findet sich beispielsweise eine Kombination eines Cam-FAI mit einer acetabulären Dysplasie. Es gibt verschiedene Kombinationen von FAI-Deformitäten (Cam oder Pincer) und femoraler Torsion, die unterschiedliche Effekte haben können. So können einige Kombinationen abhängig von der gegenseitigen Verminderung oder Verstärkung ihres Effektes zur Kompensation oder Verschlimmerung des FAIs führen.
Das Problem der Diagnostik
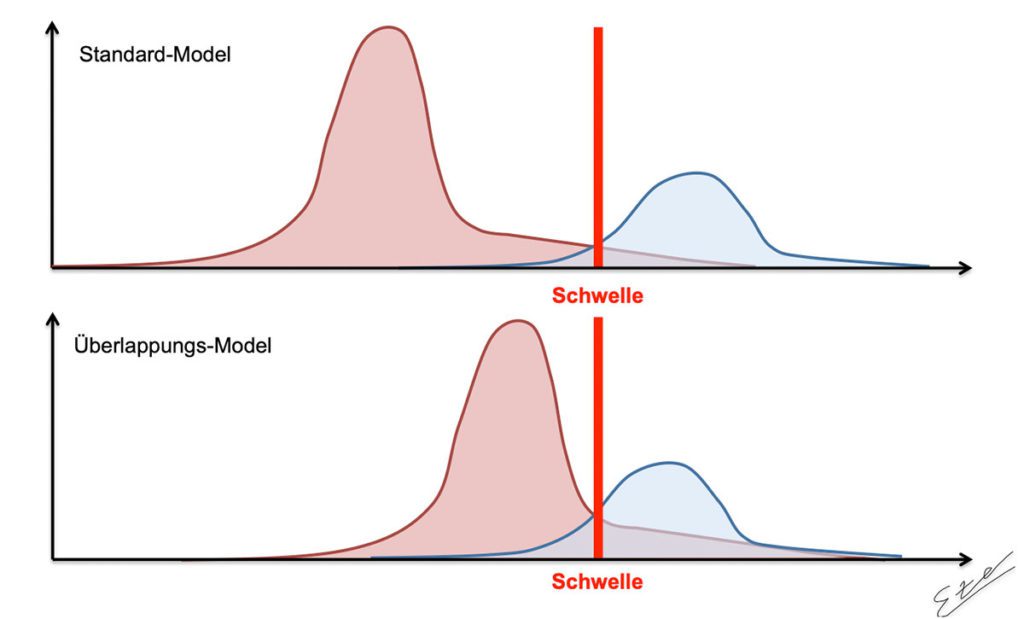
Viele Patienten mit einem radiologischen FAI können klinisch beschwerdefrei oder -arm bleiben [5]. Es bleibt jedoch die Frage, welche Messparameter zurate gezogen werden, um eine klare Diagnose zu stellen und wenn es sie gäbe, wie zuverlässig diese sind? Es gibt viele Patienten, die in einem Graubereich anzusiedeln sind, wo keine klare Abgrenzung zwischen gesunden Patienten und einem pathologischem Befund besteht. Eine Möglichkeit sich der Problematik zu näheren, ist ein Populationsmodel, wie in Anlehnung an Sutter und Pfirrmann 2017 in Abb. 4 beschrieben. Welches Modell sollte bei FAI-Verdacht betrachtet werden? Das sogenannte „Standard-Modell“, bei der eine relativ klare Trennung zwischen der „gesunden“ und der FAI-Population besteht oder trifft das Model mit einer vermehrten Überlappung beider Gruppen eher zu? Im „Standard-Model“ ließe sich eine klare Trennlinie oder Schwelle zwischen beiden Gruppen definieren, wie z. B. einen bestimmten klinischen Test. In der klinischen Praxis wird jedoch eher das zweite Model beobachtet, sodass die klinischen und radiologischen Untersuchungen, die wir standardmäßig durchführen, häufig zu falsch-positiven oder falsch-negativen Ergebnissen führen würden. In der Folge sollte klar sein, dass ein radiologischer Befund nur ein Entscheidungskriterium in der Diagnostik des FAI, neben der klinischen Untersuchung, den Symptomen des Patienten, der Vorgeschichte und dem Aktivitätslevel, ist. Aktuell gibt es kein eindeutiges Diagnostik-Tool, welches immer eine genaue Zuordnung in eine der beiden Gruppen erlaubt. Nichts desto trotz ist die aktuelle Bildgebung dafür geeignet, bei vielen Patienten eine klinische FAI-Verdachtsdiagnose zu erhärten oder zu bestätigen [1].
Operative Therapieoptionen
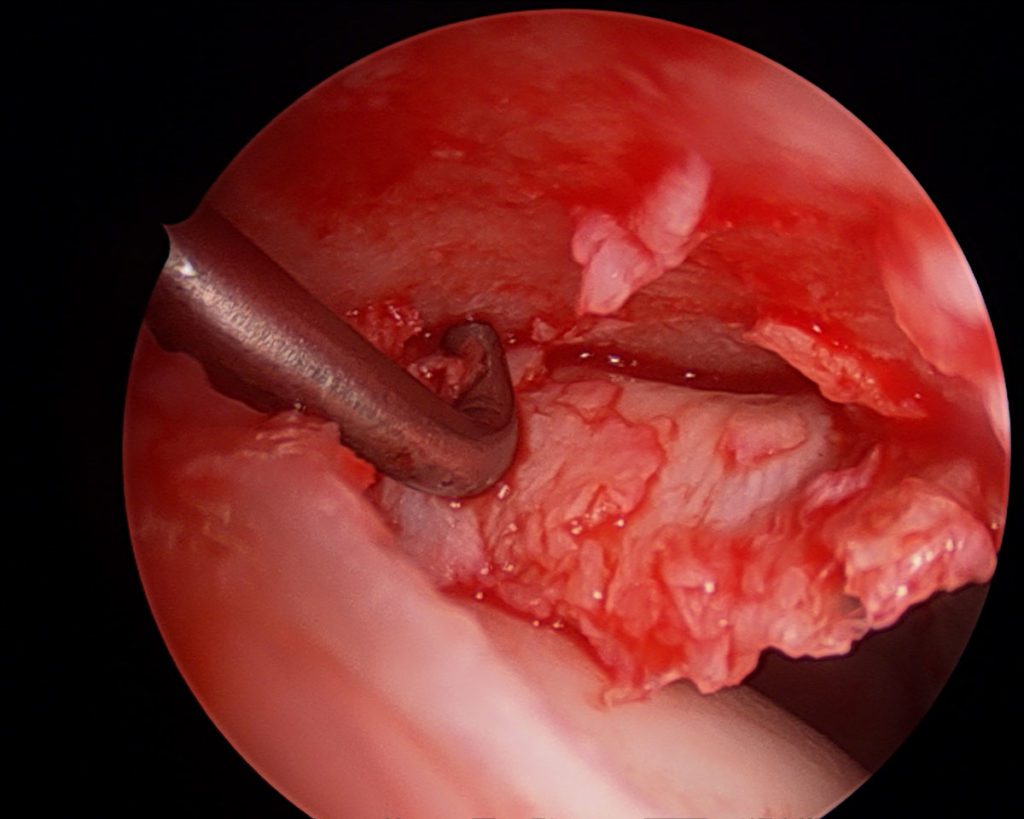
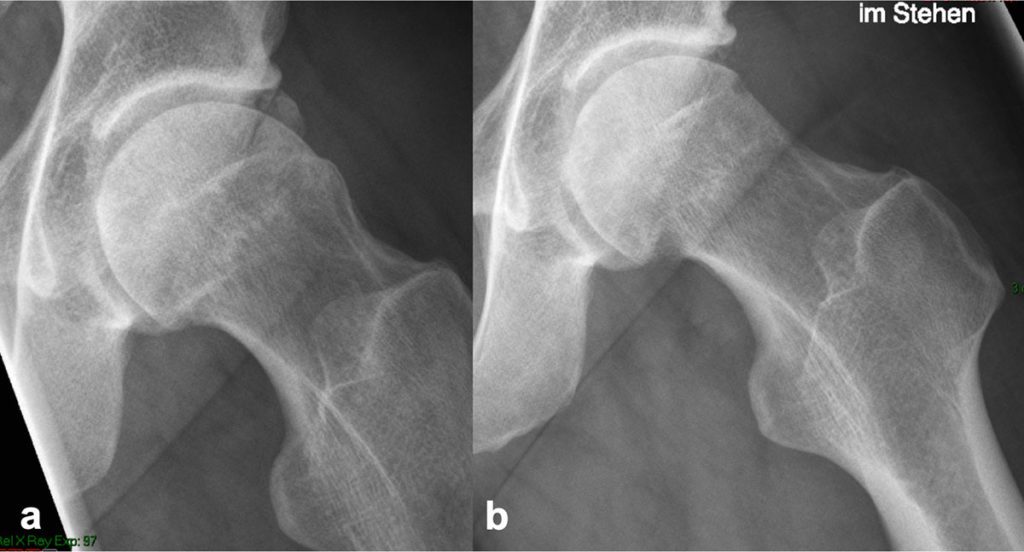
Seit Anfang der 2000er hat sich die Hüftarthroskopie als der Goldstandard in der Behandlung des FAI etabliert, die arthroskopisch assistierte Mini-open Arthrotomie hat ebenfalls ihren Stellenwert und ist Bestandteil aktueller Langzeiterhebungen [6] (Abb. 5) . Die offene Luxation ist als Standard in der FAI-Versorgung abgelöst worden, wird noch vereinzelt angewandt, kommt bei speziellen Indikationen noch zum Einsatz und sollte zum Repertoire eines Hüftoperateurs gehören. Die Indikationen zum chirurgischen Eingriff des FAI werden nach wie vor etwas kontrovers diskutiert. Insbesondere die Frage, ob Patienten mit keiner oder wenig klinischer Beschwerden, die radiologisch ein FAI zeigen, operiert werden sollten, um die Entwicklung einer Koxarthrose zu verhindern. Die operative Behandlung des FAI zeigt gute kurz- bis mittelfristige Ergebnisse, je größer die Knorpelschäden und der Gelenkverschleiß zum Zeitpunkt der OP, desto schlechter ist das post-operative Ergebnis. Eine Gelenkspaltweite von mindestens 2mm hat sich als Grenze zur Indikation eines gelenkerhaltenden Eingriffs etabliert. Randomisierte kontrollierte Studien werden derzeit durchgeführt. Die FIRST-Studie z. B., ist eine randomisiert-kontrolliert Studie, die Hüftarthroskopie mit Schenkelhalsosteoplastik und Korrektur der Cam-Deformität bei Patienten mit FAI mit Hüftarthroskopie, bei der nur eine Lavage durchgeführt wird, verglichen wird. Die Ergebnisse dieser Studie stehen derzeit noch aus [7]. Zwei kürzlich veröffentlichte Level-1a Studien haben jedoch beide zeigen können, dass eine operative Therapie eines symptomatischen FAI gegenüber eines physiotherapeutischen Programmes überlegen ist [8, 9].
Literatur
[1] Sutter R, Pfirrmann CWA Update on Femoroacetabular Impingement: What Is New, and How Should We Assess It?; Semin Musculoskelet Radiol 2017;21:518–528.
[2] Nepple JJ, Vigdorchik JM, Clohisy JC (2015) What is the association between sports participation and the development of proximal femoral cam deformity? A systematic review and meta-analysis. Am J Sports Med 43:2833 – 2840.
[3] Brunner R, Maffiuletti NA, Cavatelli NC, et al. Prevalence and functional consequences of femoroacetabular impingement in young male ice hockey players. Am J Sports Med 2016;44(01):46 – 53.
[4] Palmer A, Fernquest S, Gimpel M, et al. Physical activity during adolescence and the development of cam morphology: a cross-sectional cohort study of 210 individuals. Br J Sports Med 2018;52:601 – 10.
Autoren
ist Facharzt für Orthopädie und Unfallchirurgie sowie spezielle orthopädische Chirurgie. Seit 2016 ist er Chefarzt und Leiter EPZmax im Vincenz Krankenhaus GmbH Paderborn, Standort St-Josefs. Bis 2015 war Dr. Ezechieli Mannschaftsarzt der Hannover Scorpions und ist aktuell Vorstandsmitglied der GOTS. Außerdem wurde er in das Expertenpanel der EU für „medical devices“ in den Feldern „Orthopädie, Unfallchirurgie, Rehabilitation und Rheumatologie“ berufen.