Seit der Entdeckung der Myokine durch BK Pederson 2007 in Kopenhagen [1] wurden mehrere Hundert dieser Substanzen identifiziert, die der Muskel bei entsprechender Tätigkeit in den Kreislauf abgibt. Eine mindestens genauso große Anzahl wartet vermutlich noch auf ihre Entdeckung. Die Myokine sind für die allseits bekannten positiven Effekte der sportlichen Betätigung verantwortlich. Mit dieser Erkenntnis sind wir in der Lage, die Zusammenhänge von Sport und Gesundheit besser zu verstehen und können so Sport gezielt als wichtigen Therapiebaustein einsetzen.
Definition
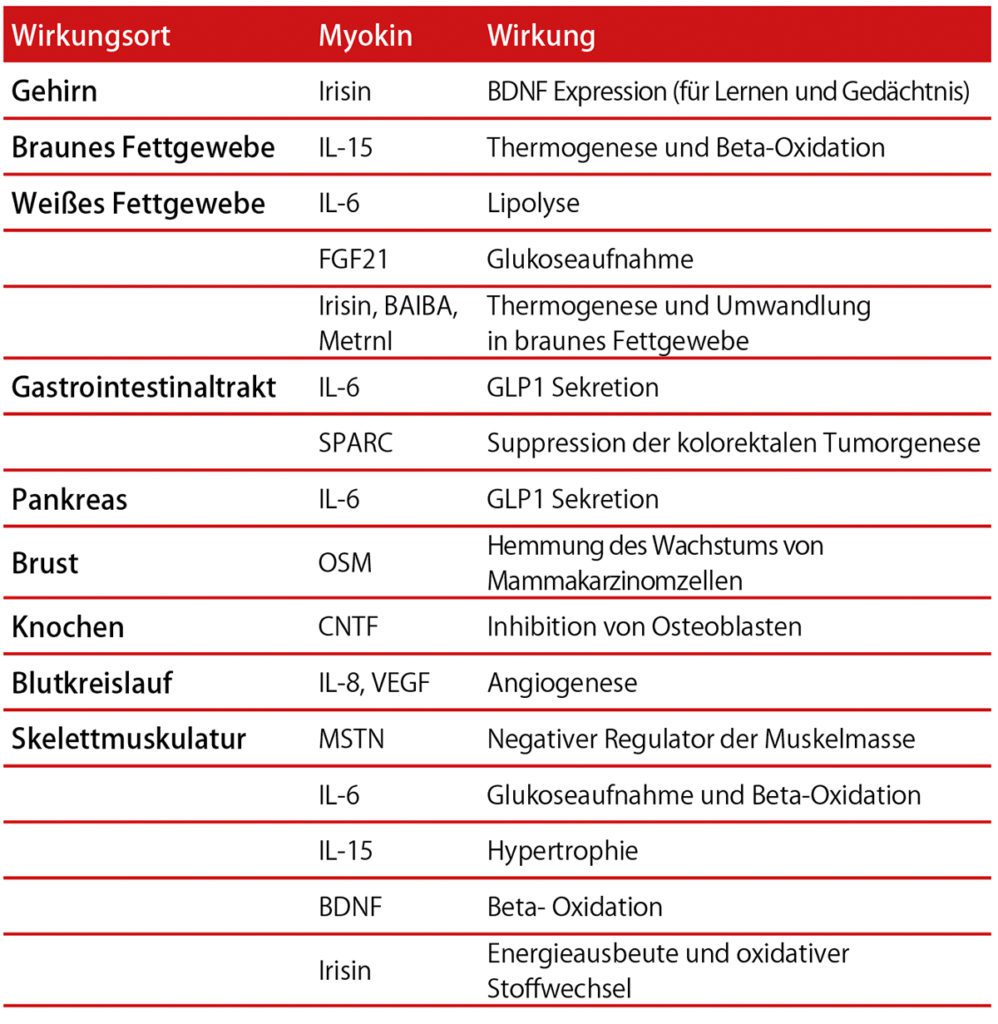
Als Myokine werden Zytokine und andere Peptide bezeichnet, die von der Muskulatur produziert und sezerniert werden, sowie entweder parakrine oder endokrine Effekte besitzen [1]. Mittlerweile wurde den Moykinen auch ein autokriner Effekt nachgewiesen. Stellvertretend für die große Anzahl an Myokinen werden im Folgenden drei der bekanntesten Vertreter dieser Art vorgestellt.
IL-6
Eines der besterforschten Myokine ist das IL-6. Diesem Peptid werden gegenteilige Wirkungen nachgesagt. Eigentlich handelt es sich bei IL-6 um ein proinflammatorisches Zytokin. Es kann unter anderem die Blut-Hirnschranke passieren und die Prostaglandin E2 Synthese stimulieren. So entsteht beispielsweise Fieber. Gleichzeitig sagt man dem Zytokin IL-6 eine beträchtliche Wirkung bei Kachexie und Muskelatrophie im Rahmen chronischer Erkrankungen nach. Die Konzentration des IL-6 ist im Blut bei Patienten mit Diabetes mellitus Typ 2 und auch bei kardiovaskulären Erkrankungen erhöht, sozusagen bei Patienten mit einer „silent inflammation“. Auch beim Metabolischen Symptomkomplex ist der IL-6 Level erhöht. Umso erstaunlicher ist der Effekt des aktivitätsinduzierten Myokins IL-6. Unter Ausdauertraining kann der Spiegel an IL-6 um das 100fache ansteigen und das in kürzester Zeit. Hierunter kommt es nachweislich zur Aktivierung antiinflammatorischer Prozesse (z.B. Expression von IL-1ra und IL10, sowie Supression von TNF Alpha) [2]. Die Expression des Myokins IL-6 ist nicht nur aktivitätsabhängig, sondern die Höhe des Plasmaspiegels hängt auch von der Menge des Glykogens im Muskel ab: je niedriger dieser wird, umso mehr IL-6 wird produziert und ausgeschüttet [3]. Es wirkt sozusagen als „Energie-Sensor“. Um dem Muskel genug Energie bereit zu stellen, wird in Folge der Sekretion die Fettsäureoxidation angekurbelt und die Glukoneogenese in der Leber vorangetrieben. Die Insulinsensitivität wird verbessert, damit der arbeitende Muskel genug Substrat erhält. Zusätzlich hat Myokin IL-6 Einfluss auf die Insulinproduktion der Beta- Zellen in der Bauchspeicheldrüse. Auch die Wirkung des exercise-induced-glucagon-like-peptide-1, welches die Insulinsekretion stimuliert, ist von der Anwesenheit des muskelproduzierten IL-6 abhängig. Nun mag die konträre Wirkung seltsam erscheinen. Die Forscher erklären sich diesen Umstand unter anderem mit der Verweildauer des IL-6 im Blut. Die positiven Effekte leben durch die kurzzeitige Ausschüttung durch den bewegten Muskel. Bei chronischen Erkrankungen (Inflammation) liegt ein langanhaltender systemisch erhöhter IL-6 Level vor, der schließlich zur Atrophie von Muskelgewebe und zu generalisierten Entzündungsprozessen führt. Das muskelinduzierte IL-6 hingegen steigt kurzfristig bei Belastung sehr stark im Kreislauf an und fällt auch entsprechend schnell ab.
Als beste Trainingsform hat sich in den Studien das Ausdauertraining herausgestellt, so mussten die Probanden in einigen Studien zwei bis drei Stunden auf dem Laufband schwitzen [4]. Jedoch scheinen sich auch kürzere, dafür intensivere Einheiten zu lohnen, um einen antiinflammatorischen Effekt zu erzielen.
IL-15
Auch IL-15 ist ein Myokin der ersten Stunde, jedoch war es deutlich schwerer einzusortieren als IL-6. Als Zytokin sezerniert, besitzt auch IL-15 proinflammatorische Effekte, wie etwa die Aktivierung von T- und natürlichen Killerzellen [5]. Auch gibt es bei IL-15 verschiedene Isomere [6]. Durch Ausdauertraining konnte kein Anstieg verzeichnet werden, weder der mRNA in der Muskelzelle, noch des Plasmaspiegels. Jedoch wurde IL-15 durch Krafttraining stimuliert und führte zu einer Zunahme der Muskelmasse [7]. Dem Myokin IL-15 wurde daher eine anabolische Wirkung zugesprochen [8]. Mittlerweile wurden neue Studien veröffentlicht, die einen IL-15 Anstieg im Muskel selbst nachweisen konnten, und zwar bei Ausdauertraining (jedoch kein Anstieg im Serum) [9]. Es führt zu einer verstärkten Glukoseaufnahme und Fettsäureoxidation. IL-15 führt in Folge dessen zu einer Reduktion des Körperfettanteils und in besonderem Maße zu einer Reduktion des viszeralen Fettes [10]. Es konnte auch ein positiver Effekt auf den Leberstoffwechsel nachgewiesen werden, so dass die Fetteinlagerung dort reduziert wurde [11]. Es bleibt abzuwarten, wie in zukünftigen Studien das Myokin IL-15 weiter charakterisiert werden wird. Zusammenfassend gilt IL-15 derzeit als Waffe gegen Tumorkachexie und andere Kachexien (z.B. bei COPD). Durch seinen positiven Effekt auf Zucker- und Fettstoffwechsel profitieren auch Patienten mit Diabetes mellitus und kardiovaskulären Erkrankungen. Für all diese Patienten ist eine Kombination aus Ausdauer – und Krafttraining empfehlenswert.
Irisin
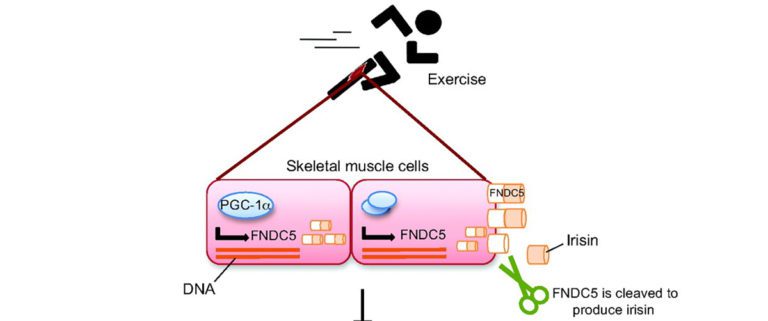
Das Myokin Irisin in ein vieltalentiertes Peptid, das in der Lage ist, beim erwachsenen Menschen weißes Fettgewebe über einen speziellen Signalweg in braunes Fettgewebe zu verwandeln. Diese Erkenntnis wurde 2012 in der Nature veröffentlich und ist seitdem Gegenstand intensivster Forschung [12]. Es wird aktuell als ein potenzieller Lösungsansatz für den metabolischen Syndrom-Komplex angesehen. Auch hier postulierte man Ausdauertraining als Schlüssel zur Produktion. Diese erfolgte PGC-1alpha abhängig (ein transkriptionaler Cofaktor, der im bewegten Muskel eine Schlüsselrolle spielt). Irisin wird anschließend von einem durch PGC-1alpha induzierten membranständigen Protein (FNDC5) abgeschnitten und ins Blut abgegeben [13]. Es kann jedoch auch durch Kälte induziert werden, durch Muskelzittern [14]. In den letzten Jahren wurde der Hype um Irisin etwas gedämpft. Neue Studien widersprechen sich teilweise, was die Aktivierung des Irisin betrifft. So ist immer noch nicht abschließend geklärt, welche Cofaktoren, wie etwa Kälte, Alter, Fitnesszustand etc., Einfluss auf die Irisinproduktion nehmen. Auch wurden in den Studien unterschiedliche Nachweismethoden und unterschiedliche Arten der Probengewinnung durchgeführt [15]. Man kann daher zum jetzigen Zeitpunkt noch keine generalisierte Trainingsempfehlung geben. Zumindest scheinen sich die positiven Auswirkungen auch in den jüngsten Studien zu bestätigen und ständig kommen neue Einflussbereiche des Irisins hinzu:
Irisin verhindert beispielsweise auch den Knochenabbau [16]. Es verbessert die Fettsäureoxidation und den Zuckerstoffwechsel bei Diabetes Typ II Patienten über den AMPK Signalweg. 2018 wurden erste Studien bekannt, in denen Irisin das Zellwachstum von Pankreastumorzellen inhibiert, über den AMPK-mTOR Signalweg [17]. Anfang 2019 wurde schließlich in Nature Medicine eine Studie veröffentlicht, in der dem Myokin eine Erhaltung der synaptischen Plastizität in alzheimergeschädigten Nervenzellen zugesprochen wird [18]. Mit Sicherheit werden im Laufe der nächsten Jahre noch mehr positive Effekte von Irisin publik werden. Jetzt muss nur noch geklärt werden, mit welchem Training man die Produktion dieses Multitalents am besten forcieren kann.

Fazit
Wenn man sich diese Mechanismen vor Augen führt, wird klar, wie essenziell Bewegung für den Menschen ist. Wir tragen sozusagen eine „körpereigene Apotheke“ jederzeit griffbereit mit uns herum, jedoch müssen Patienten dazu motiviert werden. Um sie zu animieren, sich zu bewegen wurde beispielsweise die Rheumotion-Initiative ins Leben gerufen, die speziell Rheumapatienten von den positiven antiinflammatorischen Effekten der körperlichen Bewegung überzeugen möchte [19, 20]. Es gibt bereits Trainingspläne, um den antiinflammatorischen Effekt bei Rheumapatienten bestmöglich auszunutzen: hier werden mehrmals pro Woche Einheiten mit mittlerer (3 x wöchentlich) und hoher (2 x wöchentlich) Intensität, sowie 2 x pro Woche Krafttraining empfohlen [21]. In Studien wurde zudem gezeigt, dass Rheumatiker ein 10-wöchiges hochintensives Intervalltraining gut vertragen haben und signifikant positive Effekte, unter anderem auf die Krankheits- und Entzündungsaktivität, nachgewiesen werden konnten [22]. Die Pharmaindustrie sieht sich zudem in der Pflicht, möglichst bald eine „exercise-like-drug“ auf den Markt zu bringen, basierend auf den Erkenntnissen der Myokinforschung. Irisin hat hierbei momentan gute Chancen, eine „exercise-like-drug“ zu werden. Wie lange die Entwicklung jedoch noch dauern wird ist unbekannt. Bis dahin bleibt der Sport das Monopol der Myokinproduktion. Bewegung liegt uns schließlich im Blut – im wahrsten Sinne des Wortes.
Literatur
[1] Pedersen BK et al. Role of myokines in exercise and metabolism; J Appl Physiol 103; 1093–1098 (2007)
[2] Ostrowski K et al. Physical activity and plasma IL-6 in humans – effect of intensity of exercise; J Appl Physiol 83;512–515 (2000)
[3] Keller C et al. Transcriptional activation of the IL-6 gene in human contracting skeletal muscle: influence of the muscle glycogen content FASEB J 15; 2748–2750 (2001)
[4] Ostrowksi K et al. Evidence that IL-6 is produced in skeletal muscle during prolonged running. J Physiol 508; 949–953, 1998
[5] Giri JG et al. IL-15, a novel T cell growth factor that shares activities and receptor components with IL-2; J Leuko Biol 57 (5); 763–766 (1995)
Autoren
ist Fachärztin für Allgemeinmedizin und Ernährungsmedizin (BTB). Sie ist seit 2016 im Zentrum für Allgemein- und Sportmedizin in Bayreuth, einer Akademischen Lehrpraxis der Universität Erlangen-Nürnberg, selbstständig tätig. Seit 2007 betreut sie deutschlandweit Triathlon-, Lauf- und Rennradveranstaltungen. Seit 2014 ist sie Vereinsärztin des Team Icehouse e.V., einem Bayreuther Ausdauersportverein, der u.a. in der 2. Triathlonbundesliga der Männer an den Start geht.