Während der Triathlon-Europameisterschaft 2015 in Frankfurt musste der ambitionierte Vereinssportler den Wettkampf auf der Radstrecke nach 90 km wegen thorakaler Schmerzen beenden. Die Wettkampfdistanz betrug 3,8 km Schwimmen, 180 km Radfahren und 42,195 km laufen. Die klimatischen Bedingungen waren am Wettkampftag mit anhaltenden Temperaturen über 35 °C extrem. Relevante Vorerkrankungen lagen bei dem Athleten nicht vor, allerdings war der Vater fünf Monate zuvor am plötzlichen Herztod verstorben.
Wegen persistierender Beschwerden stellte sich der Patient am Folgetag in der Universitätsklinik am Wohnort vor. Dort wurden eine CT-Thorax zum Ausschluss einer Lungenembolie, koronaren Makroangiopathie und Aortendissektion (sog. Triple Rule-out) sowie ein kardiales MRT zum Ausschluss einer Myokarditis durchgeführt. Poststationär zeigten sich eine Spiroergometrie sowie ein Langzeit-EKG jeweils mit unauffälligem Ergebnis. Die Beschwerdesymptomatik wurde daraufhin als vertebragen eingestuft und eine physiotherapeutische Behandlung empfohlen.
Unter dieser Behandlung kam es zu keiner Besserung der Symptomatik und dem subjektiven Empfinden einer weiterhin eingeschränkten Leistungsfähigkeit. Es erfolgte deshalb ein erneuter diagnostischer Work-Up beim Vereinsarzt. Die Spiroergometrie zeigte jetzt eine maximale Sauerstoffaufnahme von 146 % des Sollwertes. Dieser Wert ist formal normal, für einen Triathleten, der sich auf einen Langdistanztriathlon systematisch vorbereitet hat, aber unerwartet niedrig. Es wurde deshalb um nochmalige Durchsicht der CT-Bilder im Hinblick auf eine anderweitige Lungengerüsterkrankung gebeten. Die zweite Durchsicht ergab die Diagnose einer Koronaranomalie mit Abgang der rechten Koronararterie (RCA) aus der linkskoronaren Tasche. Der Befund war im Rahmen der Notfalldiagnostik schlicht übersehen worden. Die Anomalie war in Kenntnis des CT-Befundes bei dem sehr gut beschallbaren Patienten in der Echokardiographie darstellbar (Abb. 1).

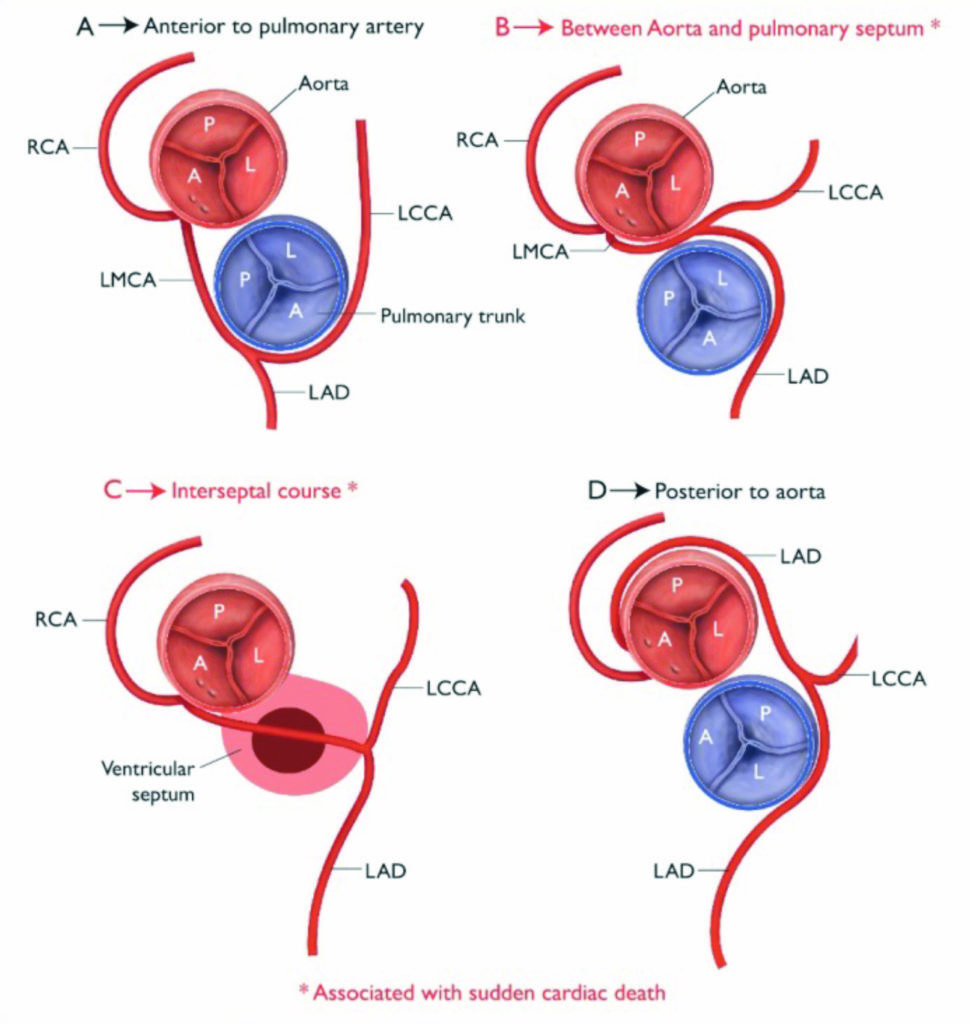
Koronaranomalien gehören zu den häufigsten Ursachen für plötzliche Todesfälle im Sport. In einer Studie der Minneapolis Heart Institute Foundation Registry war eine Koronaranomalie in der untersuchten Gruppe von 1435 jungen Wettkampfsportlern zwischen 1980 und 2005 mit 17 % die zweithäufigste Todesursache [1]. Die häufigsten Koronaranomalien betreffen den Abgang der rechten Koronararterie aus dem linkskoronaren Sinus valsalvae (anomalous RCA/ARCA) beziehungsweise den Abgang des linken Hauptstammes aus dem rechtskoronaren Sinus (anomalous LCA/ALCA). Seltenere Anomalien kommen in Form einer singulären Koronararterie, die sich in alle drei Hauptäste aufteilt oder den Abgang der linken Koronararterie aus der Pulmonalarterie (ALPACA) oder Hypoplasien einzelner Abschnitte des Koronarsystems oder Koronarfisteln vor. Alle Formen wurden mit plötzlichen Todesfällen beim Sport in Verbindung gebracht [2].
Pathophysiologische Mechanismen
Als Mechanismus für den plötzlichen Herztod wird eine akute Okklusion der falsch abgehenden Arterie mit schwerer myokardialer Ischämie und ventrikulären Tachykardien oder Kammerflimmern postuliert. Im Vordergrund steht dabei immer der proximale Abschnitt des falsch abgehenden Gefäßes. Körperliche Belastung führt zu sympathoadrenerger Stimulation mit Anstieg der Herzfrequenz, des systolischen Blutdrucks, der myokardialen Kontraktilität und dadurch resultierendem erhöhtem myokardialen Sauerstoffverbrauch. Mit Zunahme der Kontraktilität und des Schlagvolumens steigt die systolische Expansion der proximalen Aorta und Pulmonalarterie. Eine rein systolische Okklusion bei normaler Herzfrequenz würde allerdings nicht ausreichen, um eine relevante Myokardischämie zu verursachen, da auch in der Diastole Koronarfluss besteht. Bei sehr hoher Herzfrequenz nimmt allerdings der zeitliche Anteil einer systolischen Gefäßokklusion zu, da die Diastolendauer relativ gesehen abnimmt. Dadurch erhöht sich das Risiko einer Ischämie. Bestimmte Gefäßverläufe begünstigen das Auftreten eine Ischämie (Verlauf des Gefäßes zwischen Aorta und A. pulmonalis, Abgang des Gefäßes in einem spitzen Winkel, sodass das Ostium schlitzförmig und in der Art eines Ventilmechanismus kollabiert, proximaler Anteil der aberranten Koronararterie in der aortalen Gefäßwand) [1]. Als direkte Todesursache ist in der Regel von einem ischämiebedingten Rhythmusereignis auszugehen. Das akute Ereignis tritt meist bei oder nach kurzer, sehr intensiver Belastung auf. Verstorbene haben oft vorher auch schon mehrfach vergleichbare Belastungen ohne Symptomatik oder Zwischenfall durchgeführt. Ein tödlicher Zwischenfall ist also nicht vorhersagbar. Todesfälle treten meist vor dem 30. Lebensjahr auf. Ältere Personen mit Koronaranomalie weisen nur ein geringes Risiko auf, weil dann vermutlich doch kein pathophysiologisches Substrat für den plötzlichen Herztod vorliegt. EKG, Belastungsuntersuchungen und Echo sind vor und nach einem Koronarereignis oft negativ. Eine Ischämie ist bei den betroffenen Personen oftmals auch bei höherer Belastung nicht provozierbar.
Entscheidend für ein erhöhtes Risiko ist der proximale Verlauf des aberranten Gefäßes. So sind fast nur Patienten mit aberrant abgehender linker Koronararterie und Verlauf zwischen Aorta und rechtsventrikulärem Ausflusstrakt gefährdet. Ein proximaler Verschluss der linken Koronararterie führt zu einem großen Ischämieareal mit der Folge ventrikulärer Herzrhythmusstörungen, einer massiven Infizierung und ggf. eines kardiogenen Schocks. Beim Verschluss der rechten Koronararterie ist der betroffene Bereich in der Regel kleiner. Die Prävalenz von Koronaranomalien wird in der Bevölkerung mit 0,3 bis 1,3 % angegeben [6 – 8].
Können Risikopatienten identifiziert werden?
Die Mehrzahl der Patienten mit Koronaranomalien ist asymptomatisch. Der akute Herztod ist oftmals das Initialereignis. Die retrospektive Aufarbeitung von Patienten mit überlebtem plötzlichem Herztod zeigt nur bei einem geringen Anteil der Patienten Beschwerden oder pathologische Untersuchungsbefunde wie Erregungsrückbildungsstörungen oder Arrhythmien in der Belastungsuntersuchung. Verdächtige Beschwerden bei jungen Patienten sind immer Angina Pectoris, Synkopen, insbesondere im Zusammenhang mit Belastung oder Palpitationen als Folge von Herzrhythmusstörungen. Sportler mit diesen Beschwerden sollten immer unter dem Verdacht einer Koronaranomalie untersucht werden. Die Darstellung der Koronarostien kann bei guter Beschallbarkeit in der 2-D Echokardiographie (Abb.1) oder sonst mit anderen bildgebenden Techniken (transösophagelaer Echokardiographie, Kernspintomographie, Computertomographie, Koronarangiographie) erfolgen.
Management der Patienten
Bis auf Patienten mit Abgang der linken Koronararterie aus der Pulmonalarterie (ALPACA) bleiben die meisten Patienten mit anderen Formen der Koronaranomalien ihr Leben lang asymptomatisch. Patienten mit ALPACA versterben häufig bereits in der Kindheit. Die Patienten sind in der Regel aber symptomatisch mit Angina Pectoris oder Zeichen der Herzinsuffizienz. Die Operationsindikation besteht sowohl aus symptomatischen Gründen aber auch bei asymptomatischen Patienten aus prognostischen Gründen zur Vermeidung des plötzlichen Herztodes.
Bei symptomatischer ALCA oder ARCA (Synkopen, Angina pectoris, ventrikulären Arrhythmien oder Wiederbelebung infolge eines Herzstillstandes) besteht unabhängig vom Alter des Patienten die Indikation zur Therapie. Schwierig zu beurteilen ist die Versorgung von asymptomatischen Patienten. Bei Sportlern mit Koronaranomalien im Alter über 40 Jahre ist der plötzliche Herztod selten. Daher scheinen diese Patienten ungefährdet zu sein, allerdings fehlen gute Studien zu dieser Patientengruppe. Da das Komplikationsrisiko eines operativen Eingriffs den therapeutischen Benefit übersteigt, wird eine operative Versorgung in der Regel nicht empfohlen. Bei Patienten mit ARCA, die im Versorgungsbereich einen objektiven Ischämienachweis aufweisen, wird die Vorgehensweise kontrovers diskutiert. Das Risiko für einen plötzlichen Herztod bei ALCA wird in einer jungen Population mit 0,0006 % angegeben [8]. Von betroffenen Personen mit ARCA verstarb keiner. Die Entscheidung bei asymptomatischen jungen Patienten mit ALCA ist schwieriger. Von allen Patienten mit ALCA weist die große Mehrheit, bei denen ein plötzlicher Herztod eintritt, einen interarteriellen (zwischen Aorta u. A. pulmonalis) Verlauf auf. Auch wenn diese Patienten eine niedrige Inzidenz für einen plötzlichen Herztod haben, wird Ischämiediagnostik in Form von szintigraphischen Untersuchungen (Myokardszintigraphie) oder Stressechokardiographie oder Stress-MRT empfohlen. Bei Nachweis einer Ischämie sollte eine operative Korrektur in Erwägung gezogen werden. Bei Personen ohne objektiven Ischämienachweis wird die Vorgehensweise kontrovers diskutiert [10]. Zumindest wird diesen Personen empfohlen, intensive Belastungen und Wettkampfsport zu vermeiden. Inwieweit eine medikamentöse Therapie, beispielsweise mit einem Betablocker, das Risiko reduzieren kann, ist wissenschaftlich nur unzureichend belegt. Bei Patienten mit intramuralem Gefäßverlauf besteht therapeutisch die Möglichkeit einer operativen Freilegung (Unroofing) des betroffenen Gefäßabschnittes. Bei Formen ohne intramuralen Verlauf erfolgt eine koronare Reimplantation, Bypassversorgung oder Verlagerung der Pulmonalarterie zur Vergrößerung des interarteriellen Abschnittes mit dem Ziel einer Dekompression der aberrant verlaufenden Arterie. Angioplastische Maßnahmen und Stent- Versorgung sind in der Literatur ebenfalls beschrieben.
Bei dem oben geschilderten Fallbericht lag eine ARCA vor. Ein interarterieller Verlauf des Gefäßes mit Kompression bestand nicht. In der Stressechokardiographie konnte keine belastungsabhängige myokardiale Ischämie bis zur subjektiven Belastungsgrenze dokumentiert werden. Arrhythmien waren im Langzeit-EKG nicht nachweisbar. Zur genauen Beurteilung des proximalen Gefäßverlaufes und insbesondere des Ostiums erfolgte auch eine Koronarangiographie, die eine Kompression ausschließen und eine freies Ostium darstellen konnte. Das Risiko für einen plötzlichen Herztod beim Sport ist in diesem Fall als sehr gering einzustufen. Insbesondere die Einschätzung der Symptomatik war bei dem Patienten schwierig. Eine psychogene Komponente aufgrund des plötzlichen Herztodes beim Vater erschien möglich und wurde im offenen Gespräch mit dem Patienten dann auch von diesem bejaht. Dem Sportler wurde daraufhin wieder eine Freigabe zur Teilnahme am Wettkampfsport erteilt und ist bis dato komplett beschwerdefrei geblieben.
Fazit
- Koronaranomalien gehören zu den potenziellen Ursachen für einen plötzlichen Herztod im Zusammenhang mit Sport. Die Diagnosestellung ist nicht leicht. Insbesondere die nicht-invasive Ischämiediagnostik ist oft negativ.
- Bei jungen Sportlern unter 40 Jahren mit verdächtigen Beschwerden muss deshalb gezielt nach einer Koronaranomalie mit bildgebenden Verfahren (Echo, MRT, CT, Koronarangiographie) gesucht werden. Eine aberrant abgehende rechte Koronararterie ist meist unproblematisch und bedarf in der Regel keiner weiteren Maßnahmen.
- Die ALCA mit Verlauf der linken Koronararterie zwischen Aorta und Pulmonalarterie ist eine risikoreiche Form. Bei Patienten mit Ischämienachweis oder entsprechenden Beschwerden ist eine operative Therapie zu erwägen.
- Asymptomatische Sportler mit Koronaranomalie über 40 Jahren scheinen weniger gefährdet zu sein, konkrete Empfehlungen zur Sportausübung sind wegen fehlender Studien aber nicht möglich, so dass Freizeitsport und moderate Belastungen vertretbar erscheinen, hoch-intensive Belastungen aber nur mit Vorsicht zu empfehlen sind [11].
Literatur
[1] Cheitlin MD. Congenital anomalies of coronary arteries. Herz 34. 2009: 268 – 279
[2] Rich BS. Sudden death screening. Med Clin North Am 1994; 78:267 – 88
[3] Taylor AJ, Byers JP Cheitlin MD et al. Anomalous right or left coronary artery from the contralateral sinus: „high risk“ abnormalities in the initial coronary artery course and heterogenous clinical outcomes. Am Heart J 1997; 133: 428 – 35
[4] Cheitlin MD, De Castro CM, McAllister HA. Sudden death as a complication of anomalous left coronary origin from the anterior sinus of Valsalva. A not-so-minor congenital anomaly. Circulation 1974; 50: 780 – 7.
[5] Roberts WC, Shirani J. The four subtypes of anomalous origin of the left main coronary artery from the rigth aortic sinus (or from the right coronary artery). Am J Cardiol 1992; 70: 119 – 21
[6] Yamanaka O, Hobbs RE. Coronary artery anomalies in 126.595 patients undergoing coronary arteriography. Cathet Cardiovasc Diagn 1990; 21: 28 – 40
[7] Lytrivi ID, Wong AH, Ko HH, et al. Echocardiographic diagnosis of clinically silent congenital coronary artery anomalies. Int J Cardiol 2008; 126: 386 – 93
[8] Alexander RW, Griffith GC. Anomalies of the coronary arteries and their clinical significance. Circulation 1956; 14: 800 – 5
[9] Eckart RE, Scoville SL, Campbell CL. Et al. Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann Intern Med 2004; 141: 829 – 34
[10] Mirchandani S, Phoon CK. Management of anomalous coronary arteries from contralateral sinus. Int J Cardiol 2005; 102: 383-9
[11] Antonio Pelliccia, Sanjay Sharma, Sabiha Gati, Maria Bäck, Mats Börjesson, Stefano Caselli, Jean-Philippe Collet, Domenico Corrado, Jonathan A. Drezner, Martin Halle, Dominique Hansen, Hein Heidbuchel, Jonathan Myers, Josef Niebauer, Michael Papadakis, Massimo Francesco Piepoli, Eva Prescott, Jolien W. Roos-Hesselink, A. Graham Stuart, Rod S. Taylor, Paul D. Thompson, Monica Tiberi, Luc Vanhees, Matthias Wilhelm
[12] 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. European Heart Journal (2021) 42, 17 – 96:10.1093/eurheartj/ehaa605
Autoren
ist Facharzt für Innere Medizin, Kardiologie, Psychotherapie, Sportmedizin und Sportkardiologie in eigener kardiologischer Praxis mit dem Schwerpunkt Sportkardiologie. Er ist Nukleusmitglied der AG 32 Sportkardiologie der Deutschen Gesellschaft für Kardiologie, Mitherausgeber des „Kursbuch Spiroergometrie“ und Bundessportarzt des Sportverbandes DJK.
ist Fachärztin für Kardiologie, Innere Medizin, Sportmedizin/Sportkardiologie Level 3 mit eigener Praxis (KardioPro) in Düsseldorf. Sie ist Autorin des Buches „Sportherz und Herzsport“. Zusammen mit PD Dr. med. Pascal Bauer (Sprecher der AG32 Sportkardiologie der DGK) und Dr. med Katrin Esefeld (TUM München, Mitglied des Nucleus der AG 32) hat sie als Mandatstragende der Leitliniengruppe die Deutsche Gesellschaft für Kardiologie-Herz- und Kreislaufforschung e.V. (DGK) vertreten.
Foto: © MAX SONNENSCHEIN