Verletzungen des Fußes machen einen nicht unwesentlichen Teil der Sportverletzungen aus. Die Häufigkeit unterscheidet sich jedoch nach Sportart. Laut VBG-Sportreport 2018 lag der Anteil der Fußverletzungen bei 7,4 % im Basketball, 5,6 % im Eishockey, 10,3 % im Fußball und 4,3 % im Handball [20]. Dabei sind die Mittelfußfrakturen die häufigste Entität [3].
Der erste Mittelfußknochen (MFK) ist mit etwa 5 % am seltensten betroffen, der fünfte mit etwa 56 % am häufigsten. Die restlichen Verletzungen verteilen sich gleichmäßig auf die übrigen MFK [6]. Neben den traumatischen Frakturen können auch Stressfrakturen der MFK auftreten. Sie machen 38 % der Stressfrakturen der unteren Extremität aus. Bei den Stressfrakturen sind meistens der 2. und 3. MFK betroffen [6]. Unabhängig davon, ob eine akute oder Stressfraktur vorliegt, gilt es, schnellstmöglich die Ursache und begünstigende Risikofaktoren zu erkennen. Die darauf folgende Therapie sollte dies mit einbeziehen.
Symptomatik
Während bei akuten Frakturen normalerweise Schmerzen nach einem Trauma führend sind, treten bei Stressfrakturen der MFK meistens langsam zunehmenden Schmerzen im Fußbereich auf. Eine eingeschränkte Belastbarkeit geht mit Frakturen unabhängig von der Ätiologie einher. Vor allem im Leistungssport gilt es, durch eine frühzeitige adäquate Diagnostik und Erhebung von Risikofaktoren lange Trainings- und Wettkampfausfälle zu umgehen.
Risikofaktoren
Von entscheidender Bedeutung ist das Erkennen der prädisponierenden Faktoren. Stressfrakturen sind unter anderem bei Balletttänzern aufgrund der wiederholten maximalen Plantarflexion häufiger [36, 27]. Aber auch Sportler aus Sportarten mit hohen Lauf- oder Sprungbelastungen sind gefährdet. Da das Aufgeben der Sportart für Leistungssportler keine Option darstellt, gilt es weitere Ursachen zu identifizieren. Das können Veränderungen der Belastung, wie z. B. erhöhte Trainingsvolumina, wechselnder Untergrund, neue Schuhen, spezielle Schuheinlagen oder biomechanische Kompensationsmechanismen nach vorangegangenen Verletzungen sein [7, 21]. Darüber hinaus müssen auch systemische Ursachen berücksichtigt werden. Dazu gehören Veränderungen im Hormonhaushalt, Essstörungen und Malabsorptionssyndrome [1, 2]. Hier sei auch die Female Athlete Triad erwähnt [33, 1]. Daher sollte die Versorgung mit Eiweiß, Kalzium, Vitamin D und K2 sowie der Alkohol-, Opioid- und Nikotinkonsum überprüft werden [28, 10]. Gerade die nicht steroidalen Antirheumatika (NSAR) können sich negativ auf die Frakturheilung auswirken. Die Anwendung von NSAR verringerte die Trabekelzahl und die Knochenmasse in den ektopen Ossifikationszonen signifikant aufgrund der reduzierten Anzahl und Aktivität der Osteoblasten. Diese resultiert aufgrund von Interferenzen mit dem bone morphogenetic protein-7 (BMP-7) Signalweg [32]. Zwar ist bei akuten Frakturen das Trauma die unmittelbare Ursache, die weiteren aufgeführten Faktoren können eine Fraktur aber begünstigen und sollten daher auch bei adäquatem Trauma mitberücksichtigt werden.
Ernährung
Über die Ernährung kann man die Frakturheilung positiv und negativ beeinflussen. Zunächst gilt es, Noxen zu meiden. Rauchen und starker Alkoholkonsum stehen mit einem Knochenmasseverlust (Osteopenie) und erhöhtem Frakturrisiko in Verbindung [28]. Die Datenlage bei moderatem Alkoholkonsum ist noch unschlüssig [38]. Generell sollte bei Verletzungen durch eine vollwertige Kost, eine ausreichende Energie- und Proteinversorgung sichergestellt sein (Anmerkung der Redaktion: siehe dazu auch https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3257708/ und „Entzündungshemmende Ernährung und Proteine in der Orthopädie und im Leistungssport 2020“ – Video Dr. med. Klaus Pöttgen auf www.sportaerztezeitung.com). Hier werden 2 – 2,5 g Eiweiß pro kg Körpergewicht empfohlen. Besonders wichtig ist es, Mikronährstoffdefizite zu vermeiden. Zur Unterstützung der Knochenheilung sind vor allem Vitamin D und K2, Magnesium sowie Bor zu nennen.
Auch Übergewicht sollte vermieden werden. Zur Kontrolle der Körperzusammensetzung hat sich hierbei die Verlaufsmessung mit der Bioimpendanzanalyse (BIA) etabliert, mit welcher man neben der Fettmasse, auch den Anteil der Muskelmasse und der Wasserverteilung im Körper messen kann. Gerade der Anteil der Muskelmasse sollte hier durch den oben genannten Proteinbedarf / Tag bei eventueller geringerer Bewegung bis zu Immobilisation erhalten bleiben und kann durch regelmäßige Verlaufskontrollen mit der BIA-Waage geprüft werden.
Vitamin D-Mangel
Vitamin D spielt eine wichtige Rolle bei der Kalzium- und Phosphathomöostase. Gerade in der Kombination mit Kalzium führt es zu einem ausgeglichenen Knochenstoffwechsel [18, 19]. Daher ist es von Bedeutung, einen Vitamin D-Mangel (< 25 nmol/l) [9] und einen daraus möglicherweise resultierenden sekundären Hyperparathyreodismus (sHPT) auszuschließen. Ein länger bestehender sHPT ist mit Störungen des Knochenumsatzes verbunden [23, 17] und kann zusätzlich zu einer Mineralsalzminderung führen [26, 17]. Richtlinien empfehlen die Messung des Serumspiegels von 25-Hydroxy-Vitamin D bei allen Patienten mit sHPT [22].
Osteopenie
Eine Osteopenie kann alleinstehend oder als Folge des Vitamin D-Mangels auftreten [17]. Die Diagnose wird zumeist durch eine Dual Energy-XRay- Absorptiometrie (DXA) gestellt. Durch ein neues Verfahren ist es in Zukunft möglich, auf diese Strahlenbelastung zur Bestimmung der Knochendichte zu verzichten und über die Kalziumhomöostase im Skelett Aussagen über eine mögliche Osteopenie zu treffen [9].
Biomechanische Kompensationsmechanismen
Sind die zuvor genannten Risikofaktoren auszuschließen oder treten rezidivierende Verletzungen des MFK auf, sollten ebenso strukturelle Kompensationsmechanismen betrachtet werden [8]. Diese können zu einem Ungleichgewicht zwischen Belastung und Entlastung an Knochen und Weichteilstrukturen und somit zu einer Fraktur führen [21]. Aus biomechanischer Sicht kommt es zu einer Fehl-/Überbelastung durch eine Verschiebung der Bewegungs- und daraus resultierenden Kraftvektoren [31]. Einen Eindruck über das Bewegungsmuster und die daraus resultierenden Belastungsvektoren erhält man durch eine biomechnische Gang- bzw. Laufanalyse, in welcher die Kinematik und Kinetik der unteren Extremität betrachtet wird [5]. Hierzu kommen dynamische Verfahren wie die Fußdruckmessung und Ganganalyse zum Einsatz [7, 5, 11]. Mit diesen Verfahren lassen sich beispielsweise Lauf- und Abrollverhalten beobachten. So ist es möglich, mit einer individuellen Schuhauswahl bzw. Schuheinlagen und Mittelfußtraining zum Aufbau der Muskulatur, den biomechanischen Fehl- und Kompensationsbelastungen entgegenzuwirken.
Diagnostik
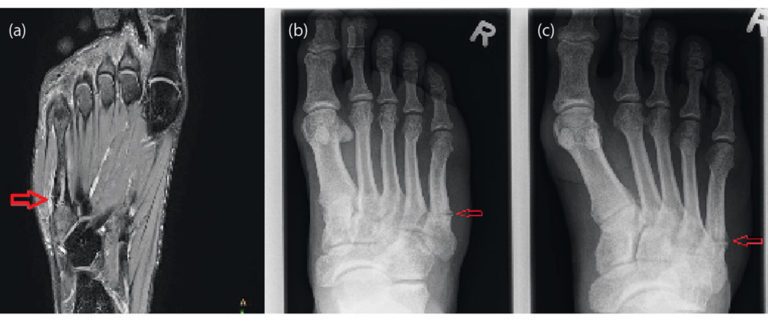
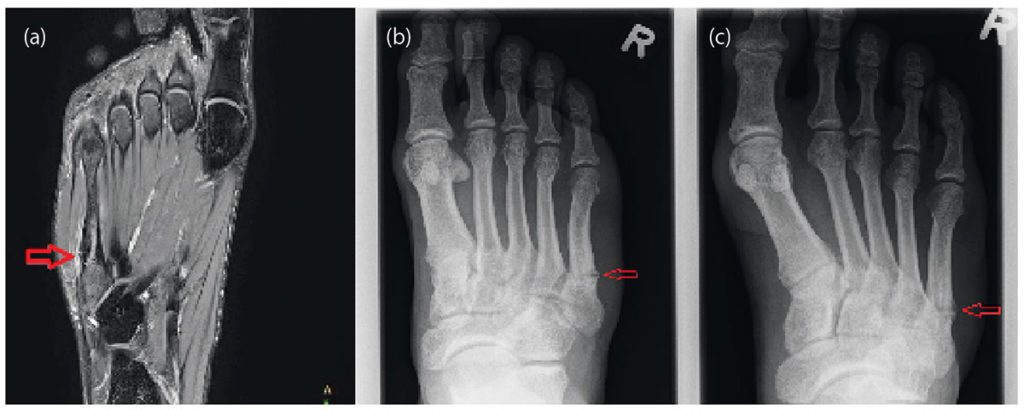
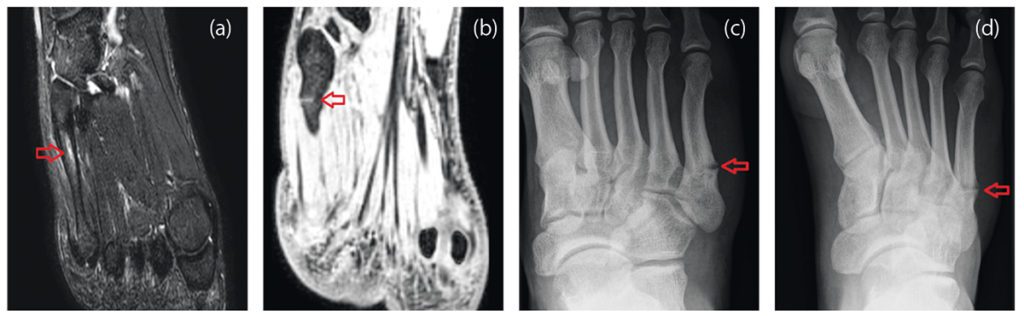
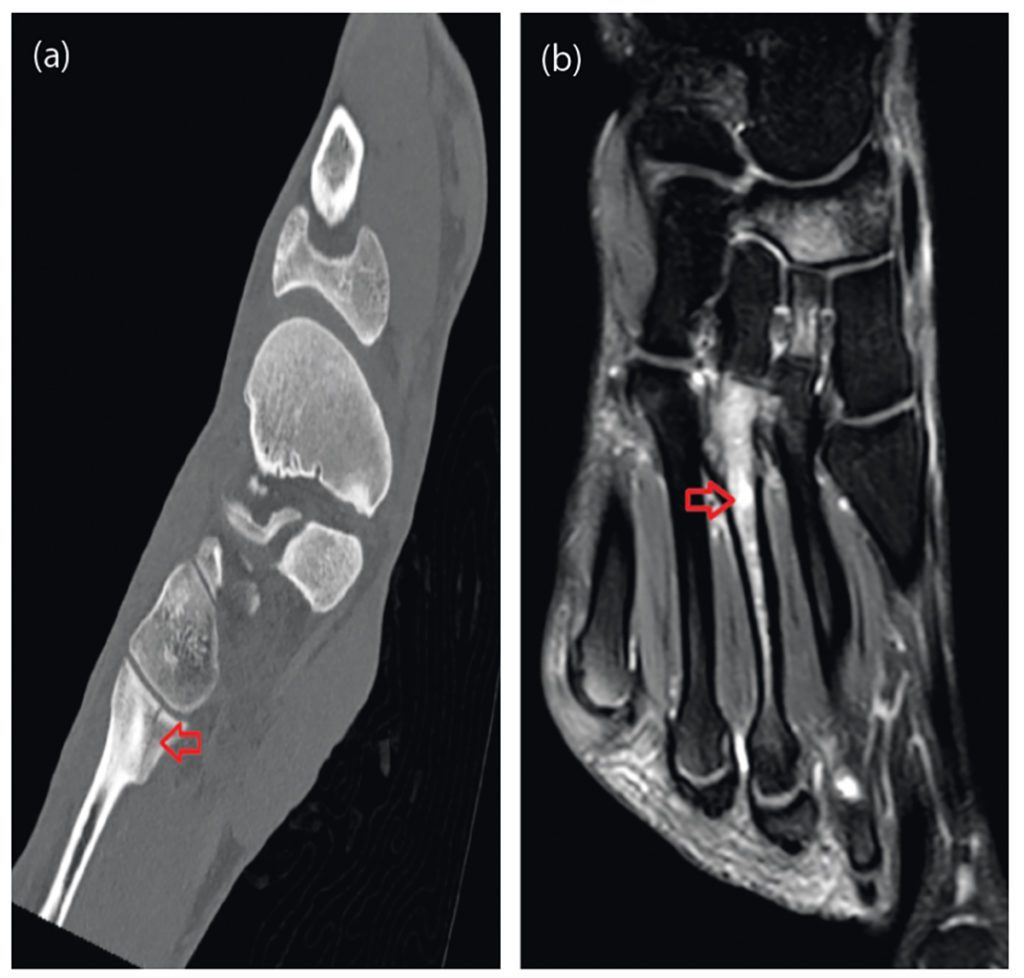
Nach Anamnese und körperlicher Untersuchung ist eine orientierende Ultraschalldiagnostik des Fußskeletts empfehlenswert. Bei geübtem Untersucher sind Sensitivität und Spezifität ähnlich gut wie in der Röntgendiagnostik [4]. Trotzdem sollte sich bei Frakturverdacht eine Röntgendiagnostik des Fußes in drei Ebenen anschließen [3]. Bei Frakturen der Basis von MFK 1-4 sollte eine CT ergänzt werden, da diese mit Lisfranc-Luxationsfrakturen einhergehen können. Bei Stressfrakturen ist das MRT Goldstandard, da Röntgenaufnahmen häufig falsch negativ sind. [36].
Therapie
Konservative oder operative Therapie
Nicht oder nur gering dislozierte Schaftfrakturen des 2. – 5. MFK können konservativ behandelt werden. Dabei sind Dislokationen bis 3 mm und plantare Achsfehlstellung bis 10° tolerabel [3]. Hier genügt eine Ruhigstellung im Short Walker bei schmerzorientierter Vollbelastung. Diese Behandlung mit Wechsel auf einen Schuh mit rigider Sohle nach 4 – 6 Wochen hat gegenüber der Ruhigstellung im Unterschenkelgips den Vorteil des besseren funktionellen Ergebnisses [4]. Hier kommt auch die primäre Versorgung mit einer Carbonsohle in Betracht. Frakturen des ersten MFK mit Dislokation sollten operativ stabilisiert werden, da dieser für das Tragen des Körpergewichts und das Fußgewölbe eine zentrale Rolle spielt [4]. Bei Frakturen mehrerer MFK kann auch bei geringer Dislokation eine Operation notwendig sein [3]. Bei subkapitalen oder kapitalen MFK-Frakturen können ebenfalls Achsabweichungen bis 10° toleriert werden. Die konservative Therapie besteht aus der Entlastung des Vorfußes mittels starrer Sohle bei schmerzadaptierter Vollbelastung. Bei größerer Dislokation und extraartikulärem Frakturverlauf sind intramedulläre Drähte das Osteosyntheseverfahren der Wahl [3]. Auch bei Verkürzung der MFK oder Rotationsfehlern der Zehen sollte die OP-Indikation gestellt werden [12].
Besonderheiten bei Stressfrakturen
Stressfrakturen betreffen häufig den Hals der MFK 2 und 3 oder den Schaft des MFK 5. Bei sehr ausgeprägtem Fußgewölbe ist das Risiko für Stressfrakturen des MFK 5 erhöht, da hier eine vermehrte Belastung entsteht [12]. Die Heilung kann 3 – 6 Monate dauern. Die Therapie beinhaltet analog zu den traumatischen Frakturen die anfängliche Entlastung mit zunehmender Wiederaufnahme der Belastung, während sich der Knochen erholt [15]. Besonders Stressfrakturen der MFK 4 und 5 neigen häufiger zu Pseudarthrosen [36]. Daher wurden in einer Fallserie 11 Sportler mit Stressfrakturen der Basis des MFK 4 mit einer Plattenosteosynthese und Calcaneus-Autograft versorgt. Alle Sportler konnten im Durchschnitt nach 12 Wochen in ihren Sport zurückkehren [30].
Verfahren zur Förderung der Knochenheilung
Sowohl bei akuten als auch bei Stressfrakturen können Pseudarthrosen auftreten. Es gibt einige Therapieverfahren, die hier zum Einsatz kommen können, bevor über eine operative Revision nachgedacht werden muss. Man sollte diese nicht erst einsetzen, wenn es zu spät ist, sondern möglichst früh im Heilungsverlauf mit der Therapie beginnen.
Stoßwellentherapie
Stoßwellen sorgen für eine stärkere Produktion von Wachstumsfaktoren, Stickoxiden und freien Radikalen, die den Heilungsprozess anstoßen. Dies kann man sich bei der Behandlung von Stressfrakturen zunutze machen [15]. Die Stoßwellentherapie induziert die Gefäßneubildung und mesenchymale Stammzellen differenzieren sich zu Osteoblasten. Darüber hinaus wird das Periost stimuliert, welchem ein großer Stellenwert in der Kallusbildung zukommt [15]. Es gibt mehrere Fallserien, die positive Ergebnisse bei Stressfrakturen berichten. Dabei wurden fokussierte, mittel- bis hochenergetische Stoßwellen verwendet. In den meisten Fällen wurden die gleichen Dosierungen genutzt wie bei Pseudoarthrosen. Die besten Ergebnisse konnten dabei mit jeweils 2000 Impulsen bei 0,2 mJ = mm2 in zwei Sitzungen erreicht werden. Bei Pseudoarthrosen gibt es neben Fallserien auch vereinzelt randomisierte, kontrollierte Studien. Hier unterschieden sich die Heilungsraten bei Stoßwellentherapie nicht von denen nach Operation. Dabei kamen meist 3 – 4 Sitzungen mit jeweils 4000 Impulsen bei einer Energieflussdichte von 0,09 – 0,7 mJ=mm2 zum Einsatz.
Pulsierende Magnetfeldtherapie (PEMF)
Auch die PEMF wird bei Pseudarthrosen oder verzögerter Knochenheilung propagiert. Studien zeigten, dass pseudoarthrotische Jones-Frakturen gut ausheilten, insbesondere wenn die Stimulation mehr als 9 Stunden/Tag appliziert wurde. Diese Geräte können nach vorheriger Einweisung und Aufklärung durch Fachpersonal vom Patienten selbst Zuhause angewendet werden. Ebenso war die Bruchheilung postoperativ schneller in der Treatment-Gruppe erreicht als in der Gruppe mit Placebo Magnetfeldtherapie [34]. Problematisch hinsichtlich der Evidenz der Ergebnisse stellt sich jedoch dar, dass nur in einer der bisherigen Studie eine Kontrollgruppe Teil des Studiendesigns war.
Ultraschall
Ähnlich verhält es sich beim therapeutischen Ultraschall. Studien weisen auf eine bessere Heilung bei Pseudoarthrosen hin, jedoch fehlte hier teilweise eine Kontrollgruppe [35, 14]. Es konnten gute Heilungsraten erreicht werden und einzelne Studie legen eine Kostenüberlegenheit gegenüber der operativen Revision nahe [14].
Plättchenreiches Plasma (PRP)
In Tierstudien zeigten sich positive Effekte von PRP auf die Frakturheilung [13]. Angesichts dieser Ergebnisse ist auch beim Menschen eine förderliche Wirkung denkbar. Praxiserfahrungen zeigen, dass die additive PRP-Behandlung bei prolongierten Heilungsverläufen durchaus zu positiven Verläufen der Frakturheilung führt. Insgesamt gibt es nur eine geringe Evidenz für eine Förderung der Frakturheilung [29]. Durch die Injektion von PRP zeigen sich jedoch Erfolge in der Schmerzlinderung und den damit verbundenen geringfügigeren biomechanischen Kompensationsmechanismen, sowie Schonhaltung und Bewegungsvermeidung [25, 37]. Für eine abschließende Beurteilung sind jedoch noch weitere evidenzbasierte Studien notwendig [16].
Fazit
Bei der Behandlung von Stressfrakturen der MFK ist es zunächst wichtig, die Ursache zu finden und Risikofakturen zu identifizieren. Dadurch können Folgeverletzungen vorgebeugt werden. Es sollte ein multimodales Therapiekonzept bestehend aus der Belastungsmodifikation und der Optimierung der Knochenheilung folgen. Gerade hinsichtlich der Belastungsmodifikation spielen die Schmerzen des Patienten eine zentrale Rolle. Hier sollte jedoch auf die Gabe von NSAR aufgrund ihres negativen Effekts auf die Frakturheilung verzichtet werden. Eine Reduktion der Schmerzen und Unterstützung der Knochenheilung kann auf Ebene der Ernährung, durch Stoßwellentherapie und gegebenenfalls ergänzender Magnetfeldtherapie erreicht werden.
Literatur
[1] Alexandra Abbott, Mackenzie L Bird, Emily Wild, Symone M Brown, Greg Stewart,
and Mary K Mulcahey. Part i: epidemiology and risk factors for stress fractures in
female athletes. The Physician and Sportsmedicine, 48(1):17-24, 2020.
[2] Michelle Barrack, Jenna Gibbs, Mary Jane De Souza, Nancy Williams, Jeanne
Nichols, Mitchell Rauh, and Aurelia Nattiv. Higher incidence of bone stress injuries with increasing female athlete triad-related risk factors a prospective multisite study of exercising girls and women. The American journal of sports medicine, 42, 02 2014. doi: 10.1177/0363546513520295.
[3] M Beck, A Wichelhaus, R Rotter, P Gierer, and T Mittlmeier. Mittel-und vorfußfrakturen. Der Unfallchirurg, 122(4):309-322, 2019.
[4] David Bica, Ryan A Sprouse, and Joseph Armen. Diagnosis and management of
common foot fractures. American family physician, 93(3):183-191, 2016.
[5] Paul Brinckmann, Wolfgang Frobin, Gunnar Leivseth, and Burkhard Drerup. Orthopädische Biomechanik. Westfälische Wilhelms-Universität, 2012.
[6] Hamit Cakir, ST Van Vliet-Koppert, EMM Van Lieshout, MR De Vries, Maarten Van Der Elst, and T Schepers. Demographics and outcome of metatarsal fractures. Archives of orthopaedic and trauma surgery, 131(2):241-245, 2011.
[7] Geoffrey J Dowling, George S Murley, Shannon E Munteanu, Melinda M Franettovich
Smith, Bradley S Neal, Ian B Griffiths, Christian J Barton, and Natalie J Collins.
Dynamic foot function as a risk factor for lower limb overuse injury: a systematic review. Journal of foot and ankle research, 7(1):53, 2014.
[8] Katherine M Edenfield, Charlie Michaudet, Guy W Nicolette, and Peter J Carek.
Foot and ankle conditions: Midfoot and forefoot conditions. FP essentials, 465:
30-34, 2018.
[9] Anton Eisenhauer, M Müller, Alexander Heuser, Ana Kolevica, C-C Glüer, M Both,
C Laue, Uv Hehn, S Kloth, R Shroff, et al. Calcium isotope ratios in blood and
urine: A new biomarker for the diagnosis of osteoporosis. Bone reports, 10:100200,
2019.
[10] Roberto Fabiani, Giulia Naldini, and Manuela Chiavarini. Dietary patterns in relation to low bone mineral density and fracture risk: a systematic review and metaanalysis. Advances in Nutrition, 10(2):219-236, 2019.
[11] Von C Fritsch and M Haslbeck. Was leistet die Pedographie? MMW. Fortschritte
der Medizin, 146(26):51-54, 2004.
[12] Heather E Gotha, Craig R Lareau, and Todd A Fellars. Diagnosis and management
of lisfranc injuries and metatarsal fractures. Rhode Island medical journal, 96(5):33, 2013.
[13] Yunus Guzel, Nazım Karalezli, Onur Bilge, Burkay K Kacira, Hasan Esen, Hakan
Karadag, Serdar Toker, Recep Gani Göncü, and Mahmut Nedim Doral. The biomechanical and histological effects of platelet-rich plasma on fracture healing. Knee Surgery, Sports Traumatology, Arthroscopy, 23(5):1378-1383, 2015.
[14] Ailish Higgins, Matthew Glover, Yaling Yang, Susan Bayliss, Catherine Meads, and
Joanne Lord. Exogen ultrasound bone healing system for long bone fractures with
non-union or delayed healing: a nice medical technology guidance. Applied health
economics and health policy, 12(5):477-484, 2014.
[15] Carlos Leal, Cristina D’Agostino, Santiago Gomez Garcia, and Arnold Fernandez. Current concepts of shockwave therapy in stress fractures. International Journal of Surgery, 24:195-200, 2015.
[16] L Leitner, G Gruber, B Lohberger, H Kaltenegger, A Leithner, and P Sadoghi. Klinische anwendung von platelet-rich plasma und wachstumsfaktoren am bewegungsapparat. Der Orthopäde, 48(1):105-116, 2019.
[17] Paul Lips. Vitamin d deficiency and secondary hyperparathyroidism in the elderly:
consequences for bone loss and fractures and therapeutic implications. Endocrine reviews, 22(4):477-501, 2001.
[18] Huai H Loh, Lee L Lim, Anne Yee, Huai S Loh, and Shireene R Vethakkan. Effect
of vitamin d replacement in primary hyperparathyroidism with concurrent vitamin d deficiency: a systematic review and meta-analysis. Minerva endocrinologica, 44(2):221-231, 2017.
[19] Raquel Ojeda López, Elvira Esquivias de Motta, Andrés Carmona, Victoria García
Montemayor, Isabel Berdud, Alejandro Martín Malo, and Pedro Aljama García. Correction of 25-oh-vitamin d deficiency improves control of secondary hyperparathy-roidism and reduces the inflammation in stable haemodialysis patients. Nefrología (English Edition), 38(1):41-47, 2018.
[20] P Luig, H Bloch, K Burkhardt, C Klein, and N Kühn. Vbg-sportreport 2017|analyse
des unfallgeschehens in den zwei höchsten ligen der männer: Basketball, eishockey,
fußball und handball. Hamburg: VBG, 2017.
[21] F Mazur, B Swoboda, HD Carl, C Lutter, M Engelhardt, MW Hoppe, T Hotfiel,
and C Grim. Plantar pressure changes in hindfoot relief devices of different designs.
Journal of experimental orthopaedics, 6(1):7, 2019.
[22] Nasser Mikhail. Clinical significance of vitamin d deficiency in primary hyperparathyroidism, and safety of vitamin d therapy. Southern medical journal, 104(1):29-33, 2011.
[23] Vijayadershan Muppidi, Sreenath R Meegada, and Anis Rehman. Secondary hyperparathyroidism. In StatPearls [Internet]. StatPearls Publishing, 2020.
[24] Hallie B Murray and Brian A Pethica. A follow-up study of the in-practice results
of pulsed electromagnetic field therapy in the management of nonunion fractures.
Orthopedic Research and Reviews, 8:67, 2016.
[25] H Namazi and A Mehbudi. Investigating the effect of intra-articular prp injection on
pain and function improvement in patients with distal radius fracture. Orthopaedics
& Traumatology: Surgery & Research, 102(1):47-52, 2016.
[26] HJ Oh, B-H Yoon, Y-C Ha, D-C Suh, S-M Lee, K-H Koo, and Y-K Lee. The change of bone mineral density and bone metabolism after gastrectomy for gastric cancer: a meta-analysis. Osteoporosis International, 31(2):267-275, 2020.
[27] Martin J O’Malley, William G Hamilton, John Munyak, and Michael J DeFranco.
Stress fractures at the base of the second metatarsal in ballet dancers. Foot & ankle
international, 17(2):89-94, 1996.
[28] Christopher J Richards, Kenneth W Graf, and Rakesh P Mashru. The effect of opioids, alcohol, and nonsteroidal anti-inflammatory drugs on fracture union. Orthopedic Clinics, 48(4):433-443, 2017.
[29] Alice Roffi, Berardo Di Matteo, Gopal Shankar Krishnakumar, Elizaveta Kon, and
Giuseppe Filardo. Platelet-rich plasma for the treatment of bone defects: from pre-clinical rational to evidence in the clinical practice. a systematic review. International orthopaedics, 41(2):221-237, 2017.
[30] Kurt M Rongstad, Jonathan Tueting, Meriel Rongstad, Katie Garrels, and Ryan
Meis. Fourth metatarsal base stress fractures in athletes: a case series. Foot & ankle
international, 34(7):962-968, 2013.
[31] Erik Bruun Simonsen. Contributions to the understanding of gait control. University
of Copenhagen Copenhagen, 2014.
[32] Alexander S Spiro, F Timo Beil, Anke Baranowsky, Florian Barvencik, Arndt F
Schilling, Khoa Nguyen, Shahram Khadem, Sebastian Seitz, Johannes M Rueger,
Thorsten Schinke, et al. Bmp-7-induced ectopic bone formation and fracture healing
is impaired by systemic nsaid application in c57bl/6-mice. Journal of Orthopaedic
Research, 28(6):785-791, 2010.
[33] Siobhan M Statuta. The female athlete triad, relative energy deficiency in sport, and
the male athlete triad: The exploration of low-energy syndromes in athletes. Current
Sports Medicine Reports, 19(2):43-44, 2020.
[34] Adam Streit, B Collier Watson, Jaymes D Granata, Terrence M Philbin, Hsuan-Ni Lin, J Patrick O’Connor, and Sheldon Lin. Effect on clinical outcome and growth factor synthesis with adjunctive use of pulsed electromagnetic fields for fifth metatarsal nonunion fracture: a double-blind randomized study. Foot & ankle international, 37 (9):919-923, 2016.
[35] Kar Hao Teoh, Robert Whitham, Jenny F Wong, and Kartik Hariharan. The use of
low-intensity pulsed ultrasound in treating delayed union of fifth metatarsal fractures.
The Foot, 35:52-55, 2018.
[36] MJ Welck, T Hayes, P Pastides, W Khan, and B Rudge. Stress fractures of the foot
and ankle. Injury, 48(8):1722-1726, 2017.
[37] Yung-Tsan Wu, Kao-Chih Hsu, Tsung-Ying Li, Cheng-Kuang Chang, and LiangCheng Chen. Effects of platelet-rich plasma on pain and muscle strength in patients with knee osteoarthritis. American journal of physical medicine & rehabilitation, 97 (4):248-254, 2018.
[38] Shuai Yuan, Karl Michaelsson, Zihao Wan, and Susanna C Larsson. Associations of smoking and alcohol and coffee intake with fracture and bone mineral density: a mendelian randomization study. Calcified tissue international, 105(6):582-588, 2019.
Autoren
ist wissenschaftliche Koordinatorin am LANS Medicum. Sie hat sich zuvor an der Deutschen Sporthochschule Köln in Exercise Science and Coaching (M. Sc.) spezialisiert und war selbst im Schwimmleistungssport aktiv.
ist Facharzt für Orthopädie und Unfallchirurgie, Spezielle Unfallchirurgie und Sportmedizin. Er ist Gründer und Inhaber des LANS Medicum. Seine mannschaftsärztlichen Betreuungen umfassten u. a. das Handballteam des HSV sowie von 2011-2014 die Erstligafußballmannschaft des Hamburger SV. Heute betreut er mit seinem Team mehrere Fußball- und Hockeyteams sowie das Hamburger Ballett von John Neumeier. Außerdem ist Prof. Catalá-Lehnen als Professor für den Schwerpunkt Orthopädie an der Medical School Hamburg und am UKE in der Lehre für das Fach Knochenpathologie tätig.
ist Sportwissenschaftler und Assistenzarzt in der Weiterbildung zum Facharzt für Orthopädie und Unfallchirurgie am Städtischen Klinikum Lüneburg. Am LANS Medicum betreut er die Leistensprechstunde.