Durch den wissenschaftlichen und technologischen Fortschritt der letzten Jahre haben sich Proteintherapeutika zu einer der wichtigsten Klassen neuer Arzneistoffe entwickelt [1]. Sie umfassen sowohl rekombinant hergestellten Versionen natürlich vorkommender Proteine wie beispielsweise Wachstumsfaktoren, Enzyme, Hormone, und Gerinnungshemmer, als auch Fc-Fusionsproteine und therapeutische Antikörper.
Bei den ersten Protein-Arzneistoffen handelte es sich vor allem um gentechnisch hergestellte Wirkstoffe, mit denen entweder ein Proteinmangel kompensiert (z. B. Insulin, Wachstumshormon) oder ein existierender Signalweg des Körpers stimuliert werden kann (z. B. Erythropoietin). Um das therapeutische Potenzial der Substanzen zu erhöhen, wurde schon bald versucht, durch gezielte Modifikation der Proteinstruktur – beispielsweise durch einen Austausch von Aminosäuren und das Einbringen von zusätzlichen Zuckerresten (Glykosylierungen) oder PEGylierungen – ihre biologische Halbwertszeit und Effektorfunktionen zu verbessern. Eine weitere Strategie, um die biologischen und pharmakologischen Eigenschaften von therapeutischen Proteinen zu verbessern, ist die Generierung von Fc-Fusionsproteinen [1, 2]. Durch die Verknüpfung eines therapeutisch wirksamen Proteins / Peptids mit der Fc-Domäne von humanem Immunoglobulin G (IgG) werden dem Fusionspartner einige für Antikörper typische Eigenschaften verliehen: Infolge des höheren Molekulargewichtes und Recycling-Prozessen über den neonatalen Fc-Rezeptor verlängert sich die biologische Halbwertszeit von wenigen Minuten bis Stunden auf mehrere Tage oder sogar Wochen. Außerdem zeichnen sich Fc-Fusionsproteine durch eine verbesserte Löslichkeit und höhere Stabilität aus und können während des Produktionsprozesses einfach mittels Protein A oder G gereinigt werden. Die Interaktion der Fusionsproteine mit den Fc-Rezeptoren von Immunzellen eröffnet zudem neue therapeutische Ansätze. Therapeutische Antikörper sind eine äußerst schnell wachsende Substanzklasse und können für die Therapie einer Vielzahl von Krankheiten wie Krebs, Infektionen und Autoimmunerkrankungen genutzt werden [1, 3, 4]. Antikörperbasierte Arzneistoffe binden ihr Antigen mit einer hohen Affinität und Spezifität, haben lange biologische Halbwertszeiten von mehreren Wochen und eine gute Verträglichkeit. Ihre therapeutische Wirksamkeit wird jedoch durch eine mögliche Immunogenität und die schlechte Gewebepenetration limitiert, sodass normalerweise hohe Dosen von mehreren Milligramm pro Kilogramm Körpergewicht verabreicht werden müssen. Die Immunogenität hängt vor allem vom Grad der Humanisierung ab: Während chimäre Antikörper zu etwa 70 % human sind und nur die variablen Antikörperdomänen murinen Ursprungs sind, bestehen humanisierte Antikörper zu 85 – 90 % aus humanen Sequenzen – lediglich die Antigen-Bindestellen stammen noch aus der Maus. Humane Antikörper sind dementsprechend vollständig menschlichen Ursprungs und haben die geringste Immunogenität.
Der Missbrauch von therapeutischen Proteinen im Sport ist sowohl innerhalb als auch außerhalb des Wettkampfes verboten. In der Verbotsliste der Welt Anti-Doping Agentur (WADA) sind zahlreiche protein- und peptidbasierte Wirkstoffe in den Klassen S2 „Peptidhormone, Wachstumsfaktoren, verwandte Substanzen, und Mimetika“ und S4 „Hormon- und Stoffwechsel-Modulatoren“ aufgeführt [5]. Für ihren Nachweis in Blut und / oder Urin stehen immunologische und massenspektrometrische Nachweisverfahren zur Verfügung. Auch wenn einige der verbotenen Proteintherapeutika noch keine klinische Zulassung haben, sind verwandte Substanzen bereits für Forschungszwecke und auf dem Schwarzmarkt erhältlich. Somit ist es für die präventive Dopingforschung von höchster Wichtigkeit, proaktiv empfindliche und spezifische Nachweismethoden zu entwickeln. Im Rahmen dieses Artikels sollen nun zwei neue Klassen an Proteintherapeutika sowie mögliche Strategien für ihren Nachweis in biologischen Proben vorgestellt werden.
TGF-β Inhibitoren als neue Erythropoiesie- stimulierende Agenzien
Insbesondere in Ausdauersportarten wird die körperliche Leistungsfähigkeit durch die Sauerstoffversorgung der Muskulatur limitiert [6]. Um die Anzahl der zirkulierenden Erythrozyten und damit die Sauerstofftransportkapazität des Blutes künstlich zu erhöhen, greifen manche Athleten auf Bluttransfusionen, künstliche Sauerstoffträger (z. B. quervernetztes Hämoglobin), oder Erythropoiese-stimulierende Agenzien zurück. Zu Letzteren zählen neben dem Peptidhormon Erythropoietin (EPO) und seinen Derivaten auch niedermolekulare HIF-Stabilisatoren, EPO-mimetische Peptide, und TGF-β (Transforming Growth Factor beta) Inhibitoren [6, 7].
Während durch EPO vor allem die ersten Schritte der Erythropoiese stimuliert werden, sind Zytokine aus der TGF-β Superfamilie wie z. B. GDF-11 für die negative Regulation der späteren Phasen dieses komplexen Prozesses verantwortlich [8, 9]. TGF-β Inhibitoren stellen somit nicht nur potenztielle Dopingsubstanzen dar, sondern auch vielversprechende Therapeutika für Bluterkrankungen, welche durch eine EPO-unabhängige Störung der Erythropoiese verursacht werden. Derzeit befinden sich zwei unterschiedliche TGF-β Inhibitoren in der klinischen Entwicklung: Sotatercept (ActRIIA-Fc) und Luspatercept (modifiziertes ActRIIB-Fc). Bei beiden Substanzen handelt es sich um rekombinant hergestellte Fusionsproteine aus der extrazellulären Domäne des humanen Activin-Rezeptors des Typs IIA oder B (ActRIIA bzw. ActRIIB) sowie der Fc-Domäne von humanem IgG1 [8-12]. Während in Sotatercept die unveränderte Aminosäuresequenz der extrazellulären Rezeptordomäne verwendet wurde, sind der N- und C-Terminus der ActRIIB-Domäne in Luspatercept verkürzt und es wurde zudem ein Aminosäureaustausch vorgenommen, um die Affinität für den Wachstumsfaktor Activin A zu reduzieren. Sotatercept und Luspatercept wirken als so genannte „Liganden-Fallen“, welche im Körper zirkulierende TGF-β Zytokine abfangen und so die Aktivierung der endogenen Rezeptoren ActRIIA und ActRIIB verhindern (Abb. 1). Während die Erythropoiese-stimulierende Wirkung vermutlich vor allem über die Neutralisation von GDF-11 zustande kommt, blockiert Sotatercept zusätzlich noch negative Regulatoren der Knochenbildung wie beispielsweise Activin A. Aus diesem Grund wurde das Proteintherapeutikum sowohl für die Behandlung von Osteoporose, als auch anämischen Zuständen bei seltenen Bluterkrankungen entwickelt. Neuerdings wird Sotatercept außerdem für die Therapie von pulmonaler Hypertonie getestet [13]. Luspatercept ist hingegen der führende Produktkandidat von Acceleron Pharma für die Behandlung von chronischer Anämie bei unterschiedlichsten hämatopoietischen Erkrankungen wie z. B. β-Thalassämie und Myelofibrose [14].

Auch wenn sich beide Substanzen noch in der klinischen Entwicklung befinden, gibt es bereits immunologische und massenspektrometrische Nachweisverfahren für die Dopinganalytik (Abb. 2). Hierbei werden die Zielsubstanzen zunächst per Affinitätsreinigung mit Activin A-gekoppelten magnetischen Partikeln [15] oder Immunoaffinitätsreinigung mit Antikörpern, die gegen die extrazellulären Rezeptordomänen gerichtet sind [16 – 20], aus der biologischen Matrix (Serum / Plasma) isoliert. Bei den immunologischen Nachweisverfahren von Sotatercept und Luspatercept erfolgen dann eine Auftrennung mittels Gelelektrophorese (SAR- / SDS-PAGE) [17, 18, 20] oder Isoelektrischer Fokussierung (IEF) [19] und Western Blot-basierte Detektion. Für einen massenspektrometrischen Nachweis werden die isolierten Proteine hingegen zunächst mit der Protease Trypsin verdaut. Charakteristische Peptide, die eine zweifelsfreie Identifizierung der Fusionsproteine ermöglichen, können anschließend mittels Flüssigkeitschromatographie und hochauflösender Massenspektrometrie (LC-HRMS) nachgewiesen werden [15, 16].

Myostatin Inhibitoren
Um die Muskelmasse des Körpers künstlich zu steigern, greifen dopende Sportler schon seit den 1930er Jahren auf anabole Steroide zurück [21]. Inzwischen hat jedoch auch eine andere Substanzklasse die Aufmerksamkeit der Sportler und der pharmazeutischen Industrie erregt: Myostatin Inhibitoren [22, 23]. Bei Myostatin handelt es sich um ein Zytokin aus der TGF-β Superfamilie, welches das Wachstum der Skelettmuskulatur limitiert [24]. Sowohl in Myostatin-Knockout-Mäusen als auch verschiedenen Tierspezies mit natürlich vorkommenden Mutationen im Myostatin-Gen konnte eine enorme Zunahme der Muskelmasse festgestellt werden [23, 25]. Aus diesem Grund stellt Myostatin einen vielsprechenden therapeutischen Angriffspunkt für die Behandlung von muskulären und metabolischen Erkrankungen wie beispielsweise Muskeldystrophien und Diabetes mellitus Typ 2 dar.
Eine Vielzahl an unterschiedlichen Myostatin-Inhibitoren ist derzeit in der klinischen Entwicklung (Abb. 3) [22, 23, 25]: Sowohl humane und humanisierte Anti-Myostatin Antikörper wie z. B. Domagrozumab (Pfizer) und Landogrozumab (Eli Lilly), als auch Myostatin-bindende Proteine wie der Peptibody PINTA-745 (Amgen / Atara Biotherapeutics) und das Adnectin BMS-986089 (Bristol-Myers Squibb) binden hochspezifisch an das zirkulierende Zytokin und verhindern so die Aktivierung der Zielrezeptoren auf den Muskelzellen. Im Gegensatz dazu gibt es auch Agenzien welche gleich mehrere negative Regulatoren der Skelettmuskelmasse inhibieren (Multi-Target-Prinzip). Bimagrumab (Novartis) ist ein humaner Antikörper, welcher gegen die extrazellulären Domänen der Activin Typ II Rezeptoren gerichtet ist und somit die Interaktion mit unterschiedlichsten Liganden unterbindet. Analog zu Sotatercept und Luspatercept sind Ramatercept (ACE-031) und ACE-2494 Fusionsproteine aus der extrazellulären Domäne des Activin Typ IIB Rezeptors und der Fc-Domäne von humanem IgG1. Sie wirken ebenfalls als „Liganden-Fallen“, welche die Wechselwirkung zwischen TGF-β Zytokinen und dem Activin Typ IIB Rezeptor unterbinden. Da es in den klinischen Studien mit Ramatercept zu unterwünschen Nebenwirkungen wie Nasenbluten und Teleangiektasien kam, welche vermutlich auf die Hemmung der Wachstumsfaktoren BMP9 und BMP10 zurückzuführen sind [26], wurde ACE-2494 so modifiziert, dass es eine verminderte Affinität für diese Zytokine hat [27]. ACE-083 (Acceleron Pharma) ist ein Fusionsprotein aus Follistatin und der Fc-Domäne von Immunoglobulin G2, welches durch Bindung an Myostatin und weitere Wachstumsfaktoren aus der TGF-β Superfamilie ihre Anlagerung an die Activin Typ II Rezeptoren verhindert.
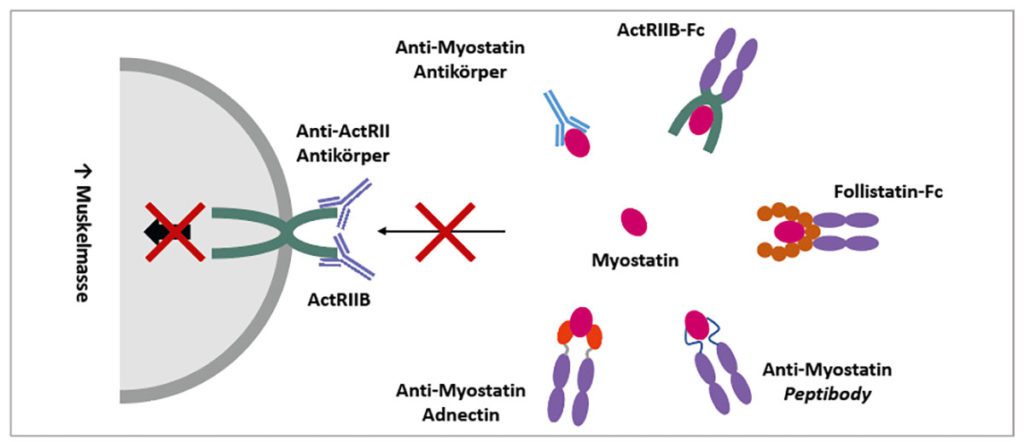
Bisher hat keiner der beschriebenen Myostatin-Inhibitoren die klinische Zulassung erreicht und bei einigen Substanzen wurde die Entwicklung aufgrund nicht erreichter Studienendpunkte vorzeitig beendet. Nichtsdestotrotz konnten für einzelne Vertreter dieser Substanzklasse bereits Nachweismethoden für die Dopinganalytik entwickelt werden. Für den Nachweis von Anti-Myostatin Antikörpern wurde eine indirekte Western Blot-basierte Methode etabliert, bei welcher die Affinität für Myostatin und das Vorhandensein einer humanen Fc-Domäne aufgezeigt werden [28]. Sowohl für den Anti-ActRII Antikörper Bimagrumab, als auch ActRIIB-Fc Fusionsproteine wie Ramatercept konnten zudem direkte massenspektrometrische Nachweisverfahren entwickelt werden, bei denen die Analyten zunächst mittels Affinitätsreinigung über ActRIIB- und Activin A-gekoppelte magnetische Partikel aus Serum / Plasma isoliert, mit der Protease Trypsin verdaut und anhand von charakteristischen Peptiden schließlich mittels LC-HRMS detektiert werden [29, 30]. Sämtliche Assays können problemlos um weitere Myostatin-Inhibitoren erweitert werden, sobald entsprechendes Referenzmaterial – entweder durch klinische Zulassung oder Kooperationen mit der pharmazeutischen Industrie – zur Verfügung steht.
Fazit
Proteintherapeutika stellen eine sehr wichtige und kontinuierlich wachsende Klasse von Arzneistoffen dar und umfassen zahlreiche Substanzen mit potentiell leistungssteigernder Wirkung. Insbesondere Inhibitoren der TGF-β Zytokine Myostatin, GDF-11 und Activin A, sowie weitere proteinbasierte Modulatoren des Myostatin-Signalweges könnten aufgrund ihrer positiven Effekte auf Blutbildung und Muskelwachstum für Dopingzwecke missbraucht werden. Bereits vor der klinischen Zulassung konnten für einige dieser Substanzen proaktiv immunologische und / oder massenspektrometrische Nachweisverfahren entwickelt werden, welche eine spezifische und sensitive Detektion in Serum ermöglichen und somit den Kampf gegen Doping im Sport weiter vorantreiben.
Literatur
[1] P.J. Carter, Introduction to current and future protein therapeutics: a protein engineering perspective. Exp Cell Res. 2011, 317, 1261–1269.
[2] D.M. Czajkowsky, J. Hu, Z. Shao, R.J. Pleass, Fc-fusion proteins: new developments and future perspectives. EMBO Mol Med. 2012, 4, 1015–1028.
[3] P. Chames, M. Van Regenmortel, E. Weiss, D. Baty, Therapeutic antibodies: successes, limitations and hopes for the future. Br J Pharmacol. 2009, 157, 220–233.
[4] J.M. Reichert, C.J. Rosensweig, L.B. Faden, M.C. Dewitz, Monoclonal antibody successes in the clinic. Nat Biotechnol. 2005, 23, 1073–1078.
[5] World Anti-Doping Agency, The World Anti-Doping Code – International Standard: Prohibited List (January 2018). 2017. Verfügbar unter: https://www.wada-ama.org/
[6] W. Jelkmann, C. Lundby, Blood doping and its detection. Blood. 2011, 118, 2395–2404.
Autoren
ist forensischer Chemiker (GTFCh), seit 2006 Professor für Präventive Dopingforschung und seit 2017 Leiter des Instituts für Biochemie der DSHS Köln, womit auch die Leitung des ansässigen WADA-akkreditierten Dopingkontroll-Labors einhergeht. Das Institut forscht schwerpunktmäßig im Bereich neuer dopingrelevanter Substanzen und deren Nachweisbarkeiten sowie in der Etablierung alternativer Teststrategien und – matrices.
hat Biologie studiert und am Institut für Biochemie / Zentrum für Präventive Dopingforschung der DSHS Köln im Fach Biochemie promoviert. Seit 2013 ist sie dort als wiss. Mitarbeiterin beschäftigt und unter anderem für die Entwicklung von Nachweisverfahren für neue Proteintherapeutika verantwortlich.