Die potenziellen Effekte von (Leistungs)Sport auf die Morphologie und Funktion des Herzens sind vielfältig und mittlerweile gut erforscht. Diese myokardialen Anpassungen durch körperliches Training waren bereits im späten 19. Jahrhundert Gegenstand sportmedizinischen Interesses: So dokumentierte der Schwede Dr. Henschen um 1890 deutlich vergrößerte „Sportherzen“ bei Skilangläufern und der Amerikaner
Dr. White um 1900 Sinusbradykardien bei Teilnehmern des Boston-Marathons.
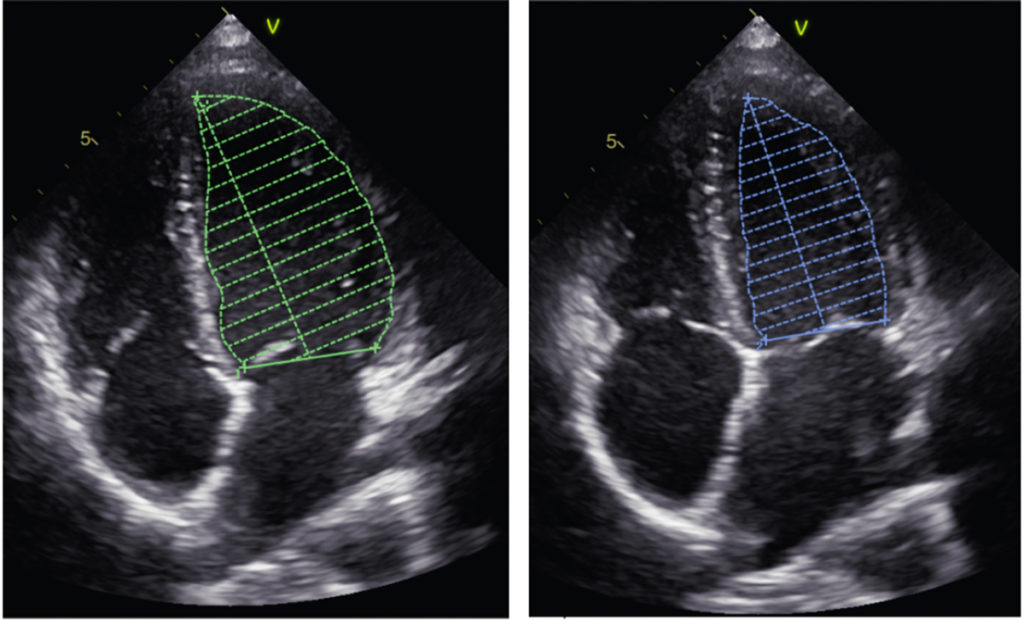
Dr. Henschen bediente sich übrigens der Auskultation und Perkussion, um die Herzdimensionen zu erfassen. Mitte des 20. Jahrhunderts wurden die diagnostischen Möglichkeiten um das Röntgen, das EKG und – nicht zuletzt – die Echokardiografie erweitert [1]. Die sportkardiologische Diagnostik ist ein gut etablierter Eckpfeiler in der Betreuung von Spitzensportlern. So kommt sie bei akuten Fragestellungen erkrankter oder leistungsreduzierter Athleten zum Einsatz, als auch bei der regelmäßigen und obligaten Sporttauglichkeitsuntersuchung der diversen Verbände. Eine elementare Komponente dieser Diagnostik ist die Echokardiografie, die heutzutage durch hochauflösende Resolution sowohl visuelle als auch Softwaregestützte Beurteilung der Funktion kardialer Strukturen durch den Erfahrenen Untersucher zulässt. Lange galt – und gilt nach wie vor – die Ejektionsfraktion (EF) als wichtigster Parameter zur Beurteilung der myokardialen Funktion. Hierbei wird in der 2-D-Echokardiografie im 2- und 4-Kammer-Blick das Endokard jeweils in der Diastole und Systole markiert und mit der Simpson-Formel die Auswurfleistung des Herzens berechnet (Abb. 1).
Speckle Tracking
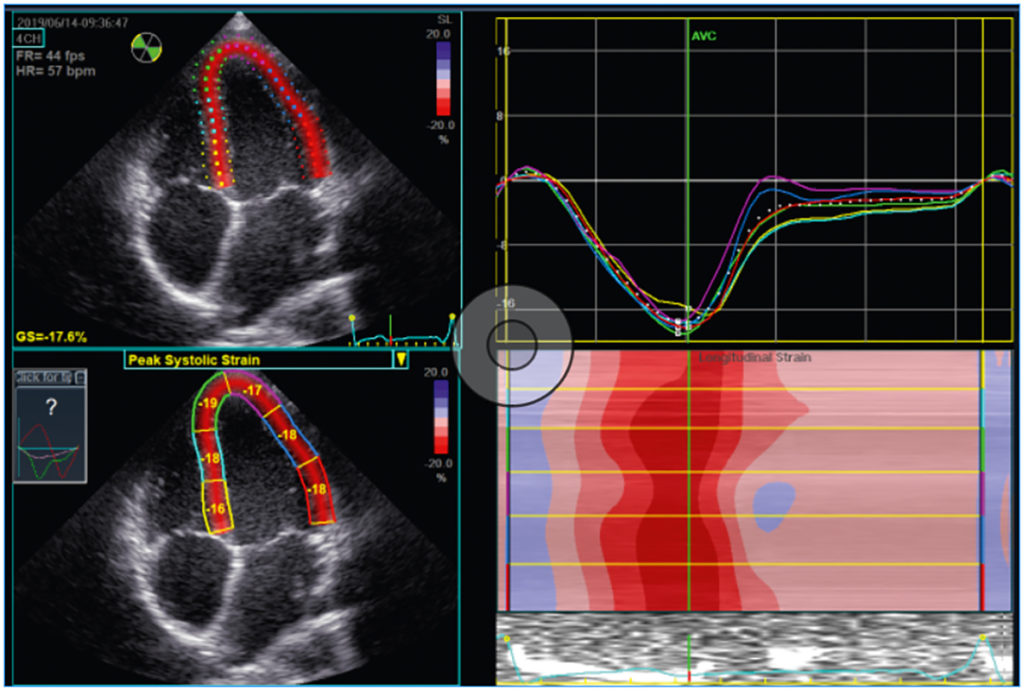
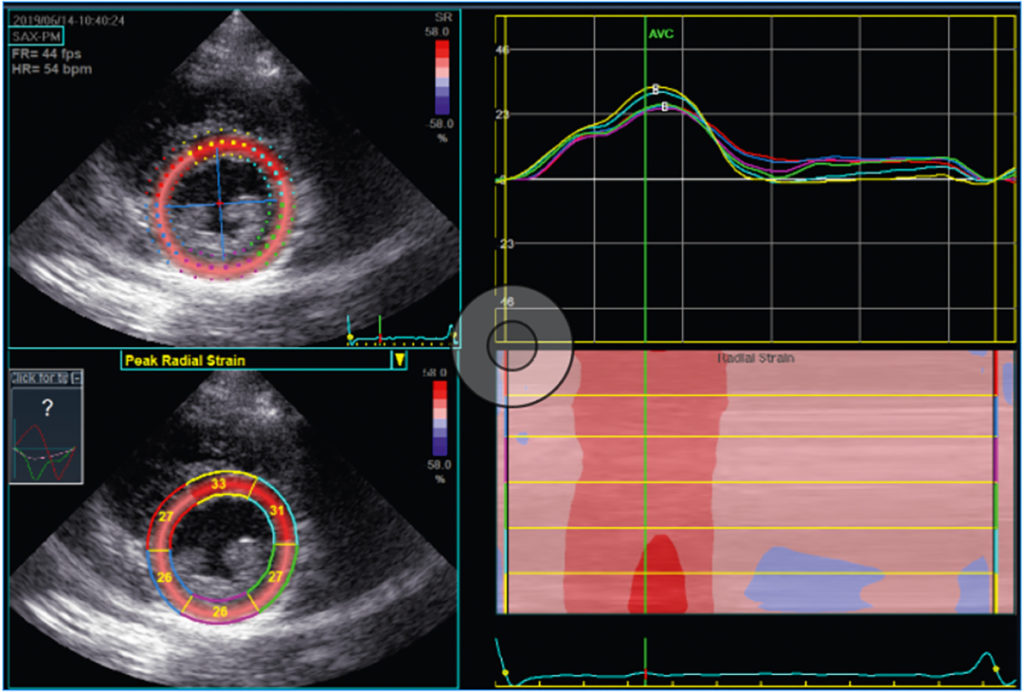
In den letzten Jahren hat die relativ neue bildgebende Technik des Speckle Tracking, speziell die Speckle Tracking Echokardiografie (STE), die diagnostischen Möglichkeiten hinsichtlich der Beurteilung der myokardialen Funktion signifikant erweitert. Hierbei werden von der Echokardiografie-Software einzelne oder mehrere Punkte (engl. Speckles) des dargestellten Myokards im Verlauf der Herzzyklus verfolgt. Dies lässt Erkenntnisse hinsichtlich der Kontraktilität in Ebenen zu, die mit dem bloßen Auge nicht nachvollziehbar sind (im Gegensatz zur Ejektionsfraktion). So werden beispielsweise der longitudinale Strain (Annäherung zwischen Herzspitze und Herzbasis) oder der radiale Strain (Verdickung des Myokards) berechnet (Abb. 2 und 3 respektive). Diese Berechnung geschieht für diverse myokardiale Segmente, sodass letztlich aus verschiedenen Einstellungen der 2-D-Echokardiografie globale Werte für den dreidimensionalen linken Ventrikel berechnet werden können (gleiches gilt für die Vorhöfe und, eingeschränkt, für den rechten Ventrikel). So werden für jedes myokardiale Segment Strainspitzenwerte aus dem 2-, 3- und 4-Kammerblick berechnet und zu einer vereinfachten Ansicht, dem Bulls-Eye, zusammengefasst, sowie ein einzelner Mittelwert für den linken Ventrikel als Globaler Longitudinaler Strain (GLS) errechnet (Abb. 4).
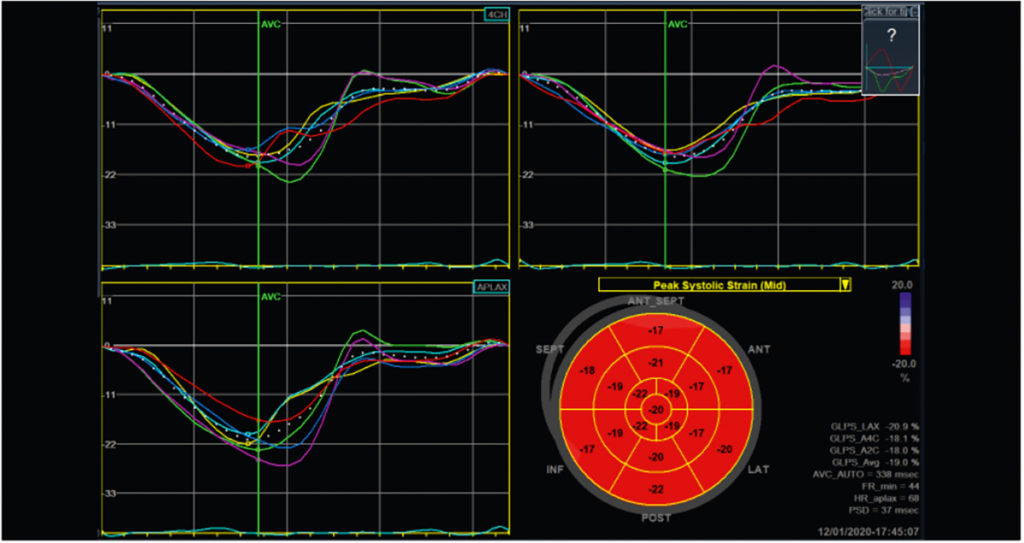
Die Berechnung des myokardialen Strains findet mittlerweile eine breite Anwendung in der Kardiologie: So dient der GLS als Prädiktor kardiovaskulärer Mortalität bei Gesunden, als Parameter in der Diagnostik der kardialen Amyloidose, zur Beurteilung kardiotoxischer Effekte einer Chemotherapie, zur Detektion myokardialer Inflammation oder pathologischer Herzmuskelhypertrophie [2]. Speziell letztere zwei Anwendungen spielen eine Rolle im sportkardiologischen Alltag. Ambitionierte Athleten vernachlässigen oft die bei einem Infekt nötige körperliche Schonung, was im Verlauf wiederholt zu der Frage nach einer möglichen Myokarditis führt. Diesbezüglich – einer häufig komplexen Fragestellung – bietet die Strain Analyse dem Sportkardiologen bzw. Sportmediziner ein neues, hilfreiches Tool. Lokale Reduktion des longitudinalen Strains, erkennbar im Bulls-Eye oder der Segmentdarstellung, kann Hinweis auf einen lokalen entzündlichen Prozess sein [2]. Deutlich häufiger als inflammatorische Prozesse ist die myokardiale Hypertrophie bei Leistungssportlern. In den allermeisten Fällen ist eine signifikante Verdickung des Ventrikelseptums als Sportanpassung im Sinne einer physiologischen, exzentrischen Hypertrophie gut erkennbar und nachvollziehbar (Abb. 5). In einigen Fällen stellt sich jedoch die Frage, ob pathologische Mechanismen eine Septumhypertrophie verursacht haben könnten. Hierzu zählen eine begleitende Arterielle Hypertonie, ein konzentrischer Hypertrophieaspekt oder Hinweise auf eine mögliche hypertrophe Kardiomyopathie (z. B. apikale Hypertrophie, familiäre Häufung oder sehr ausgeprägte Hypertrophie). Während die physiologische Anpassung im Sinne eines Sportherzens nach derzeitigem Erkenntnisstand keine Effekte auf die kardialen Strainwerte hat, sind diese durch die diversen pathologischen Mechanismen – teils sehr deutlich – reduziert [2, 3].
Fazit
Die Strainanalyse bietet durch Speckle Tracking Echokardiografie dem Sportkardiologen und Sportmediziner ein effektives neues Tool im diagnostischen Alltag. Weitere Forschung hinsichtlich der Effekte sportlicher Aktivität auf die diversen kardialen Strainparameter ist nötig, z. B. um Unterschiede in verschiedenen Sportdisziplinen oder zwischen den Geschlechtern zu untersuchen. Einer Aufgabe, der wir uns auch an der Deutschen Sporthochschule im Institut für Kreislaufforschung und Sportmedizin stellen.
Literatur
[1] Rost R (1997) THE ATHLETE’S HEART: Historical Perspectives—
Solved and Unsolved Problems. Cardiology Clinics 15(3): 493–512. doi: 10.1016/S0733-8651(05)70355-6
[2] Collier P, Phelan D, Klein A (2017) A Test in Context: Myocardial Strain Measured by Speckle-Tracking Echocardiography. Journal of the American College of Cardiology 69(8): 1043–1056. doi: 10.1016/j.jacc.2016.12.012
[3] D’Ascenzi F, Caselli S, Solari M et al. (2016) Novel echocardiographic
techniques for the evaluation of athletes’ heart: A focus on speckle-tracking echocardiography. Eur J Prev Cardiol 23(4): 437–446. doi: 10.1177/
2047487315586095
Autoren
studierte bis 2006 Sport an der Deutschen Sporthochschule Köln, anschließend bis 2013 Medizin an der Universität zu Köln. Bis 2018 arbeitete er in der Klinik für Kardiologie, Elektrophysiologie und Rhythmologie des Krankenhaus Porz am Rhein. Seit 2018 ist Dr. Zacher als stellvertretender Leiter der Abteilung I des Instituts für Kreislaufforschung und Sportmedizin der Deutschen Sporthochschule Köln und in der kardiologischen Gemeinschaftspraxis Kardiozentrum-Köln tätig. Seine Forschungsschwerpunkte sind die Effekte von Trainingstherapie bei Herzrhythmusstörungen, sowie kardiale Trainingsadaptationen erkrankter und gesunder Herzen.