Neue Grundlagenerkenntnisse zum strukturellen Aufbau, 3D Mikromechanik und der molekularbiologischen Zusammensetzung. Eine der biologisch raffiniertesten Hart-Weichübergänge in der Natur stellt das Interface zwischen Sehne und Knochen dar. Dieses Interface, die sogenannte Enthese, beschreibt die anatomische Region, an der die Sehne in den Knochen inseriert. Über diese Verbindungsstelle werden zum Teil erhebliche Muskelkräfte übertragen, die z. B. im Bereich der Achillessehne ein Mehrfaches des Körpergewichts darstellen.
Aus bionischer und ingenieurstechnischer Sicht ist dabei äußerst erstaunlich, dass diese hohen Lasten bei derartigen fibrokartilaginären Enthesen auch noch aus verschiedenen Winkelstellungen zwischen Sehne und Knochen übertragen werden können, ohne nach mehrfachen Lastwechseln an der Kontaktstelle zu reißen (Abb. 1), obwohl beide „Werkstoffe“ extrem unterschiedliche Materialeigenschaften haben. So unterscheiden sich beispielsweise die Elastizitätswerte erheblich mit einem 40-fach (!) unterschiedlichem Young‘s Modulus für die Sehne (0,45 GPa) gegenüber dem Knochen (20 GPa) [1, 2]. Umso erstaunlicher ist es, dass wir aus unserer klinischen Erfahrung wissen, dass diese Interfaceregion in der Regel nicht direkt am Übergang von Sehne zu Knochen versagt, sondern bei Kindern eher ein Teil der ossären Verankerung ausreißt und beim Erwachsenen in der Regel die Sehne mehrere Millimeter entfernt von der Knocheninsertion rupturiert [3, 4].
Andererseits haben Läsionen im Bereich der Sehnenansätze, beispielsweise der Rotatorenmanschette, eine hohe Inzidenz und werden heutzutage nicht selten operativ versorgt mit dem Ziel, das distale Sehnenende im Knochen zu refixieren. Diese Eingriffe haben eine relativ hohe Versagensrate mit entsprechenden Rerupturen und machen oft Revisionseingriffe nötig [5]. Einer der Gründe für diese relativ hohen Versagensraten liegt an dem bisher noch unzureichend Verständnis des komplexen physiologischen Aufbaus und der dadurch bedingten spezifischen biomechanischen Eigenschaften der Enthese. Um diesen außergewöhnlichen Hart-Weichübergang sowohl für neue Therapieoptionen als auch unter dem Aspekt potenziell neuer biomimetisch-technischer Lösungsansätze besser zu verstehen, wurde im Rahmen eines DFG geförderten Projektes systematisch die geometrische Mikrostruktur, die lastabhängige Deformation des Interface-Sehnengewebes sowie die molekularbiologische Zusammensetzung am Beispiel der porcinen Achillessehne untersucht. In enger Kooperation innerhalb der Technischen Universität München mit der Klinik für Orthopädie und Sportorthopädie, der Lehrstühle für Zelluläre Biophysik, Organische Chemie II, Biomedizinische Physik sowie des Lehrstuhls für Computational Mechanics [1, 6] konnten dabei wichtige neue Erkenntnisse dieses Knochen-Sehnenüberganges gewonnen werden. Im Folgenden sollen die neuen grundlagenorientierten Erkenntnisse dieses hochkomplexen Sehnen- Knochenübergangs in kursorischer Form dargestellt werden.
Struktureller Aufbau
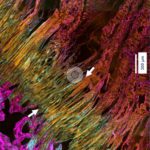
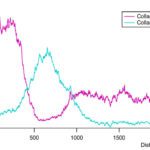
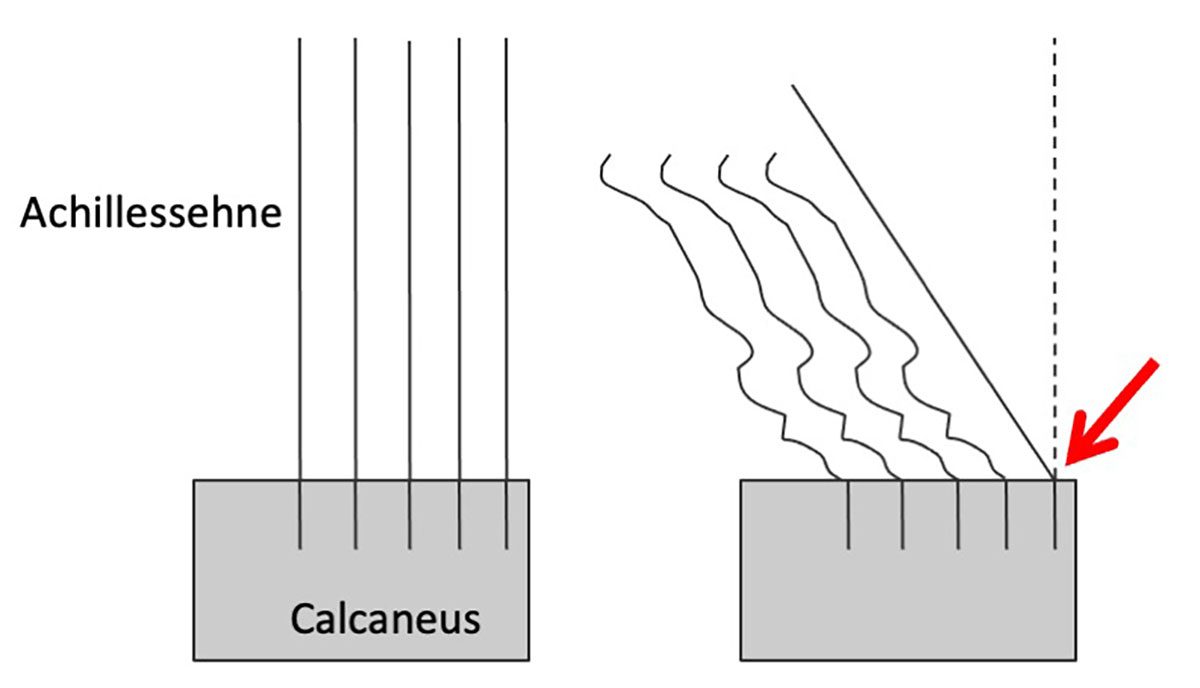
Um den mikrostrukturellen Aufbau zu charakterisieren, wurden die Proben mittels konfokaler Multiskalen-Bildgebung, Elektronenmikroskopie und hochauflösender Mikrocomputertomographie untersucht. Bei den Untersuchungen zur Mikrostruktur zeigte sich auf Basis dieses neuartigen µ-CT-Verfahrens und konfokaler Fluoreszenzmikroskopie, dass in der ca. 500 µm breiten Interfacezone (Abb. 2) sowohl die Faserstärke als auch deren biomolekulare Zusammensetzung gegenüber dem Sehnengewebe erhebliche Unterschiede aufweist. Im Gegensatz zu Knochen und Sehne, bei der Kollagen Typ I die Hauptkomponente darstellt, ist im Bereich der Enthese vorwiegend Kollagen Typ II nachweisbar (Abb. 3 und 4). Außerdem ändert sich der Faserdurchmesser im Sehnengewebe von 105 µm im Mittel (± 21 µm) auf deutlich dünnere mittlere Faserdurchmesser von ca. 13 µm (± 4 µm) (Abb. 2 und 3). Gleichzeitig fächern sich diese Interfacefasern mit Winkelwerten von bis zu 15° auf, bevor sie am Knochen ansetzen (Abb. 5).
Die Anheftung an den Knochen erfolgt dabei entlang einer ossären Oberfläche, deren Kontaktzone auf Grund der rauen, lakunenartigen Strukturierung erheblich vergrößert wird und die Interface-Fasern sich so mit dem Knochen regelrecht verzahnen. Die Spreizung der Interface-Fasern und die Verzahnung im Bereich der Kontaktzonen vergrößern die Fläche zusätzlich, über die die Kräfte übertragen werden, wodurch die Befestigungen belastbarer und resilienter werden auf Grund der damit verbundenen Reduktion der Spannungskonzentrationen [8]. Eine weitere wichtige Folge der Spreizung und Auffächerung der Fasern ist, dass die Kräfte in verschiedenen, z. T. vergleichsweise flachen Winkeln übertragen werden können und damit eine weitere Reduktion der Spannungsspitzen erfolgt. Entsprechend stellt die Spreizung und Auffächerung der Interfacefasern im Bereich der Knochenkontaktzone ein essentielles Schlüsselmerkmal dar, das die hohe Belastbarkeit und Resilienz der Enthese erklärt und entsprechend Rupturen im Bereich des Interfaces durch Minimierung von kritischen Spannungsspitzen verhindert werden.
3D Mikromechanik
Im Rahmen der mikromechanischen Untersuchungen, bei denen gezielt mittels konfokalen Mikroskops das Deformationsverhalten unter verschiedenen Lasten analysiert wurde, konnte gezeigt werden, dass es zu heterogenen, winkel- und lastabhängigen Dehnungsverteilungen in dem Sehnenanteil kommt, während die Interfaceregion sich relativ homogen verhält und erheblich nachgiebiger als der Knochen, aber auch um das 10-fache nachgiebiger als die Sehne ist (Abb. 6). Dabei konnte die deutlich höhere Compliance der Interfacefasern gegenüber dem benachbarten Sehnengewebe – neben der Faserauffächerung – als ein wichtiges Element identifiziert werden, um die entsprechende Lastverteilung und Energiedissipation zu ermöglichen und damit die biomechanische Robustheit dieses Biomaterials zusätzlich zu steigern. Um das mikromechanische Verhalten der Enthese auch unter dem Aspekt unterschiedlicher Krafteinleitungsrichtungen exakt erfassen zu können, wurde der experimentelle Messaufbau unter dem konfokalen Mikroskop so ausgelegt, dass die Sehne aus verschiedenen Winkeln gegenüber der knöchernen Insertion positioniert werden konnte (Abb. 6 a und b). Dabei zeigte sich ein entsprechender Lastverteilungsmechanismus, bei dem verschiedene Fasergruppen zur Lastübertragung rekrutiert werden je nach Winkel der Lastapplikation. Die molekularen Mechanismen sind derzeit noch unklar, aber es ist wahrscheinlich, dass die Kopplung zwischen den Fasern auf der Mikroskala in Kombination mit verschiedenen bekannten Quervernetzungen auf der Nanoskala eine wichtige Rolle spielen [10, 11].

Molekularbiologische Zusammensetzung
Weitergehende Untersuchungen mit Analyse des Proteoms und Transkriptoms dieser Interfaceregion mittels Liquid Chromatography Tandem Mass Spectroscopy respektive Next Generation Sequencing zeigten schließlich, dass diese Region auch erhebliche Unterschiede der Proteine und Biomarker gegenüber dem Sehnengewebe aufweist und damit deutlich macht, wie hochspezialisiert und adaptiert diese vergleichsweise dünne 500 µm Zone ist [1, 6]. So konnten diese Untersuchungen mehr als 400 Interfaceproteine identifizieren, von denen 22 Eiweiße hochsignifikant angereichert in der Enthese gegenüber der Sehne sind. Dabei zeigten sich im Interface 4 bis 10-fach höhere Konzentrationen von großen Chondroitinsulfat-Proteoglykanen – sog. Hyalektane – wie Versican und Aggrecan, die vor allem in Geweben den starken Kompressionen ausgesetzt sind, wie Knorpel- und Bandscheibengewebe vorkommen [12]. Außerdem konnten wir gegenüber dem benachbarten Sehnengewebe deutlich erhöhte Konzentration von sog. small leucine-rich repeat proteoglycans (SLRP) nachweisen, die insbesondere die Funktion haben, die Fibrillenbreite zu regulieren und die – über die ebenfalls nachgewiesenen FACIT Kollagene IX – an Kollagen Typ II Fasern anhaften und so Strukturen höherer Ordnung maßgeblich stabilisieren, was die molekulare Ursache für die dargestellte Faserauffächerung und –spreizung sein könnte. Außerdem beeinflussen die SLRP´s die Fasergleitfähigkeit und dadurch wichtige viskoelastische Gewebeeigenschaften [13]. Im Rahmen der durchgeführten Transkriptomanalyse [6] zeigte sich schließlich, dass das Interfacegewebe eine deutlich höhere Ähnlichkeit zu artikulärem Knorpel aufwies als zum benachbarten Sehnengewebe. Dies erklärt – neben den mikrostrukturellen und biomechanischen Besonderheiten des Enthesengewebes – dessen ausgeprägte Fähigkeit, den hohen Kompressions- und Scherkräften – wie sie durch die veränderlichen Krafteinleitungsrichtungen verursacht werden – standzuhalten. In diesem Zusammenhang konnten 10 Biomarker identifiziert werden, die statistisch signifikant und mindestens zweifach angereichert im Enthesengewebe vs. Sehne sowohl im Proteom als auch Transkriptom vorlagen. Für das Sehnengewebe konnten – im Gegenzug – 6 Biomarker identifiziert werden, die statistisch signifikant höher exprimiert waren als in der Enthese. Diese weltweit neuen Erkenntnisse können beispielsweise zukünftig sehr hilfreich sein bei der zielgenauen Evaluation bzw. Überprüfung von Tissue-Engineering Ansätzen des Sehnen-Knochenüberganges z. B. im Bereich der Rotatorenmanschette.
Fazit
Zusammenfassend lässt sich festhalten, dass die vorgestellten Untersuchungen wichtige neue Einblicke und ein deutlich tieferes Verständnis der Enthese als komplexer, evolutionär-hochoptimierter Hart-Weichübergang der Natur ermöglichen. Diese Erkenntnisse liefern neue wichtige Erklärungsansätze, warum Enthesen trotz extremer biomechanischer Belastungen mit oftmals dem Mehrfachen des Körpergewichtes derart widerstandsfähig und resilient sind. Auf Grund der hohen Ähnlichkeit dieses Interfacebereiches zum artikulären Knorpel sowohl bzgl. dem vorherrschenden Kollagen Typ II als auch vieler identischer Proteine bzw. Proteoglykanzusammensetzungen wird allerdings auch verständlich, warum das regenerative Potenzial dieser Übergangszone vergleichbar gering ist, wie beim Gelenkknorpel. Entsprechend ist es überlegenswert, bei der Refixation von Sehnen an den Knochen – wie z. B. bei Rotatorenmanschettenrupturen – die am Knochen verbleibenden Enthesenanteile, die derzeit oftmals operativ komplett entfernt werden, zu schonen, um dadurch bessere Regenerationsbedingungen zu schaffen und so potenziell Versagensraten zu minimieren. Hierfür sind aber weiterführende Studien notwendig. Zusammenfassend lässt sich festhalten, dass die vorgestellten Ergebnisse [1, 6] zukünftig eine essentielle Basis für innovative Ansätze darstellen können, die sowohl im Bereich biologisch-medizinischer Therapieverfahren als auch für biomimetisch-technische Designs für neuartige Hart-Weich-Komponenten hilfreich sein können.
Acknowledgements
Die Forschung wurde im Rahmen der DFG-Exzellenzinitiative durch die International Graduate School of Science and Engineering der TUM gefördert und war nur möglich durch die enge interdisziplinäre Kooperation innerhalb der TUM mit der Klinik für Orthopädie und Sportorthopädie, der Lehrstühle für Zelluläre Biophysik, Organische Chemie II, Biomedizinische Physik sowie des Lehrstuhls für Computational Mechanics [s. 1].
Literatur
[1] Rossetti L, Kuntz LA, Kunold E, Schock J, Müller KW, Grabmayr H, Stolberg-Stolberg J, Pfeiffer F, Sieber SA, Burgkart R*, Bausch AR*. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 2017 Jun;16(6):664-670 (*equally contributed)
[2] Genin, G. M. et al. Functional grading of mineral and collagen in the attachment of tendon to bone. Biophys. J. 97, 976-985 (2009).
[3] Thomopoulos, S., Birman, V. & Genin, G. in Structural Interfaces and Attachments in Biology (Hrsg. Thomopoulos, S., Birman, V. & Genin, G.) 3-17 (Springer, 2013).
[4] Plaaß C, Weisskopf L (Hrsg.). Die Sehne – Leitfaden zur Behandlung von Sehnenpathologien. De Gruyter, Berlin 2017
[5] Apostolakos J, Durant TJ, Dwyer CR, Russell RP, Weinreb JH, Alaee F, Beitzel K, McCarthy MB, Cote MP, Mazzocca AD. The enthesis: a review of the tendon-to-bone insertion. Muscles Ligaments Tendons J. 2014 Nov 17;4(3):333-42.
[6] Kuntz LA, Rossetti L, Kunold E, Schmitt A, von Eisenhart-Rothe R, Bausch AR, Burgkart RH. Biomarkers for tissue engineering of the tendon-bone interface. PLoS One. 2018 Jan 3;13(1)
[7] Kuntz LA. The enthesis: nature´s solution to a hard-soft interface. Dissertationsschrift, Lehrstuhl für Orthopädie und Sportorthopädie (Prof. Dr. R. Burgkart), Klinikum rechts der Isar, Technische Universität München 2017
[8] Hu, Y. et al. Stochastic interdigitation as a toughening mechanism at the interface between tendon and bone. Biophys. J. 108, 431437 (2015).
[9] Rosetti L. The micromechanical and microstructural characterisation of the structurale interface at tendon-bone attachment. Dissertationsschrift, Lehrstuhl für Zellbiophysik (Prof. A. Bausch), Technische Universität München 2017
[10] Buehler, M. J. & Yung, Y. C. Deformation and failure of protein materials in physiologically extreme conditions and disease. Nat. Mater. 8, 175-188 (2009).
[11] Zhang, L. et al. A coupled fiber-matrix model demonstrates highly inhomogeneous microstructural interactions in soft tissues under tensile load. J. Biomech. Eng 135, 011008 (2013)
[12] Yoon, J. H. & Halper, J. Tendon proteoglycans: biochemistry and function. J. Musculoskelet. Neuronal. Interact. 5, 22-34 (2005).
[13] Thorpe, C. T., Birch, H. L., Clegg, P. D. & Screen, H. R. The role of the non-collagenous matrix in tendon function. Int. J. Exp. Pathol. 94, 248-259 (2013).
Autoren
ist Facharzt für Orthopädie mit Zusatzbezeichnung Sportmedizin. Er ist Oberarzt und Sektionsleiter der orthopädischen Forschung und Lehre der Klinik für Orthopädie und Sportorthopädie am Klinikum rechts der Isar der TU München.