Altersbedingte und pathologische Verfettung der tiefen Rückenmuskulatur: Die tiefe autochthone Rückenmuskulatur ist im Vergleich zum Großteil der Skelettmuskulatur deutlich häufiger und ausgeprägter von altersbedingten Abbauprozessen betroffen [1]. Dabei kommt es nicht immer zu einer Reduzierung des Muskelquerschnittes, sondern vielmehr zu einer Verschlechterung der Muskelqualität durch Einlagerungen von fettreichem Bindegewebe [2].
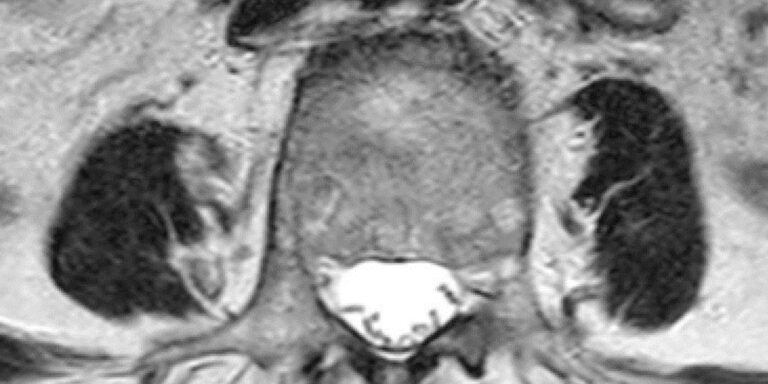
Neben diesem altersbedingten Abbau (Sarkopenie) kommt es auch im Rahmen von Inaktivität sowie durch Nervenkompression (z. B. Bandscheibenvorfall) oder andere schmerzhafte Erkrankungen im Wirbelsäulenbereich zu einer Verschlechterung des morphologischen und funktionellen Zustandes [3 – 5], welcher meist direkt mit den klinischen Symptomen korreliert [6 – 9]. Der m. multifidus ist bei Patienten mit chronischen Beschwerden von diesen Abbauprozessen deutlich häufiger betroffen als der m. erector spinae [10, 11]. Die Mechanismen können sehr unterschiedlich sein und sind abhängig von der zugrunde liegenden Pathologie. So kann durch Inaktivität beidseitig der gesamte Muskel betroffen sein, während bei Nervenkompressionen (z. B. Prolaps) eher einzelne Faszikel und diese meist einseitig verfetten (Abb. 1) [12]. Dies entsteht dadurch, dass sich die Anteile des m. multifidus über mehrere Segmente strecken; die tiefen Anteile über zwei Segmente, die oberflächlichen Anteile über fünf. Eine Schädigung bzw. Kompression des Nervs kann sich folglich auf die Muskulatur fünf Segmente unterhalb der Schädigung auswirken. In jedem der betroffenen Segmente wäre dann folglich die Verfettungsmuster unterschiedlich ausgeprägt [12]. Eine Verbesserung dieses tiefenmuskulären Zustandes ist daher nicht nur ein wichtiger Bestandteil von nachhaltigen Rückentherapien, sondern auch, um im Alter eine hohe Wirbelsäulenstabilität und somit Lebensqualität zu gewährleisten. Bildgebende Verfahren zur Bewertung des qualitativen Zustandes dieser Muskulatur und zur Messung von Veränderungen während Therapieprozessen werden daher im Bereich der Orthopädie zunehmend wichtiger.
Magnetresonanztomografie (MRT)
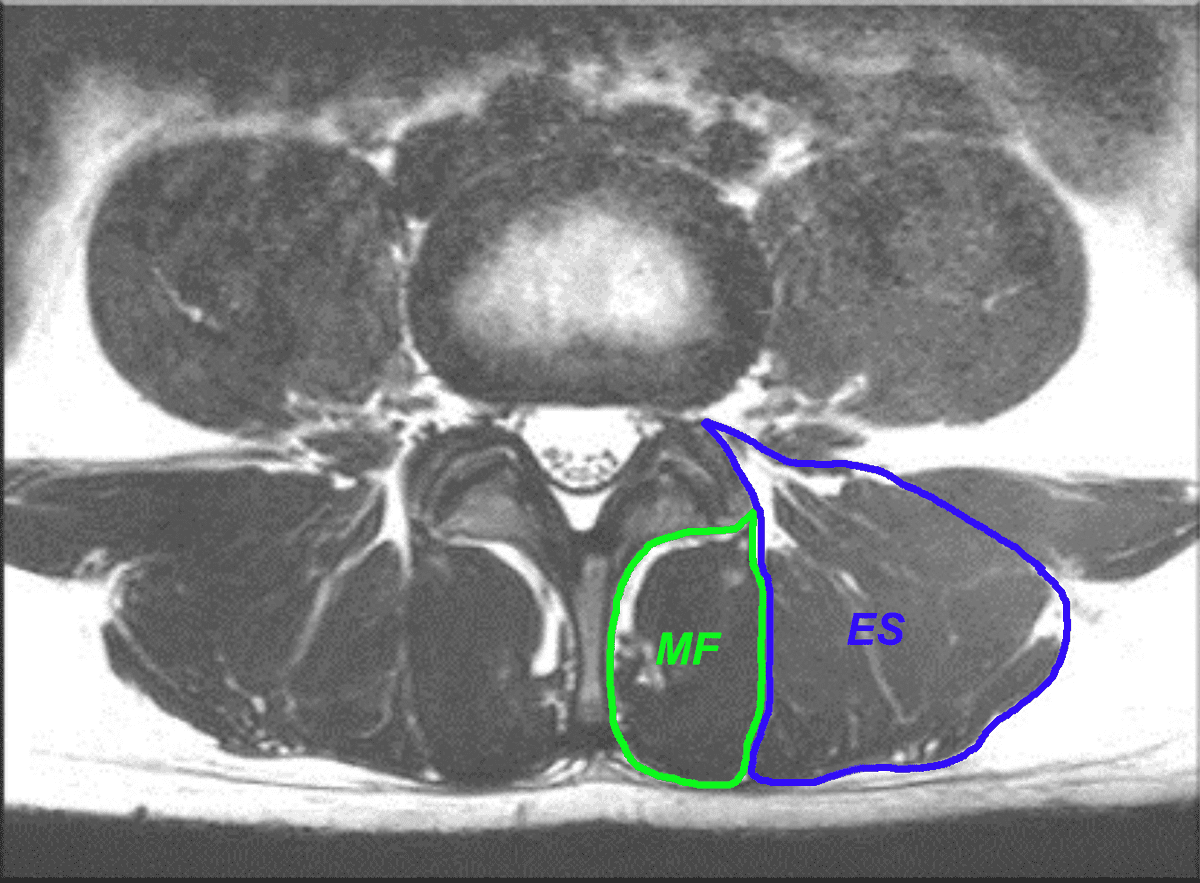
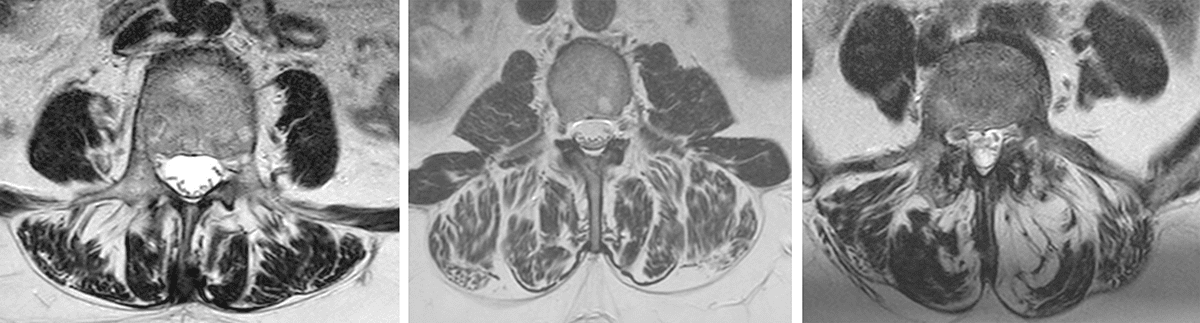
Das MRT ist bei der Bewertung der Muskelqualität nach wie vor der Goldstandard. Zahlreiche Studien haben mittels MRT das Verständnis über die beschriebenen Abbauprozesse vorangetrieben, auch wenn die exakten Mechanismen noch nicht vollständig erforscht sind. Für die Bewertung des Zustandes ist es wichtig, den m.multifidus (MF) von m. erector spinae (ES) zu unterscheiden (Abb. 1). Letzterer setzt sich laut neuerer Studien aus den Anteilen des m. longissimus und m. iliocostalis zusammen, auch wenn dies in älteren Studien häufig anders definiert wurde. Um die Bewertungen des muskulären Zustandes zu vereinheitlichen, wurden in einer 2021 durchgeführten Delphi Studie der „International society for the study of the spine“ (ISSLS) Standards erarbeitet und festgeleitet [12]. Diese beziehen sich in erster Linie auf die Durchführung von Studien, sind aber auch für praktizierende Ärzte hilfreich. Auf der physiologischen bzw. pathophysiologischen Ebene wird empfohlen, idealerweise immer mehrere Segmente zu analysieren (L1 – L5), um eine Aussage zu treffen. Ist die Pathologie bereits bekannt und segmentspezifisch, kann in Einzelfällen auch ein Segment reichen. Als Minimum sollte am besten das von der Pathologie betroffene Segment und das darunter analysiert werden. Wenn Veränderungen im zeitlichen Verlauf betrachtet werden, sollte in jedem Fall zwischen akuten und chronischen Patienten unterschieden werden, da der Zeitpunkt des Schmerzes nicht zwangsläufig den Zeitpunkt der morphologischen Veränderung widerspiegelt. Es gilt auch zu beachten, dass Veränderungen sowohl einzelne Faszikel und nicht zwingend den ganzen Muskel betreffen (Abb. 2).
Faktoren, die ebenfalls einen Einfluss auf die Menge an intramuskulär eingelagertem Fett haben, sind Alter, Geschlecht, BMI, Aktivitätslevel und die Pathologie (wenn bekannt). Ältere Menschen, Frauen und inaktive Menschen haben tendenziell einen höheren intramuskulären Fettgehalt. Diese Faktoren gilt es im Studiendesign als auch bei der Bewertung zu berücksichtigen. Eine Kontrollgruppe ist daher sehr wichtig. Bei der Quantifizierung der MRT Bilder wird zwischen Fett- und Muskelgewebe differenziert und das Verhältnis von reinem Muskelgewebe (ohne Fettanteil) im Verhältnis zum kompletten Querschnitt (Muskel + Fett) berechnet. Neben einer software-gestützten Quantifizierung dieser beiden Muskelanteile kann man auch semi-quantitativ den Fettgehalt bestimmen. Gemäß dem Goutallier-Klassifizierungssystem kann man den Verfettungsgrad in vier Stufen einteilen: Grad 0: normaler Muskel, kein Fett; Grad 1: Fett-Schlieren innerhalb des Muskels vorhanden; Grad 2: Fettfläche geringer als Muskelfläche; Grad 3: Fett- und Muskelfläche gleich groß; Grad 4: mehr Fett als Muskel [13]. Andere Einteilungen sind: Normal (0 – 10 % intramuskuläres Fett); leicht/moderat (10 – 50 % Fett) [12]. Vorteil dieser Klassifizierungen ist die einfache Durchführbarkeit. Eine softwareunterstützte Quantifizierung ist dagegen deutlich präziser. Letztere benötigt jedoch mehr Zeit und Equipment. Darüber hinaus ist die Identifikation und Darstellung der Konturen einzelner Muskeln mit zunehmender Verfettung (v. a. bei älteren Patienten) deutlich erschwert.
Diese nicht allzu genauen Orientierungen und Vorgaben sind jedoch für die klinische Praxis nur von begrenzter Bedeutung. Bislang gibt es zu wenig Normdaten und kaum unterstützende Software, die diese Aspekte für die Anamnese leicht zugänglich macht. Die Datenlage des Zusammenhangs zwischen der Verfettung der tiefen Rückenmuskulatur und Rückenschmerzen sowie den Symptomen ist jedoch klar belegt. Daher ist dringend zu raten, als behandelnder Arzt die MRT-Befunde als Entscheidungshilfe für eine nachhaltige Rückentherapie mit heranzuziehen und dabei nicht nur auf die passiven Strukturen zu achten, sondern auch den Zustand der Muskulatur zu beschreiben.
Ultraschall (US)
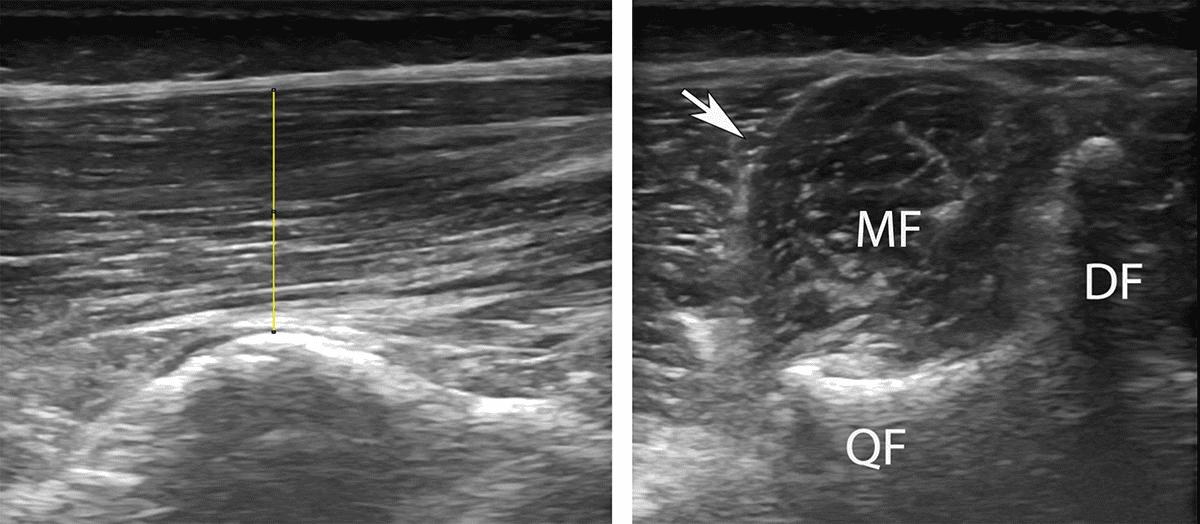
Ultraschall ist eine leicht zugängliche und kostengünstige Methode, mit der sowohl Muskelmorphologie als auch -funktion gemessen werden können. Im Vergleich zum MRT hat US eine schlechtere Auflösung und Bildqualität der Bilder sowie eine reduzierte Reliabilität [12]. Dieser Umstand erschwert gerade bei übergewichtigen und älteren Patienten die genaue Identifikation der Grenzen zwischen m. multifidus und m. erector spinae [14]. Trotzdem kann man durch standardisierte Bildgenerierungs- und Auswertungsprotokolle vielversprechende Messungen generieren. Um reliable Messungen vorzunehmen, sollte bei der Bildgenerierung die Position des Patienten (vorzugsweise Bauchlage inklusive Nivellierung der Lordose mittels Polsterung), die Neigung und der Anpressdruck des Schallkopfes (z. B. durch winkelgenaue Abnahme mithilfe eines digitalen Goniometers) sowie die Atmung (idealerweise im ausgeatmeten Zustand vorgenommen) standardisiert werden (Abb. 3). Um die Auswertung zu erleichtern, sollte schon bei der Bildgebung darauf geachtet werden, die Aufnahmen an deutlich sichtbaren, knöchernen Strukturen wie den Quer- und Dornfortsätzen sowie den Facettengelenken zu orientieren (Abb. 4). Mittels kostenlos zu Verfügung stehender Software kann anschließend eine computergestützte Auswertung erfolgen und dabei Aussagen zur Muskeldicke (engl.: „muscle thickness“) und Querschnittsfläche (engl.: „cross sectional area“) des m. multifidus getroffen werden. Falls die Konturen zwischen dem m. multifidus und dem erector spinae nicht eindeutig zu erkennen sind, kann in häufigen Fällen durch Neigung des Schallkopfes ein besseres Ergebnis erzielt werden. Wichtig dabei ist, bei wiederholter Messung (z. B. zur Verlaufskontrolle oder Evaluation im therapeutischen Setting) konsistent dieselbe Erhebungsmethode zu verwenden.

Literatur
[1] Fortin M, Videman T, Gibbons LE, Battié MC. Paraspinal muscle morphology and composition: a 15-yr longitudinal magnetic resonance imaging study. Med Sci Sports Exerc. 2014; 46(5):893-901.
[2] Dahlqvist JR, Vissing CR, Hedermann G, et al. Fat Replacement of Paraspinal Muscles with Aging in Healthy Adults. Med Sci Sports Exerc. 2017; 49(3):595-601.
[3] Hodges PW, Danneels L. Changes in Structure and Function of the Back Muscles in Low Back Pain: Different Time Points, Observations, and Mechanisms. J Orthop Sports Phys Ther. 2019;49(6):464-476.
[4] Matheve T, Hodges P, Danneels L. The Role of Back Muscle Dysfunctions in Chronic Low Back Pain: State-of-the-Art and Clinical Implications. J Clin Med. 2023 Aug 24;12(17):5510.
[5] Steele J, Bruce-Low S, Smith D. A reappraisal of the deconditioning hypothesis in low back pain: review of evidence from a triumvirate of research methods on specific lumbar extensor deconditioning. Curr Med Res Opin. 2014; 30(5):865-911.
[6] Kalichman L, Klindukhov A, Li L, Linov L. Indices of Paraspinal Muscles Degeneration: Reliability and Association With Facet Joint Osteoarthritis: Feasibility Study. Clin Spine Surg. 2016; 29(9):465-470.
[7] Fortin M, Lazáry À, Varga PP, McCall I, Battié MC. Paraspinal muscle asymmetry and fat infiltration in patients with symptomatic disc herniation. Eur Spine J. 2016; 25(5):1452-1459.
[8] Faur C, Patrascu JM, Haragus H, Anglitoiu B. Correlation between multifidus fatty atrophy and lumbar disc degeneration in low back pain. BMC Musculoskelet Disord. 2019; 20(1):414
[9] Steele J, Fisher J, Perrin C, Conway R, Bruce-Low S, Smith D. Does change in isolated lumbar extensor muscle function correlate with good clinical outcome? A secondary analysis of data on change in isolated lumbar extension strength, pain, and disability in chronic low back pain. Disabil Rehabil. 2019 Jun;41(11):1287-1295.
[10] Goubert D, Oosterwijck JV, Meeus M, Danneels L. Structural Changes of Lumbar Muscles in Non-specific Low Back Pain: A Systematic Review. Pain Physician. 2016; 19(7):E985-E1000.
[11] Ranger TA, Cicuttini FM, Jensen TS, Peiris WL, Hussain SM, Fairley J, Urquhart DM. Are the size and composition of the paraspinal muscles associated with low back pain? A systematic review. Spine J. 2017; 17(11):1729-1748.
[12] Hodges PW, Bailey JF, Fortin M, Battié MC. Paraspinal muscle imaging measurements for common spinal disorders: review and consensus-based recommendations from the ISSLS degenerative spinal phenotypes group. Eur Spine J. 2021 Dec;30(12):3428-3441.
[13] Battaglia PJ, Maeda Y, Welk A, Hough B, Kettner N. Reliability of the Goutallier classification in quantifying muscle fatty degeneration in the lumbar multifidus using magnetic resonance imaging. J Manipulative Physiol Ther. 2014 Mar-Apr;37(3):190-7.
[14] Cuellar WA, Blizzard L, Callisaya ML, Hides JA, Jones G, Ding C, Winzenberg TM. Test-retest reliability of measurements of abdominal and multifidus muscles using ultrasound imaging in adults aged 50-79 years. Musculoskelet Sci Pract. 2017 Apr;28:79-84.
Autoren
ist Facharzt für Orthopädie mit Zusatzbezeichnungen Sportmedizin und Chirotherapie. Er ist Inhaber und leitender Arzt im Privatem Wirbelsäulenzentrum Dr. Alfen Würzburg. Außerdem ist er Präsident der Gesellschaft für Medizinische Kräftigungstherapie (GMKT-D) und betreut internationale Athleten im Bereich Fechten, Handball und Triathlon.
(Ph.D) ist Neurobiologe (Univ. Dipl.) sowie Sportwissenschaftler (Univ. Dipl.). Er ist Wissenschaftler im Bereich chronische Schmerzen und Gewebsveränderungen und leitender Trainingstherapeut im Privatem Wirbelsäulenzentrum Dr. Alfen Würzburg. Außerdem ist Dr. Spang Geschäftsführer der Gesellschaft für Medizinische Kräftigungstherapie (GMKT-D).
ist Sportwissenschaftler (B.A., M.Ed.) und arbeitet als Therapeut und wissenschaftliche Projektleitung in der Orthopädischen Privatpraxis Dr. Alfen, Würzburg. Er ist Wissenschaftler und Experte für tiefenmuskuläre Diagnostik am Institut für Sportwissenschaft, Universität Würzburg.