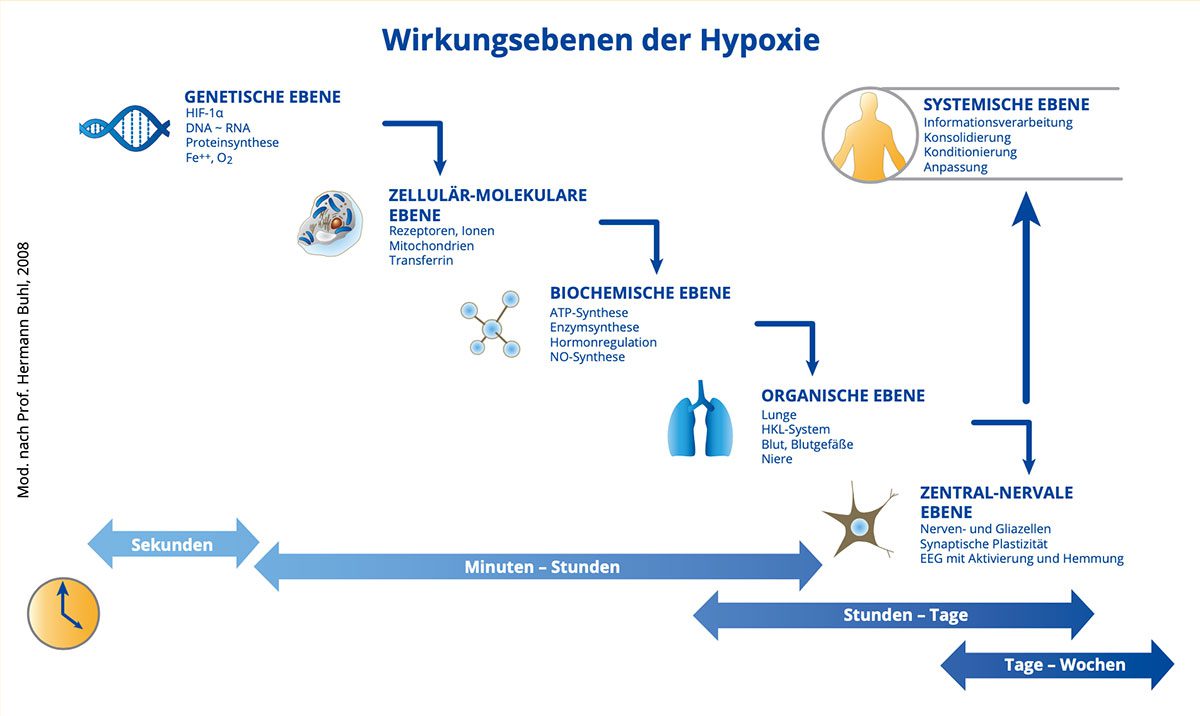
Intermittierendes Hypoxie Training (IHT) bietet eine Vielzahl von kurzfristigen physiologischen Anpassungen, die wir uns in der Sportmedizin zu Nutzen machen können. Ziel dabei ist die unspezifische Erhöhung der körperlichen Widerstandsfähigkeit durch Optimierung der mitochondrialen Atmung.
Die positiven Auswirkungen auf den menschlichen Organismus führten dazu, dass so genannte Höhentrainingslager (beginnend ab 1300 ü.NN) für Athleten zu einem festen Bestandteil ihres jährlichen Trainings wurden [1]. Vor allem normobare intermittierende Hypoxie-Trainingsprogramme (IHT) haben sich als besonders effizient erwiesen. Diese Systeme haben sich als gut verträgliche, kostengünstige und effektive Alternativen zu aufwendigen Aufenthalten in den Bergen gezeigt [2 – 4].
Es wird unterschieden zwischen der intermittierenden Hypoxie in Episoden, IHT mit Generatoren in Minuten-Intervallen und der dauerhaften Hypoxie [5]. Heute wissen wir, dass eine therapeutisch eingesetzte intermittierende Hypoxie zu einer Vielfalt von positiven, gesundheitsfördernden, physiologischen Anpassungen führen kann [6]. Diese Reaktion kann sogar noch erhöht werden, wenn die normoxische durch eine hyperoxische Erholungsphase ersetzt wird [7 – 9]. Auf Grundlage dieser Erkenntnisse wurde eine neue Form der Hypoxieexposition (Intermittierendes Hypoxie-Hyperoxie-Training, IHHT) entwickelt. Dabei hat sich gerade der Wechsel dieser unterschiedlichen Sauerstoffgehalte besonders effektiv erwiesen in der Stimulation der mitochondrialen Biogenese und Mitophagie [6,10]. Die oxidative Schädigung mitochondrialer DNA (mtDNA), die zu der sogenannten mitochondrialen Dysfunktion führt, ist eine der Hauptfaktoren menschlichen Alterns und der Entstehung chronischer Erkrankungen [11]. Dem entgegen wirkt eine kontinuierliche Erneuerung der Mitochondrien. Auf diese Art wirkt IHT oxidativem Stress entgegen, erhöht die Effizienz des oxidativen Stoffwechsels, verlangsamt den Alterungsprozess und verhindert/verzögert die Entwicklung altersbedingter Krankheiten [12].
Molekulare Mechanismen
Das IHT induziert auf zellulärer Ebene eine Regeneration der Mitochondrien. Eine kontrollierte Hypoxie führt zu einer positiven Veränderung der Atmungskette, ohne dabei eine negative Energiebilanz zu erzeugen [13,14]. Vielmehr kommt es zu einer Steigerung freier Sauerstoffradikale im positiven Sinne der Mitohormesis [15]. Ein zentraler Faktor stellt dabei der Hypoxie-induzierbare Faktor (HIF-1α) dar, der unter hypoxischen Bedingungen innerhalb kürzester Zeit aktiviert wird [16,17]. HIF-1α löst zahlreiche Reaktionen aus, die darauf abzielen, die Nutzung von Sauerstoff durch den Körper zu verbessern und wird in nahezu jedem Gewebe exprimiert. Es handelt sich bei HIF-1α um einen Transkriptionsfaktor, der eine Vielfalt positiver Kaskaden anstößt, die gesundheitsfördernde Prozesse im Körper induzieren wie bspw. eine Optimierung der Kapillarisierung und Tonusregulation der Sauerstoffverbrauchenden Gewebe, Erythrozytenbildung und des Glukosetransports und -stoffwechsels sowie Hochregulation von Neurotransmittern und der antioxidativen Kapazität [6] (Abb. 1). Es erfolgt eine zelluläre Gesundung und Verjüngung, indem schadhafte Mitochondrien in den programmierten Zelltod getrieben werden, während gesunde Mitochondrien sich weiterhin replizieren können [18 – 21].
Regeneration und IHT
Besonderen Fokus im Bereich der Sportmedizin sollte auf die Regeneration und die Unterstützung der Regenerationsfähigkeit eines Sportlers gelegt werden. Hohe körperliche Belastungen führen zu einer lokalen Erhöhung von Laktat sowie einer generellen Ausschüttung von Sauerstoffradikalen [22,23]. Die Erhöhung der antioxidativen Kapazität der Mitochondrien kann daher zu einer erhöhten körperlichen Leistungsfähigkeit führen [24]. Darüber hinaus stimuliert IHT die Kapillarerweiterung schneller in Geweben und Organen, in denen ein viel niedrigerer pH-Wert und eine erhöhte Konzentration von Milchsäure (Laktat) im Vergleich zu nicht übersäuerten, gesunden Geweben herrscht [6]. Insgesamt konnte gezeigt werden, dass Athleten unter Nutzen von Hypoxietraining besser regenerieren, sich die sportliche Leistung als Folge des Trainings effektiver besser steigern ließ und sich ein geringeres Stresslevel ausbildete [25]. Durch die mitochondriale Therapie wird vermehrt die zelluläre Energiegewinnung von Zuckerverbrennung auf Fettverbrennung umgestellt [26]. Damit hat der Körper die Möglichkeit, durch Optimierung der oxidativen Phosphorylierung eine deutlich höhere Energie zur Bewältigung einer Stress-Anpassungsreaktion zu generieren [27].
Zudem hat das Hypoxietraining einen signifikanten Einfluss auf das Autonome Nervensystem (ANS). Während des IHT hat sich daher als sinnvoller Biofeedback-Parameter die Messung der Herzratenvariabilität (HRV) erwiesen [28 – 30]. Die HRV ist die Variation der Schlag-zu-Schlag-Intervalle (RR-Zacken) und wird üblicherweise zur Bewertung der autonomen Modulation des Herzens, insbesondere der Interaktion zwischen Sympathikus und Parasympathikus, verwendet [31]. Das Autonome Nervensystem reguliert nicht-willkürliche Reaktionen des Körpers, allen voran die glatte Muskulatur der Organe und damit deren Aktivität. Das Ziel eines Trainings besteht darin, physiologische Anpassungen zu initiieren, welche die körperliche Leistungsfähigkeit verbessern. Die parasympathische Reaktivierung des Herzens nach einer Trainingseinheit ist dabei individuell unterschiedlich und scheint direkt mit der akuten und mittelfristigen Erholung (Superkompensation) zu korrelieren [32]. Während sich der Körper einem hypoxischen Reiz ausgesetzt sieht, kommt es zunächst zu einer Beschleunigung der Herzfrequenz [33,34]. In Folge der verringerten Sauerstoffsättigung und der Aktivierung der peripheren Chemorezeptoren kommt es zu einer Aktivierung des Sympathikus, was ebenfalls zu einem Anstieg der Pulsfrequenz und einer peripheren Vasokonstriktion führt [35,36]. Darüber hinaus kommt es durch eine reflektorische Parasympathikus-Aktivität zu einer subjektiven Entspannung, was man sich vor allem bei stressinduzierten Störungen zu Nutzen machen kann [5,37]. Diese nachhaltige Verbesserung der vagalen Anpassungsfähigkeit kann als eine Art induziertes Vagustraining angesehen werden. Je höher das Fitnessniveau ist, desto schneller tritt die parasympathische Reaktivierung nach dem Trainingsreiz ein und desto kürzer ist die für die Erholung benötigte Gesamtzeit [38,39]. Wiederholt konnte in der Vergangenheit in HRV-Analysen von Ausdauersportlern als Folge eines aeroben Trainingsprogramms eine Zunahme der parasympathischen Aktivität nachgewiesen werden [40]. Aktuelle Forschungsergebnisse deuten darauf hin, dass eine erhöhte sportliche Leistungsfähigkeit direkt mit einer erhöhten parasympathischen und sympathischen Modulationsfähigkeit einhergeht [41].
Nicht nur eine optimierte Regenerationsfähigkeit, sondern auch eine erhöhte Toleranz gegenüber externen psycho-emotionalen Stressoren wie z. B. bei internationalen Einsätzen spielen eine zentrale Rolle in der Leistungsfähigkeit des Athleten [42, 43]. Dabei versteht man unter einer adäquaten Stresstoleranz die Fähigkeiten des Organismus, auf negative-pathogene externe Stimuli regulierend zu reagieren [44]. Dabei sind Stressfaktoren zwar nicht vermeidbar, aber durch die Aktivierung des Parasympathikus kann der Stresseinfluss während der Wettkampfphasen schnell minimiert werden [45, 46]. Es konnte nachgewiesen werden, dass Interventionen, die sich direkt positiv auf die HRV-Messung auswirken, die Erholung der kardialen Regulationsfähigkeit verbessern und die notwendige Erholungszeit nach Trainings reduzieren [47,48]. Die Bedeutung von Schlaf als regenerativer Faktor für die Leistungsfähigkeit von Sportlern ist diverse Male ausführlich in der Wissenschaft diskutiert worden [49 – 51]. Späte Rückreisen sowie mögliche Wechsel von Zeitzonen führen zu einem deutlich beeinträchtigten Schlafmuster und reduzierter Regenerationsfähigkeit [52 – 54]. Gerade im Einsatz in stressigen Wettkampf-Phasen, hat sich IHT als sehr effektiv gezeigt. Spieler beschreiben nahezu sofort das Einsetzen von Schläfrigkeit, ein Ausbreiten innerer Ruhe und verbesserte Schlafqualität.
Intermittierendes-Hyperoxie Training sowie klinische Anwendung
Der Proband liegt meist während der Behandlung und trägt eine Atemmaske, über die abwechselnd sauerstoffreduzierte Atemluft (18 % – 9 % O2) und je nach Einstellung bei IHT normoxisches oder bei IHHT hyperoxisches (ca. 30 % O2) Luftgemisch eingeatmet wird. Dabei wird ein Brustgurt zur HRV-Messung und zwei Pulsoxymeter zur Messung der peripheren Sauerstoffsättigung getragen. Um ein ausreichend großen physiologischen Stressreiz zu setzen, wird ein SpO2-Wert von weniger als 90 % angestrebt. Eine positive physiologische Reaktion zeigt sich bereits nach Ablauf von 15 – 30 Minuten. Probanden beschreiben das Einsetzen eines Zustands allgemeiner Ruhe, oft begleitet von Entspannung, Schläfrigkeit, Verlangsamung der Atmung und der Herzfrequenz. Bereits nach ein oder zwei Sitzungen verbessern sich Schlaf und Stimmung [6]. IHHT bei Sportlern mit Übertrainingssyndrom konnte bereits nach wenigen Einheiten ein verringertes Stressniveau, d.h. verringerten Sympathikotonus und stärkerer parasympathischer Antrieb, nachgewiesen werden [9].
Fazit
Bedeutung für den Sportler: Selbst durch kurze hypoxische Trainings kann eine positive Beeinflussung des Athleten durch Erhöhung der Belastungstoleranz erreicht werden [55 – 57]. Darüber hinaus führt es zu einer Regulation des Gefäßtonus und der Gewebsazidtität (pH) sowie der zellulären glykolytischen Kapazität [58]. Der Einfluss auf die zelluläre und nervale Regenerationsfähigkeit (ANS) ist für den Sportler in Hinblick auf die Leistungsfähigkeit von enormer Bedeutung. Durch die IHT kann nicht nur die parasympathische Aktivität und die Selbstregulation des ANS positiv unterstützt werden, sondern auch aktiv als Unterstützung im Rahmen der Regeneration und circadianen Rhythmik eingesetzt werden.
Literatur
- Gutenbrunner, C.; Glaesener, J.-J. Rehabilitation, Physikalische Medizin Und Naturheilverfahren; Springer, 2007;
- Bailey, D.M.; Davies, B.; Young, I.S. Intermittent Hypoxic Training: Implications for Lipid Peroxidation Induced by Acute Normoxic Exercise in Active Men. Clin Sci (Lond) 2001, 101, 465–475.
- Burtscher, M.; Pachinger, O.; Ehrenbourg, I.; Mitterbauer, G.; Faulhaber, M.; Pühringer, R.; Tkatchouk, E. Intermittent Hypoxia Increases Exercise Tolerance in Elderly Men with and without Coronary Artery Disease. Int J Cardiol 2004, 96, 247–254, doi:10.1016/j.ijcard.2003.07.021.
- Wiesner, S.; Haufe, S.; Engeli, S.; Mutschler, H.; Haas, U.; Luft, F.C.; Jordan, J. Influences of Normobaric Hypoxia Training on Physical Fitness and Metabolic Risk Markers in Overweight to Obese Subjects. Obesity (Silver Spring) 2010, 18, 116–120, doi:10.1038/oby.2009.193.
- Viscor, G.; Torrella, J.R.; Corral, L.; Ricart, A.; Javierre, C.; Pages, T.; Ventura, J.L. Physiological and Biological Responses to Short-Term Intermittent Hypobaric Hypoxia Exposure: From Sports and Mountain Medicine to New Biomedical Applications. Frontiers in Physiology 2018, 9.
- Voronina, T.; Grechko, N.; Shikhlyarova, A.; Bobkova, N. Intermittent Hypoxic Training as an Effective Method of Activation Therapy. Cardiometry 2017.
- Faiss, R.; Girard, O.; Millet, G.P. Advancing Hypoxic Training in Team Sports: From Intermittent Hypoxic Training to Repeated Sprint Training in Hypoxia. British journal of sports medicine 2013, 47, i45–i50.
- Sanchez, A.M.J.; Borrani, F. Effects of Intermittent Hypoxic Training Performed at High Hypoxia Level on Exercise Performance in Highly Trained Runners. Journal of Sports Sciences 2018, 36, 2045–2052, doi:10.1080/02640414.2018.1434747.
- Susta, D.; Dudnik, E.; Glazachev, O.S. A Programme Based on Repeated Hypoxia-Hyperoxia Exposure and Light Exercise Enhances Performance in Athletes with Overtraining Syndrome: A Pilot Study. Clin Physiol Funct Imaging 2017, 37, 276–281, doi:10.1111/cpf.12296.
- Lukyanova, L.D.; Dudchenko, A.V.; Germanova, E.L.; Tsybina, T.A.; Kapaladze, R.A.; Ehrenbourg, I.V.; Tkatchouk, E.N. Mitochondrial Signaling in Formation of Body Resistance to Hypoxia. In Intermittent hypoxia: from molecular mechanisms to clinical applications; 2011; pp. 391–417.
- Picard, M.; Turnbull, D.M. Linking the Metabolic State and Mitochondrial DNA in Chronic Disease, Health, and Aging. Diabetes 2013, 62, 672–678, doi:10.2337/db12-1203.
- Marshall, R.P.; Droste, J.-N.; Giessing, J.; Kreider, R.B. Role of Creatine Supplementation in Conditions Involving Mitochondrial Dysfunction: A Narrative Review. Nutrients 2022, 14, 529.
- Semenza, G.L. Regulation of Oxygen Homeostasis by Hypoxia-Inducible Factor 1. Physiology (Bethesda) 2009, 24, 97–106, doi:10.1152/physiol.00045.2008.
- Fukuda, R.; Zhang, H.; Kim, J.; Shimoda, L.; Dang, C.V.; Semenza, G.L. HIF-1 Regulates Cytochrome Oxidase Subunits to Optimize Efficiency of Respiration in Hypoxic Cells. Cell 2007, 129, 111–122, doi:10.1016/j.cell.2007.01.047.
- Ristow, M. Unraveling the Truth about Antioxidants: Mitohormesis Explains ROS-Induced Health Benefits. Nat Med 2014, 20, 709–711, doi:10.1038/nm.3624.
- Jiang, B.H.; Semenza, G.L.; Bauer, C.; Marti, H.H. Hypoxia-Inducible Factor 1 Levels Vary Exponentially over a Physiologically Relevant Range of O2 Tension. Am J Physiol 1996, 271, C1172-1180, doi:10.1152/ajpcell.1996.271.4.C1172.
- Wang, G.L.; Jiang, B.H.; Rue, E.A.; Semenza, G.L. Hypoxia-Inducible Factor 1 Is a Basic-Helix-Loop-Helix-PAS Heterodimer Regulated by Cellular O2 Tension. Proc Natl Acad Sci U S A 1995, 92, 5510–5514, doi:10.1073/pnas.92.12.5510.
- Semenza, G.L. Hypoxia-Inducible Factors: Coupling Glucose Metabolism and Redox Regulation with Induction of the Breast Cancer Stem Cell Phenotype. EMBO J 2017, 36, 252–259, doi:10.15252/embj.201695204.
- Wang, Y.; Pu, L.; Li, Z.; Hu, X.; Jiang, L. Hypoxia-Inducible Factor-1α Gene Expression and Apoptosis in Ischemia-Reperfusion Injury: A Rat Model of Early-Stage Pressure Ulcer. Nurs Res 2016, 65, 35–46, doi:10.1097/NNR.0000000000000132.
- Zhang, H.; Bosch-Marce, M.; Shimoda, L.A.; Tan, Y.S.; Baek, J.H.; Wesley, J.B.; Gonzalez, F.J.; Semenza, G.L. Mitochondrial Autophagy Is an HIF-1-Dependent Adaptive Metabolic Response to Hypoxia. J Biol Chem 2008, 283, 10892–10903, doi:10.1074/jbc.M800102200.
- Manukhina, E.B.; Downey, H.F.; Shi, X.; Mallet, R.T. Intermittent Hypoxia Training Protects Cerebrovascular Function in Alzheimer’s Disease. Experimental Biology and Medicine 2016, 241, 1351–1363.
- Petibois, C.; Paiva, M.; Cazorla, G.; Déléris, G. Discriminant Serum Biochemical Parameters in Top Class Marathon Performances. Jpn J Physiol 2002, 52, 181–190, doi:10.2170/jjphysiol.52.181.
- Mastaloudis, A.; Leonard, S.W.; Traber, M.G. Oxidative Stress in Athletes during Extreme Endurance Exercise. Free Radic Biol Med 2001, 31, 911–922, doi:10.1016/s0891-5849(01)00667-0.
- Finaud, J.; Lac, G.; Filaire, E. Oxidative Stress : Relationship with Exercise and Training. Sports Med 2006, 36, 327–358, doi:10.2165/00007256-200636040-00004.
- Jung, W.-S.; Kim, S.-W.; Park, H.-Y. Interval Hypoxic Training Enhances Athletic Performance and Does Not Adversely Affect Immune Function in Middle- and Long-Distance Runners. International Journal of Environmental Research and Public Health 2020, 17, 1934, doi:10.3390/ijerph17061934.
- Zhao, Y.-C.; Guo, W.; Gao, B.-H. Hypoxic Training Upregulates Mitochondrial Turnover and Angiogenesis of Skeletal Muscle in Mice. Life Sci 2022, 291, 119340, doi:10.1016/j.lfs.2021.119340.
- Tsai, H.-H.; Chang, S.-C.; Chou, C.-H.; Weng, T.-P.; Hsu, C.-C.; Wang, J.-S. Exercise Training Alleviates Hypoxia-Induced Mitochondrial Dysfunction in the Lymphocytes of Sedentary Males. Sci Rep 2016, 6, 35170, doi:10.1038/srep35170.
- Hainsworth, R.; Drinkhill, M.J.; Rivera-Chira, M. The Autonomic Nervous System at High Altitude. Clin Auton Res 2007, 17, 13–19, doi:10.1007/s10286-006-0395-7.
- Kanai, M.; Nishihara, F.; Shiga, T.; Shimada, H.; Saito, S. Alterations in Autonomic Nervous Control of Heart Rate among Tourists at 2700 and 3700m above Sea Level. Wilderness & Environmental Medicine 2001, 12, 8–12, doi:10.1580/1080-6032(2001)012[0008:AIANCO]2.0.CO;2.
- Farinelli, C.C.; Kayser, B.; Binzoni, T.; Cerretelli, P.; Girardier, L. Autonomic Nervous Control of Heart Rate at Altitude (5050 m). Eur J Appl Physiol Occup Physiol 1994, 69, 502–507, doi:10.1007/BF00239867.
- Taralov, Z.; Terziyski, K.; Dimov, P.; Marinov, B.; Tarvainen, M.P.; Perini, R.; Kostianev, S. Assessment of the Acute Impact of Normobaric Hypoxia as a Part of an Intermittent Hypoxic Training on Heart Rate Variability. Cor et Vasa 2015, 57, e251–e256, doi:10.1016/j.crvasa.2015.05.010.
- Stanley, J.; Peake, J.M.; Buchheit, M. Cardiac Parasympathetic Reactivation Following Exercise: Implications for Training Prescription. Sports Med 2013, 43, 1259–1277, doi:10.1007/s40279-013-0083-4.
- Paralikar, S.J.; Paralikar, J.H. High-Altitude Medicine. Indian Journal of Occupational and Environmental Medicine 2010, 14, 6, doi:10.4103/0019-5278.64608.
- Peacock, A.J. Oxygen at High Altitude. BMJ 1998, 317, 1063–1066, doi:10.1136/bmj.317.7165.1063.
- BERNARDI, L.; PASSINO, C.; SPADACINI, G.; CALCIATI, A.; ROBERGS, R.; GREENE, R.; MARTIGNONI, E.; ANAND, I.; APPENZELLER, O. Cardiovascular Autonomic Modulation and Activity of Carotid Baroreceptors at Altitude. Clinical Science 1998, 95, 565–573, doi:10.1042/cs0950565.
- Marshall, J.M. Chemoreceptors and Cardiovascular Control in Acute and Chronic Systemic Hypoxia. Braz J Med Biol Res 1998, 31, 863–888, doi:10.1590/S0100-879X1998000700002.
- Bobyleva, O.V.; Glazachev, O.S. Changes in Autonomic Response and Resistance to Acute Graded Hypoxia during Intermittent Hypoxic Training. Hum Physiol 2007, 33, 199–206, doi:10.1134/S0362119707020107.
- Cipryan, L. The Effect of Fitness Level on Cardiac Autonomic Regulation, IL-6, Total Antioxidant Capacity, and Muscle Damage Responses to a Single Bout of High-Intensity Interval Training. J Sport Health Sci 2018, 7, 363–371, doi:10.1016/j.jshs.2016.11.001.
- Dixon, E.M.; Kamath, M.V.; McCartney, N.; Fallen, E.L. Neural Regulation of Heart Rate Variability in Endurance Athletes and Sedentary Controls. Cardiovasc Res 1992, 26, 713–719, doi:10.1093/cvr/26.7.713.
- De Meersman, R.E. Heart Rate Variability and Aerobic Fitness. Am Heart J 1993, 125, 726–731, doi:10.1016/0002-8703(93)90164-5.
- Furlan, R.; Piazza, S.; Dell’Orto, S.; Gentile, E.; Cerutti, S.; Pagani, M.; Malliani, A. Early and Late Effects of Exercise and Athletic Training on Neural Mechanisms Controlling Heart Rate. Cardiovasc Res 1993, 27, 482–488, doi:10.1093/cvr/27.3.482.
- Filaire, E.; Sagnol, M.; Ferrand, C.; Maso, F.; Lac, G. Psychophysiological Stress in Judo Athletes during Competitions. J Sports Med Phys Fitness 2001, 41, 263–268.
- Kellmann, M. Preventing Overtraining in Athletes in High-Intensity Sports and Stress/Recovery Monitoring. Scand J Med Sci Sports 2010, 20 Suppl 2, 95–102, doi:10.1111/j.1600-0838.2010.01192.x.
- Korobeynikov, G.; Korobeynikova, L.; Potop, V.; Nikonorov, D.; Semenenko, V.; Dakal, N.; Mischuk, D. Heart Rate Variability System in Elite Athletes with Different Levels of Stress Resistance. Journal of Physical Education and Sport 2018, 18, 550–554.
- Barbas, I.; Fatouros, I.G.; Douroudos, I.I.; Chatzinikolaou, A.; Michailidis, Y.; Draganidis, D.; Jamurtas, A.Z.; Nikolaidis, M.G.; Parotsidis, C.; Theodorou, A.A.; et al. Physiological and Performance Adaptations of Elite Greco-Roman Wrestlers during a One-Day Tournament. Eur J Appl Physiol 2011, 111, 1421–1436, doi:10.1007/s00421-010-1761-7.
- Vladimir, P. Assessment of Physical and Technical Training Level in Basic Specialization Stage in Women’s Artistic Gymnastics. Journal of physical education and sport 2013, 13, 114.
- Peçanha, T.; Bartels, R.; Brito, L.C.; Paula-Ribeiro, M.; Oliveira, R.S.; Goldberger, J.J. Methods of Assessment of the Post-Exercise Cardiac Autonomic Recovery: A Methodological Review. Int J Cardiol 2017, 227, 795–802, doi:10.1016/j.ijcard.2016.10.057.
- Perez-Gaido, M.; Lalanza, J.F.; Parrado, E.; Capdevila, L. Can HRV Biofeedback Improve Short-Term Effort Recovery? Implications for Intermittent Load Sports. Appl Psychophysiol Biofeedback 2021, 46, 215–226, doi:10.1007/s10484-020-09495-8.
- Venter, R.E. Role of Sleep in Performance and Recovery of Athletes: A Review Article. South African Journal for Research in Sport, Physical Education and Recreation 2012, 34, 167–184.
- Walsh, N.P.; Halson, S.L.; Sargent, C.; Roach, G.D.; Nédélec, M.; Gupta, L.; Leeder, J.; Fullagar, H.H.; Coutts, A.J.; Edwards, B.J.; et al. Sleep and the Athlete: Narrative Review and 2021 Expert Consensus Recommendations. Br J Sports Med 2020, bjsports-2020-102025, doi:10.1136/bjsports-2020-102025.
- Nédélec, M.; Halson, S.; Abaidia, A.-E.; Ahmaidi, S.; Dupont, G. Stress, Sleep and Recovery in Elite Soccer: A Critical Review of the Literature. Sports Med 2015, 45, 1387–1400, doi:10.1007/s40279-015-0358-z.
- Fullagar, H.H.K.; Skorski, S.; Duffield, R.; Julian, R.; Bartlett, J.; Meyer, T. Impaired Sleep and Recovery after Night Matches in Elite Football Players. J Sports Sci 2016, 34, 1333–1339, doi:10.1080/02640414.2015.1135249.
- Swinbourne, R.; Gill, N.; Vaile, J.; Smart, D. Prevalence of Poor Sleep Quality, Sleepiness and Obstructive Sleep Apnoea Risk Factors in Athletes. Eur J Sport Sci 2016, 16, 850–858, doi:10.1080/17461391.2015.1120781.
- Carriço, S.; Skorski, S.; Duffield, R.; Mendes, B.; Calvete, F.; Meyer, T. Post-Match Sleeping Behavior Based on Match Scheduling over a Season in Elite Football Players. Science and Medicine in Football 2018, 2, 9–15.
- Semenza, G.L.; Shimoda, L.A.; Prabhakar, N.R. Regulation of Gene Expression by HIF-1. Novartis Found Symp 2006, 272, 2–8; discussion 8-14, 33–36.
- Vogt, M.; Puntschart, A.; Geiser, J.; Zuleger, C.; Billeter, R.; Hoppeler, H. Molecular Adaptations in Human Skeletal Muscle to Endurance Training under Simulated Hypoxic Conditions. J Appl Physiol (1985) 2001, 91, 173–182, doi:10.1152/jappl.2001.91.1.173.
- Brocherie, F.; Millet, G.P.; D’Hulst, G.; Van Thienen, R.; Deldicque, L.; Girard, O. Repeated Maximal-Intensity Hypoxic Exercise Superimposed to Hypoxic Residence Boosts Skeletal Muscle Transcriptional Responses in Elite Team-Sport Athletes. Acta Physiol (Oxf) 2018, 222, doi:10.1111/apha.12851.
- Girard, O.; Brocherie, F.; Goods, P.S.R.; Millet, G.P. An Updated Panorama of “Living Low-Training High” Altitude/Hypoxic Methods. Frontiers in Sports and Active Living 2020, 2.
Autoren
ist Facharzt für Physikalische und Rehabilitative Medizin und seit 2018 Mannschaftsarzt von RB Leipzig. Zuvor war er als Gründungsmitglied des Athleticums am Universitätskrankenhaus Hamburg-Eppendorf seit 2012 für die medizinische Betreuung des HSV, zunächst für das komplette NLZ, von 2014 – 2017 auch stellvertretend für die Bundesligamannschaft zuständig. Spezialgebiete: konservative Orthopädie, alternative Heilmethoden, Mikronährstofftherapie. Außerdem ist er wiss. Beirat der sportärztezeitung.
ist Fachärztin für Innere Medizin mit Schwerpunkt Präventions- und funktionelle Medizin, Regulationsmedizin und Performance Optimierung.
ist Mannschaftsarzt von RasenBallsport Leipzig und Mitarbeiter der Sportmedizin des BG Klinikum Hamburg. Vor seiner Tätigkeit im Fußball leitete er für fünf Jahre die medizinische Abteilung des Radsportteams BORA Hansgrohe und war Mitglied im medizinischen Team der NBA Europe Drafts.
Foto ©BORA-hansgrohe/VeloImages






