Dr. med. Rafael Heiß 3, Dr. med. Lukas Weisskopf 2,4, Prof. Dr. med. Martin Engelhardt 1
1 Osnabrücker Zentrum für Muskuloskelettale Chirurgie (OZMC), Klinikum Osnabrück
2 GOTS Komitee Muskel/Sehne, Gesellschaft für Orthopädisch-Traumatologische Sportmedizin (GOTS)
3 Radiologisches Institut, Universitätsklinikum Erlangen
4 Altius Swiss Sportmed Center, Rheinfelden
Die Delayed Onset Muscle Soreness (DOMS) oder auch „verzögert einsetzender Muskelkater“ wird zu den ultrastrukturellen Muskelverletzungen gezählt. Obwohl
die DOMS zu den milden Verletzungsformen zugeordnet wird und in der Regel
folgenlos ausheilt, ist sie mit erheblichen leistungseinschränkenden Auswirkungen verbunden. Grundlagen der Muskelbiomechanik sind essenziell, um diese Verletzungsentität in ihrer Pathogenese zu verstehen.
Aspekte zur Anatomie und Muskelbiomechanik
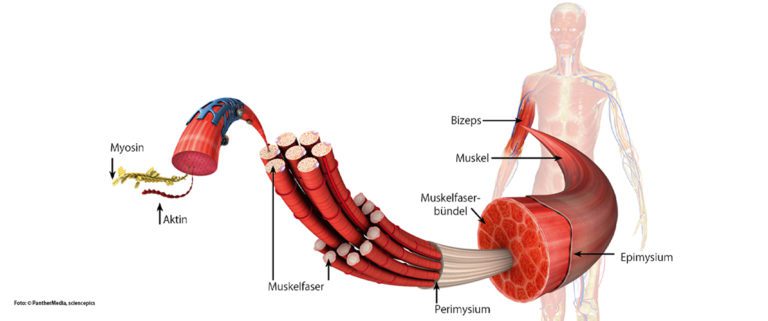
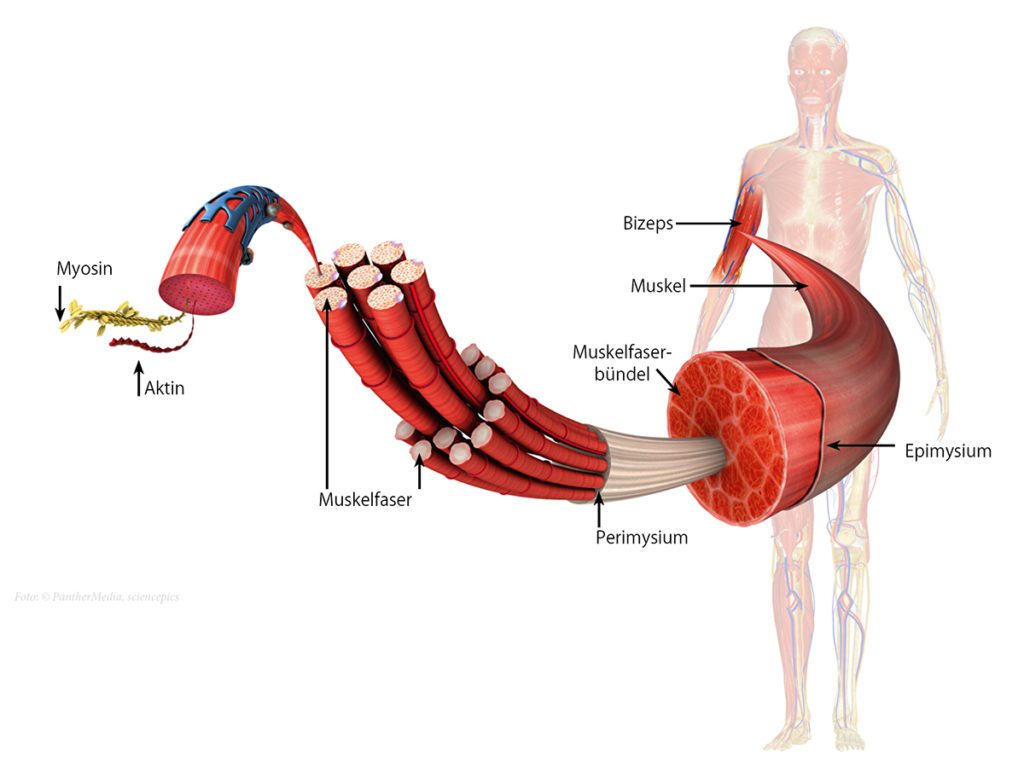
Die quergestreifte Skelettmuskulatur gilt im Verhältnis zum Gesamtkörpergewicht als das am stärksten ausgebildete Organ bzw. Gewebe des Menschen. Je nach Konstitutionstyp erreicht die Skelettmuskulatur einen Anteil zwischen 30 – 50 % des Gesamtkörpergewichts. Die Muskulatur nimmt einen wesentlichen Anteil an der äußeren Formgebung der menschlichen Gestalt ein, hat eine elementare Stütz- und Haltefunktion (z. B. Aufrechthaltung des Körpers beim Stehen oder Sitzen, Bildung von Kompartimenten und Körperhöhlen) und ermöglicht die elementare (Fort-) Bewegung und Kommunikation. Weiterhin wird die Muskulatur inzwischen in der Funktionsweise eines endokrinen Organs angesehen. Durch die Ausschüttung von sogenannten Myokinen (u. a. Pep-tidhormone) nimmt sie eine entscheidende Rolle in der Regulation und Differenzierung muskelferner Zielzellen ein [1]. Dadurch werden der Muskulatur neben den vielen weiteren Funktionen u. a. protektive, antientzündliche und letztlich allgemein gesundheitsfördernde Eigenschaften zugesprochen [1]. Um Verletzungen und Überlastungen der Muskulatur verstehen zu können, ist die Betrachtung der Anatomie und Physiologie notwendig: Der Muskel ist in seinem Aufbau hierarchisch organisiert. Kennzeichnend für Muskelfasern ist die Tatsache, dass diese im Vergleich zu anderen einige Zentimeter lang sein können und mehrere randständige Zellkerne enthalten. Diese Eigenschaften beruhen auf dem Zusammenschluss mehrerer Vorläuferzellen (Myoblasten) zu einer Muskelzelle[2]. Muskelfasern sind zu einem Faserbündel organisiert, dessen Zusammenschluss unter Einbezug von komplexen bindegewebigen Septen und Faszien zum Skelettmuskel führt [3].
Unter funktionellen Gesichtspunkten nimmt die Muskelfibrille einen wichtigen Stellenwert ein. Die Fibrille wird durch Z-Scheiben („Z-discs“) in Sarkomere eingeteilt, dessen Reihenschaltung eine kontraktile Einheit bildet. In den Sarkomeren finden sich die Filamente Myosin, Aktin, Titin und viele weitere regulatorische Eiweiße. Die Autorengruppe um die Gebrüder Huxley hat bereits in den 1950er Jahren die Hypothese der Gleitfilamenttheorie aufgestellt [4]. Mit elektronenmikroskopischen Aufnahmen konnten sie darlegen, dass sich die Länge der Filamente unter Verlängerung des Gesamtmuskels nicht ändert, stattdessen das Bündel der dünnen Filamente (Aktin) aus der Anordnung der dicken Filamente (Myosin) herausgezogen wird [4] (Huxley). Diese Erkenntnis ist bis heute als Meilenstein der Muskelbiomechanik anzusehen. Neben vielen weiteren Erkenntnissen (u. a. Querbrückenzyklus, 1957 [5]; Kraft-Längen-Kurve 1966 [6]) beobachtete Walter Herzog 2002 eine Kraftzunahme des Muskels unter dessen aktiver Verlängerung [7]. Neben Aktin und Titin scheint unter dieser exzentrischen Muskelarbeit das Strukturprotein Titin eine entscheidende Bedeutung zuzukommen [7 – 9]. Die daraus abgeleitete Dreifilamenttheorie postuliert eine aktive Bindung zwischen Titin und Aktin unter Ca2+ Einstrom während exzentrischer Muskelarbeit [7 – 10].
Folgende Merkmale konnten inzwischen der exzentrischen Arbeitsweise zugesprochen werden:
- Steigerung der Kraftentfaltung
- Strukturelle Mehrbelastung der aktivierten Fasern
- Energetisch günstig („Low cost and high force“)
- Beeinflussung der willkürlichen Innervation und des verändertes neuromuskulären Innervationsmusters
- Auftreten von akuten und überlastungsbedingten Verletzungen der Muskulatur
- Auftreten von (peri-)artikulären Verletzungen
- Effektive Trainingsform zur Behandlung der Osteoporose, Sarkopenie, Herz-Kreislauferkrankungen
- Effektive Trainingsform zur Behandlung von Tendinopathien sowie in der Therapie und Prävention von Muskelverletzungen

Entstehung von überlastungsbedingten Muskelverletzungen
Die Terminologie und Klassifikation überlastungsbedingter Muskelverletzungen ist bis dato nicht einheitlich definiert. Übergänge zwischen physiologischer, metabolischer und neuromuskulärer Ermüdung und der Entstehung von Verletzungen im eigentlichen Sinne mit einhergehender klinischer Symptomatik sind fließend. Die Delayed Onset Muscle Soreness (DOMS) oder auch „verzögert einsetzender Muskelkater“ wird nach der Münchner Klassifikation, die unter der Mitwirkung der Autorengruppe um Müller-Wohlfahrt publiziert wurde, als Muskelverletzung Typ 1b verstanden [11]. Ursächlich werden vorausgegangene exzentrische Kontraktionsformen oder ungewohnte Muskelbelastungen angesehen. Der muskelbiomechanische Zusammenhang zwischen ultrastrukturellen Verletzungen und exzentrischer Arbeitsweise wird unter o. g. Abschnitt „Aspekte zur Anatomie und Muskelbiomechanik“ deutlich. Selbst wenn der genaue ursächliche Mechanismus bis heute nicht exakt geklärt ist, wird eine mechanische, die ultrastrukturelle Belastungsfähigkeit übersteigende indirekte Lasteinwirkung als primärer Schädigungsmechanismus angenommen [12]. Eine inflammatorische Phase mit weiterer Proteindegradation, Autophagie und einer lokalen Entzündungsantwort ist die Folge. Klinisch imponieren nach einem initialen symptomarmen Intervall schmerzhafte Bewegungseinschränkungen und Schwellungen eine reduzierte Kraftentfaltung, eine Erhöhung des Muskeltonus sowie Funktionseinschränkungen angrenzender Gelenke. Initiale Symptome treten oftmals zwischen 6 – 12 Stunden nach Belastung erstmalig auf, steigern sich bis zu einem Gipfel nach 48 – 72 Stunden, bevor die Verletzung meist innerhalb einer Woche folgenlos ausheilt [12, 13].
Neben den genannten Symptomen kommt es laborchemisch zu einer Erhöhung von Schädigungs- und Entzündungsmarkern (u.a. Kreatinkinase (CK), Laktatdehydrogenase (LDH), Interleukin 6 (IL-6), Pentraxin-3 (PTX-3) oder C-reaktives Protein (CRP) [12]. Die DOMS ist in der Regel eine klinische Diagnose und selbstlimitierend. Folglich bleiben bildgebende Verfahren im klinischen Alltag zumeist unklaren Fällen vorbehalten. Kernspintomographisch stellt sich typischerweise in den flüssigkeitsgewichteten Sequenzen eine globale Signalsteigerung dar, die einem intramuskulärem Ödem entspricht, welches mit dem histopathologischen Schweregrad einer DOMS korreliert [14]. Neben den intramuskulären Ödemen können sich bei fortgeschrittenem Befund perfifasziale Flüssigkeitsansammlungen zeigen, die nicht als Zeichen einer strukturellen Verletzung fehlgedeutet werden dürfen [12]. Die Sonographie bietet im Vergleich zur Kernspintomographie nur eine eingeschränkte Sensitivität und liefert oftmals nur im intraindividuellen, zeitlichen Verlauf indirekte Hinweise [15]. Einen direkten Nachweis der Verletzungen auf Sarkomerebene bleibt bislang elektronenmikroskopischen Verfahren vorbehalten [16]; einhergehende funktionelle Veränderungen der Skelettmuskelperfusion konnten mittels kontrastmittelverstärkter Sonographie (CEUS) nachgewiesen werden [17]. Mitglieder der Autorengruppe haben es sich derzeit zur Aufgabe gemacht, mittels Hochfeld-7-Tesla-MRT o.g. Strukturveränderungen auf ultrastruktureller Ebene erstmalig bildgebend zu visualisieren – die Studienergebnisse gilt es abzuwarten.

Therapie und Prävention
Aus der Pathogenese dieser Verletzungsentität wird ersichtlich, dass aktuelle Überlegungen auf eine ursächliche primäre mechanische Belastung hinauslaufen. Die Prävention dieser folglich komplexen Verletzung zielt darauf ab, die Entstehung der primären Schädigung (Exercise Induce Muscle Damage, EIMD) zu verhindern oder bei bestehender Schädigung die inflammatorische Reaktion und damit die einsetzende klinische Manifestation zu limitieren [13]. Sofern eine manifeste DOMS vorliegt, gilt es Verfahren anzuwenden, um einhergehende Symptome zu lindern und eine schnellstmögliche Wiedererlangung der Muskelfunktion zu erzielen. Aufgrund der komplexen Pathophysiologie existieren auch hier fließende Übergänge zwischen Regeneration und Rehabilitation sowie Prävention und Therapie [18]. Bis heute sind in Praxis und Wissenschaft unzählige Verfahren und Interventionen angewandt worden. Gute Studienergebnisse sind insbesondere für physikalische Therapieverfahren* (z. B. Kältetherapie oder Kompressionstherapie) zu nennen [13, 18]. Der Vorteil einer systemischen Kältetherapie (Kaltwasserimmersionstherapie oder Kaltluftexposition) liegt in der Möglichkeit begründet, eine große Körperoberfläche adressieren zu können. Die Wirkmechanismen werden sowohl veränderten lokalen Stoffwechselvorgängen im Muskelgewebe selbst, als auch systemischen Vorgängen (u. a. vegetatives Nervensystem) zugesprochen und sind bis heute nicht endgültig geklärt [13]. Lokale Verfahren (z. B. eiswassergetränkte Binden, Kühlelemente) bleiben in der Regel der Akuttherapie struktureller Muskelverletzungen vorbehalten (z. B. klassisches PRICE-Verfahren) [19, 20]. Auch eine optimale Sporternährung und die Einnahme einiger Nahrungsergänzungsmittel, bzw. pflanzlicher Wirkstoffe, können die Entstehung und Ausprägung der DOMS laut aktuellen Studien positiv beeinflussen [13]. Spezifische Anwendungskriterien sollten hierbei stets berücksichtigt werden. Die Autoren verweisen diesbezüglich auch auf von Ihnen verfasste weiterführende Literatur [13, 18].
Literatur:
[1] Leal LG, Lopes MA, Batista ML. Physical Exercise-Induced Myokines and Muscle-Adipose Tissue Crosstalk: A Review of Current Knowledge and the Implications for Health and Metabolic Diseases. Frontiers in Physiology. 2018;9(1307).
[2] Bloch W, Hotfiel T, Ueblacker P, Tischer T., Bily W, Engelhardt M. Anatomie/Physiologie der Muskelheilung. In: Engelhardt M, Mauch F, eds. Muskel- und Sehnenverletzungen: Rolle-Verlag; 2017.
[3] Zugel M, Maganaris CN, Wilke J, et al. Fascial tissue research in sports medicine: from molecules to tissue adaptation, injury and diagnostics: consensus statement. Br J Sports Med. 2018;52(23):1497.
[4] Huxley H, Hanson J. Changes in the cross-striations of muscle during contraction and stretch and their structural interpretation. Nature. 1954;173(4412):973-976.
[5] Huxley AF. Muscle structure and theories of contraction. Prog Biophys Biophys Chem. 1957;7:255-318.
[6] Gordon AM, Huxley AF, Julian FJ. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. J Physiol. 1966;184(1):170-192.
[7] Herzog W, Leonard TR. Force enhancement following stretching of skeletal muscle: a new mechanism. J Exp Biol. 2002;205(Pt 9):1275-1283.
[8] Hessel AL, Lindstedt SL, Nishikawa KC. Physiological Mechanisms of Eccentric Contraction and Its Applications: A Role for the Giant Titin Protein. Front Physiol. 2017;8:70.
[9] Herzog W. The role of titin in eccentric muscle contraction. J Exp Biol. 2014;217(Pt 16):2825-2833.
[10] Herzog W, Schappacher G, DuVall M, Leonard TR, Herzog JA. Residual Force Enhancement Following Eccentric Contractions: A New Mechanism Involving Titin. Physiology (Bethesda). 2016;31(4):300-312.
[11] Mueller-Wohlfahrt HW, Haensel L, Mithoefer K, et al. Terminology and classification of muscle injuries in sport: the Munich consensus statement. Br J Sports Med. 2013;47(6):342-350.
[12] Hotfiel T, Freiwald J, Hoppe MW, et al. Advances in Delayed-Onset Muscle Soreness (DOMS): Part I: Pathogenesis and Diagnostics. Sportverletz Sportschaden. 2018;32(4):243-250.
[13] Heiss R, Lutter C, Freiwald J, et al. Advances in Delayed-Onset Muscle Soreness (DOMS) – Part II: Treatment and Prevention. Sportverletz Sportschaden. 2019;33(1):21-29.
[14] Nurenberg P, Giddings CJ, Stray-Gundersen J, Fleckenstein JL, Gonyea WJ, Peshock RM. MR imaging-guided muscle biopsy for correlation of increased signal intensity with ultrastructural change and delayed-onset muscle soreness after exercise. Radiology. 1992;184(3):865-869.
[15] Hotfiel T, Kellermann M, Swoboda B, et al. Application of Acoustic Radiation Force Impulse Elastography in Imaging of Delayed Onset Muscle Soreness: A Comparative Analysis With 3T MRI. J Sport Rehabil. 2018;27(4):348-356.
[16] Ulbricht A, Gehlert S, Leciejewski B, Schiffer T, Bloch W, Hohfeld J. Induction and adaptation of chaperone-assisted selective autophagy CASA in response to resistance exercise in human skeletal muscle. Autophagy. 2015;11(3):538-546.
[17] Kellermann M HM, Swoboda B, Gelse K, Freiwald J, Grim C, Nagel A, Uder M, Wildner D, Hotfiel T. Intramuscular Perfusion Response in Delayed Onset Muscle Soreness (DOMS): A Quantitative Analysis with Contrast-Enhanced Ultrasound (CEUS). Int J Sports Med. 2017;ahead of print.
[18] Hotfiel T, Mayer I, Huettel M, et al. Accelerating Recovery from Exercise-Induced Muscle Injuries in Triathletes: Considerations for Olympic Distance Races. Sports (Basel). 2019;7(6).
[19] Hotfiel T, Seil R, Bily W, et al. Nonoperative treatment of muscle injuries – recommendations from the GOTS expert meeting. J Exp Orthop. 2018;5(1):24.
[20] Ueblacker P, Haensel L, Mueller-Wohlfahrt HW. Treatment of muscle injuries in football. J Sports Sci. 2016:1-9.
Autoren
ist Verbandsarzt der Deutschen Triathlon Union (DTU). Neben der klinischen Tätigkeit im Zentrum für Muskuloskelettale Chirurgie (OZMC) des Klinikums Osnabrück beschäftigt er sich wissenschaftlich schwerpunktmäßig mit Muskel- und Sehnenverletzungen und kann auf diesem Gebiet eine Vielzahl internationaler Publikationen vorweisen. Er ist Vorstandsmitglied der GOTS, Mitglied des GOTS-Komitees Muskel, Mitglied im „Muscle Research Center Erlangen“ (MURCE) und wiss. Beirat der sportärztezeitung.