Das Knochenmarködem beschreibt eine schmerzhafte Flüssigkeitsansammlung im Knochen [1]. Knochenmarködeme können sowohl primär als auch sekundär infolge entzündlicher, degenerativer, infektiöser oder maligner Erkrankungen auftreten [2]. Unklar ist, ob die primäre Form eine eigenständige Pathologie ist oder eine Vorstufe der Osteonekrose [2].
Das Fehlen nekrotischer Anteile in Gewebeproben und Anzeichen eines gesteigerten Knochenstoffwechsels deuten jedoch darauf hin, dass es als eine eigenständige Erkrankung zu betrachten ist [3].
Was ist die Ursache des Ödems?
Bei traumatischer Genese spricht man vom „Bone Bruise“ im Sinne einer Knochenkontusion. Dem können sowohl direkte Traumata als auch Distraktionsverletzungen zugrunde liegen. Meistens liegen aber komplexere Verletzungsmuster mit einer Kombination der beiden vor [4]. Zudem treten Knochenmarködeme häufig auch im Rahmen von Bandverletzungen des Sprunggelenks und des Knies auf. In diesen Fällen ist aber keine spezifische Therapie erforderlich [5]. Die Knochenödeme können aber wertvolle Rückschlüsse auf den Verletzungshergang und mögliche Begleitverletzungen ermöglichen [6]. Neben akuten Verletzungen kann das Knochenmarködem auch durch chronisch repetitive Traumata entstehen. Wird dies nicht behandelt, kann sich eine Stressfraktur entwickeln. Auch eine veränderte Statik, z. B. ein genu valgum oder varum kann zu Knochenmarködemen führen [4]. Aber auch atraumatische Entstehungsweisen (primäres Knochenmarködem) sind möglich. Diese betreffen meist jüngere Patienten und treten häufiger bei Sportlern auf. Hier sind meistens die großen Gelenke der unteren Extremität betroffen [4].
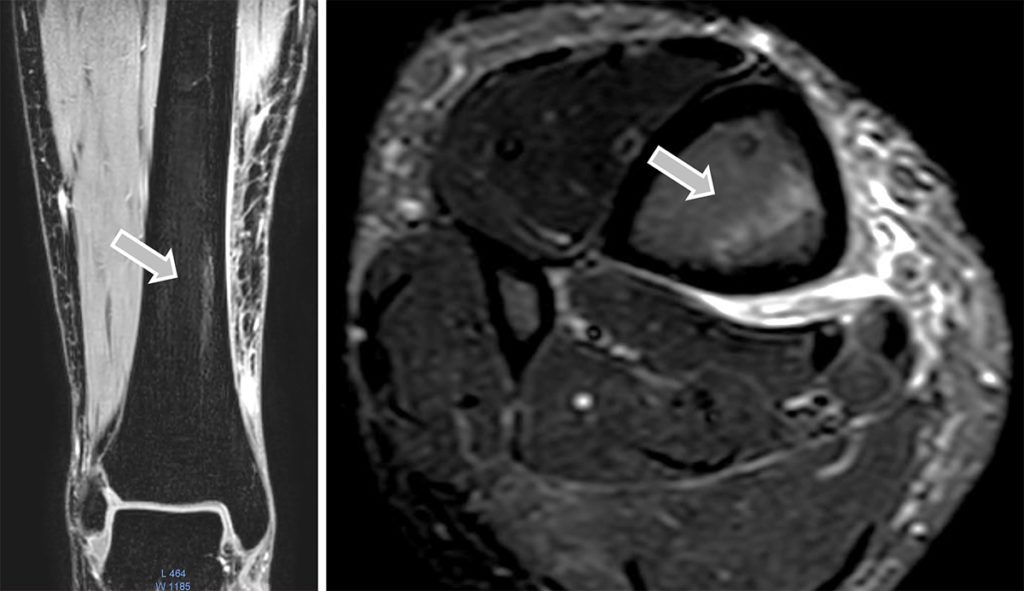
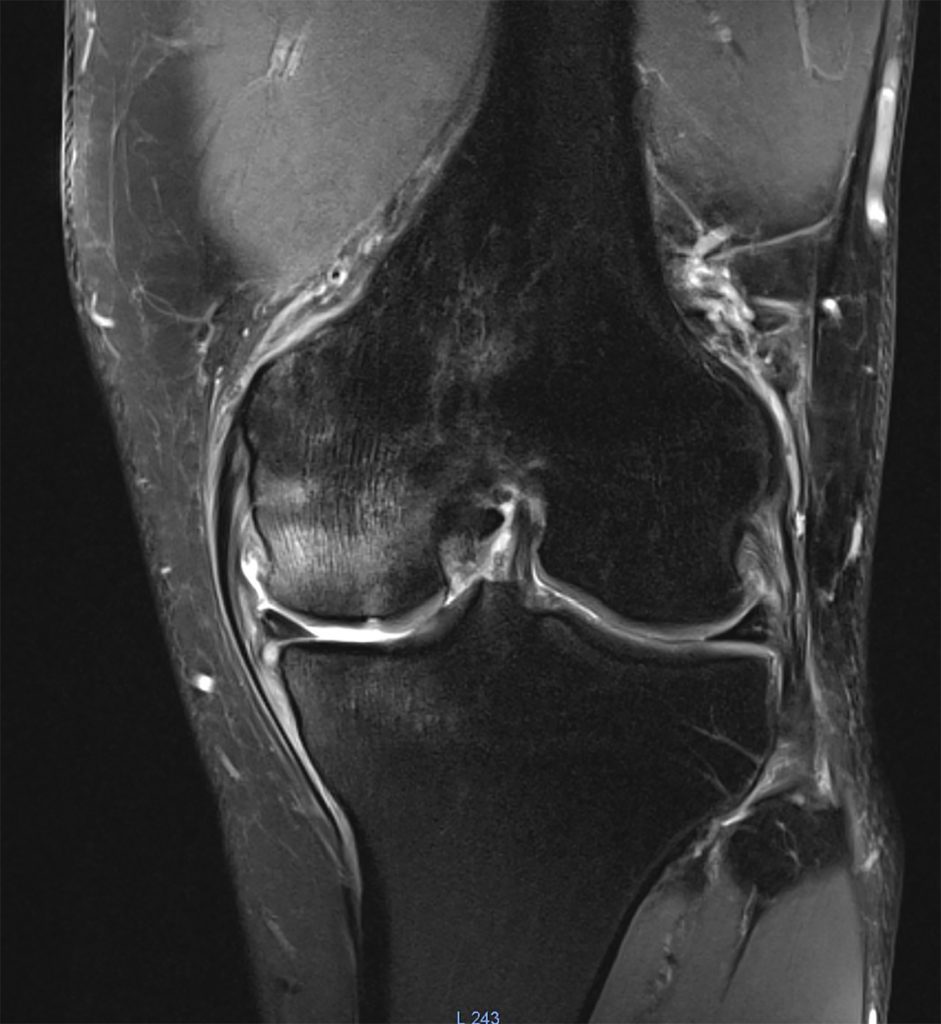
Histologie und Bildgebung
Die histopathologischen Veränderungen bei Knochenmarködemen reichen von reinen Öde-
men über Einblutungen bis hin zu trabekulären Mikrofrakturierungen und Nekrosen der zellulären Elemente des subchondralen Knochens. Diese Vielfalt erklärt sich wahrscheinlich auch durch die mannigfaltigen Ursachen [4]. Während das Nativröntgen normalerweise unauffällig ist, stellen sich Knochenmarködeme im MRT als hyperintense Zonen in T2- und STIR-Sequenzen dar, während sie in der T1-Wichtung in einem etwas geringeren Ausmaß hypointens sind. Veränderungen im Röntgen sind erst bei fortgeschrittenen Stressfrakturen zu erkennen [4]. Allerdings ist nicht jedes in der Bildgebung auftauchende Ödem pathologisch. In einer Fallserie mit 16 professionellen Mittel- und Langstreckenläufern fanden sich bei 14 Athleten (87,5 %) Knochenmarködeme. Ein Zusammenhang mit Beschwerden, die während der Saison auftraten, bestand aber nicht [7]. Daher ist auch bei Knochenmarködemen das klinische Korrelat von großer Bedeutung.
Therapie
Neben der Teilbelastung oder Entlastung und der analgetischen Medikation hat die Physiotherapie vor allem bei Sportlern einen hohen Stellenwert. Außer der Optimierung des Knochenstoffwechsels und den medikamentösen Optionen stehen auch chirurgische Interventionsmöglichkeiten zur Verfügung [8]. Auf letztere soll hier aber nicht eingegangen werden.
Analgesie
Die Verordnung nicht steroidaler Antiphlogistika (NSAR) ist zunehmend umstritten. In mehreren Studien wurde eine verzögerte Knochenheilung nachgewiesen, wobei vor allem die enchondrale Ossifikation gehemmt wird. Dies scheint bei COX-2-Hemmern ausgeprägter zu sein als z. B. bei Ibuprofen [9]. Wenn mit Alternativen wie z. B. Paracetamol eine adäquate Analgesie erreicht werden kann, sind diese anderen NSAR vorzuziehen.
Mikronährstoffe
Zur Optimierung des Knochenstoffwechsels ist zunächst eine optimale Mikronährstoffversorgung sicherzustellen. Der wohl bekannteste Vertreter ist das Vitamin D, bei dem eine Einstellung auf hochnormale Werte erfolgen sollte. Um diese Werte zu erreichen, ist die Ernährung mit den typischen Vitamin D-Quellen wie fettreichem Seefisch und Milchprodukten aber nicht ausreichend. Auch die Produktion über die Haut ist in unseren Breitengraden meist insuffizient. Daher sollte entsprechend dem 25-OH-Vitamin D3-Serumspiegels das Vitamin D hochdosiert substituiert werden, bis ein Zielwert von über 40 ng/ml erreicht ist. Bei Werten unter 20 ng/ml wird initial ein Bolus von 100.000 IE, bei Werten von 20 – 30 ng/ml ein Bolus von 60.000 IE verabreicht. Es folgt die Gabe von 20.000 IE pro Woche. Dabei ist eine ausreichende Calciumzufuhr sicherzustellen. Vor allem bei Patienten, die auf Milchprodukte teilweise oder ganz verzichten, sollte eine ausführlichere Ernährungsanamnese erfolgen und Calcium gegebenenfalls substituiert werden.
Zwei weitere, eher unbekannte Vertreter aus der Reihe der Mikronährstoffe sind das Vitamin K1 und Bor. Ersteres ist an der Mineralisierung des Knochens durch Carboxylieruung von Osteocalcin beteiligt und kommt in grünen Gemüsearten sowie Hühner- und Rindfleisch vor. Bor vermindert nicht nur die Ausscheidung von Calcium, Magnesium, Phosphor und Vitamin D, sondern erhöht auch den 17-β-Östradiol-Spiegel und spielt eine Rolle in der Steroidhormonsynthese. Bor ist in Rosinen, Rotwein, Pflaumen, Nüssen und Avocados enthalten.
Knochenresorptionshemmer – letzte Hoffnung oder früher Einsatz
Bei ausbleibendem Erfolg sollten weitere medikamentöse Optionen in Erwägung gezogen werden. Bisphosphonate sind eigentlich zur Therapie der Osteoporose und Knochenmetastasen zugelassen. In einer Fallserie zum Einsatz von Ibandronat bei 25 Sportlern mit Knochenmarködem berichteten 64 % der Patienten innerhalb der ersten zwei Wochen von einer Schmerzreduktion. Bei zwei Sportlern trat als Nebenwirkung eine Akute-Phase-Reaktion auf. Im Durchschnitt konnten die Athleten nach 102 Tagen wieder in den Spielbetrieb einsteigen. Diese Zeit war nur halb so lang, wenn zwischen Diagnosestellung und Bisphosphonatgabe weniger als 40 Tage vergangen waren [8]. Eine erste Fallserie zum Einsatz von Denosumab beim Knochenmarködemsyndrom zeigte ebenfalls eine gute Wirksamkeit. Bei der Hälfte der 14 Patienten war das Knochmarködem nach 6 – 12 Wochen nicht mehr nachweisbar, bei weiteren sechs rückläufig und nur bei einem unverändert [1]. Die Autoren legen nahe, dass Denosumab eine bessere Alternative als Bisphosphonate sein könnte, da die Wirkung schneller eintritt. Dies könnte besonders im Profisport einen wichtigen Zeitgewinn bedeuten. Mangels kontrollierter Studien ist es für ein-
deutige Empfehlungen noch zu früh.
Eine weitere medikamentöse Therapieoption sind Prostacyclin-Analoga wie Iloprost. Diese sollen die Durchblutung verbessern und dadurch die Heilung unterstützen, gehen aber häufig mit Nebenwirkungen einher [10]. Für die genannten Medikamente (Knochresorptionshemmer und Prostacyclin-Analoga) gilt aber, dass sie nicht für die Therapie des Knochenmarködems zugelassen sind und damit einen Off-Label-Use darstellen. Darüber sind die Patienten aufzuklären.
Prognose
Die Angaben zur Ausheilungsdauer reichen in der Literatur von drei Wochen bis zwei Jahren. Die Zeit bis zur Ausheilung hängt von dem Ausmaß des Traumas und des Ödems ab [4]. Auch bestimmte Lokalisation wie das Knochenmarködem am Schambein, bekannt als Schambeinentzündung, sind mit längeren Ausfallzeiten assoziiert und bedürfen einer spezifischen Therapie.
Fazit
Das Knochenmarködem erfordert eine rasche Diagnostik und Therapie, die sich je nach Ursache unterscheidet. Der Bone Bruise im Rahmen von Bandverletzung erfordert meist keine spezifische Therapie. Bei chronisch traumatischer Genese und primären Knochenmarködemen kann neben Entlastung, Physiotherapie, Analgesie sowie einer Optimierung des Knochenstoffwechsels auch der Einsatz von Knochenresportionshemmern erwogen werden.
Literatur
[1] Rolvien, T., Schmidt, T., Butscheidt, S., Amling, M., & Barvencik, F. (2017). Denosumab is effective in the treatment of bone marrow oedema syndrome. Injury.
[2] Patel, S. (2014). Primary bone marrow oedema syndromes. Rheumatology, 53(5), 785-792.
[3] Berger, C. E., Kröner, A. H., Minai-Pour, M. B., Ogris, E., & Engel, A. (2003). Biochemical markers of bone metabolism in bone marrow edema syndrome of the hip. Bone, 33(3), 346-351.
[4] Vanhoenacker, F. M., & Snoeckx, A. (2007). Bone marrow edema in sports: general concepts. European journal of radiology, 62(1), 6-15.
[5] Longo, U. G., Loppini, M., Romeo, G., van Dijk, C. N., Maffulli, N., & Denaro, V. (2013). Bone bruises associated with acute ankle ligament injury: do they need treatment?. Knee Surgery, Sports Traumatology, Arthroscopy, 21(6), 1261-1268.
[6] Kozoriz, M. G., Grebenyuk, J., Andrews, G., & Forster, B. B. (2012). Evaluating bone marrow oedema patterns in musculoskeletal injury. British journal of sports medicine, 46(13), 946-953.
[7] Kornaat, P. R., & Van de Velde, S. K. (2014). Bone marrow edema lesions in the professional runner. The American journal of sports medicine, 42(5), 1242-1246.
[8] Simon, M. J., Barvencik, F., Luttke, M., Amling, M., Mueller-Wohlfahrt, H. W., & Ueblacker, P. (2014). Intravenous bisphosphonates and vitamin D in the treatment of bone marrow oedema in professional athletes. Injury, 45(6), 981-987.
[9] Su, B., & O’Connor, J. P. (2013). NSAID therapy effects on healing of bone, tendon, and the enthesis. Journal of applied physiology, 115(6), 892-899.
[10] Aigner, N., Petje, G., Schneider, W., Meizer, R., Wlk, M., Kotsaris, S., Knahr, K. & Landsiedl, F. (2005). Bone marrow edema syndrome of the femoral head. Wiener klinische Wochenschrift, 117(4), 130-135.
Autoren
ist Facharzt für Orthopädie und Unfallchirurgie, Spezielle Unfallchirurgie und Sportmedizin. Er ist Gründer und Inhaber des LANS Medicum. Seine mannschaftsärztlichen Betreuungen umfassten u. a. das Handballteam des HSV sowie von 2011-2014 die Erstligafußballmannschaft des Hamburger SV. Heute betreut er mit seinem Team mehrere Fußball- und Hockeyteams sowie das Hamburger Ballett von John Neumeier. Außerdem ist Prof. Catalá-Lehnen als Professor für den Schwerpunkt Orthopädie an der Medical School Hamburg und am UKE in der Lehre für das Fach Knochenpathologie tätig.
ist Sportwissenschaftler und Assistenzarzt in der Weiterbildung zum Facharzt für Orthopädie und Unfallchirurgie am Städtischen Klinikum Lüneburg. Am LANS Medicum betreut er die Leistensprechstunde.