Rupturen des vorderen Kreuzbandes (VKB) zählen zu den am häufigsten auftretenden Verletzungen des Kniegelenks im Sport und ziehen langfristige Konsequenzen für die betroffenen Athleten nach sich. Trotz operativer Ersatzplastik und intensiver postoperativer Rehabilitation weisen viele VKB-Patienten jedoch persistierende funktionelle Defizite [1], ein erhöhtes Risiko für tibiofemorale und/oder patellofemorale Osteoarthritis [2], sowie eine bis zu 6-fach erhöhte Inzidenz für ipsilaterale Transplantatruptur oder kontralaterale Kreuzbandläsion nach Wiederaufnahme ihrer
sportlichen Aktivität auf [3].
Derzeit wird davon ausgegangen, dass die den funktionellen Defiziten zugrunde liegenden Mechanismen dabei über biomechanische Veränderungen der unteren Extremität hinausgehen und durch Modifikationen im sensomotorischen System bedingt sein könnten. Eine zunehmende Anzahl an Studien deutet bereits darauf hin, dass verletzungsbedingte Veränderungen der afferenten Informationen vom Kniegelenk mit Adaptionen auf höheren Ebenen des zentralen Nervensystems, wie der Großhirnrinde, assoziiert sein könnten. Aus einem aktuellen Literaturreview von Neto und Kollegen (2019) [5] geht darüber hinaus hervor, dass bei Patienten mit VKB-Ruptur neuroplastische Abweichungen wie beispielsweise eine verringerte Erregbarkeit des primär somatosensorischen Kortex oder des motorischen Kortex zu beobachten sind. Zudem zeigten die Autoren mit ihrer Literaturübersicht, dass VKB-Patienten nach Beendigung der Rehabilitationsphase bereits bei einfachen sensomotorischen Aufgaben vermehrt neurokognitive Ressourcen im Gehirn einbeziehen, um die aufgabenspezifische motorische Kontrolle des Knies zu erreichen [4]. Im Vergleich zu gesunden Kontrollprobanden zeigen die VKB-Patienten also eine stärkere auf die Aufgabe gerichtete Aufmerksamkeit. Dies betrifft sowohl die präzise Reproduktion von Gelenkwinkeln und -kräften [5, 6], die Wahrnehmung passiver Gelenktranslation [7], als auch die kontrollierte Extension und Flexion des Kniegelenks [8]. Folglich wird davon ausgegangen, dass VKB-Patienten adaptive sensomotorische Strategien entwickeln, um so die verletzungsbedingt veränderten afferenten Informationen des Kniegelenks zu kompensieren.
Die hohen Inzidenzzahlen für Rezidivverletzungen bei VKB-Patienten legen allerdings nahe, dass – abgesehen von möglichen operativ-bedingten Faktoren – die klinische Bewertung des funktionellen Leistungsstandes und des geeigneten Zeitpunktes für eine sichere Rückkehr zur sportlichen Aktivität auf der Basis bisheriger Modelle nicht optimal gelingt. Diese traditionellen return-to-sports Assessments basieren üblicherweise auf der postoperativen Zeitspanne und der Beurteilung von Gelenkerguss, Bewegungsausmaß, Laxität sowie der unipedalen Funktions- und isokinetischen Kraftdiagnostik. Es wird jedoch angenommen, dass diese Verfahren möglicherweise nicht ausreichend Sensitivität aufweisen, um VKB-Patienten mit schwacher neuromuskulärer Funktionsfähigkeit und damit erhöhtem Risiko für zukünftige Rezidivverletzungen zu identifizieren [9].
Neurophysiologische Ebene
Eine vielversprechende Ergänzung der bestehenden klinischen und apparativen Diagnostik könnten mobile bildgebende Verfahren aus den Neurowissenschaften darstellen, um den rehabilitativen Fortschritt über die motorischen Verhaltensdaten hinaus auch auf neurophysiologischer Ebene quantifizierbar zu machen [10]. So bietet beispielsweise die mobile Elektroenzephalographie (EEG) eine nicht-invasive Möglichkeit, die Funktionen des Gehirns mittels elektrophysiologischer kortikaler Potenziale an der Schädeloberfläche abzubilden. Im Gegensatz zu den klassischen bildgebenden Verfahren der klinischen Neurowissenschaft ermöglichen mobile EEG-Sensorsysteme die zeitlich hochauflösende Aufzeichnung der kortikalen Aktivität in frei beweglichen Messsituationen und realen Umgebungen [11]. Dabei können anhand von rhythmischen Oszillationen in unterschiedlichen Frequenzbereichen Rückschlüsse über die elektrische Aktivität und funktionelle Konnektivität synchron entladener Neuronenpopulationen in und zwischen unterschiedlichen Areale des Gehirns gezogen werden.
In einer explorativen Studie unserer Arbeitsgruppe [12] wurde kürzlich untersucht, inwiefern adaptive Mechanismen des Gehirns in einer mobilen Messsituation bei VKB-Patienten anhand des EEGs abgebildet werden können. Bei den VKB-Patienten konnten hierbei unterscheidbare Muster funktioneller Konnektivität im unipedalen Stand auf dem verletzten Bein beobachtet werden. Diese deuteten darauf hin, dass die Patienten zur Kompensation ihrer veränderten Afferenz möglicherweise vermehrt somatosensorische und visuelle Informationen in kortikale Netzwerke einbeziehen, um so die Stabilität des Kniegelenks im Einbeinstand zu gewährleisten. Da die funktionelle Rolle dieser Netzwerk-Modulationen jedoch vorerst ungewiss bleibt, bedarf es weiterer Studien zur Überprüfung dieser kortikalen Phänomene.
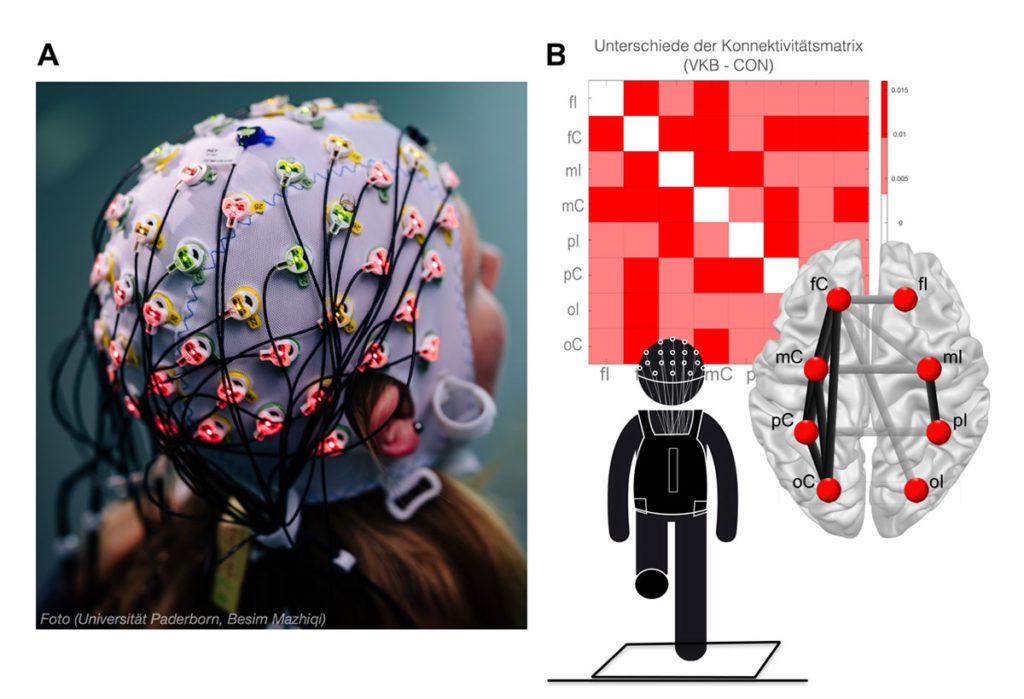
Fazit
Zusammenfassend kann jedoch festgehalten werden, dass mobile neurophysiologische Messverfahren das Potenzial haben, neue Perspektiven der funktionellen Diagnostik in der VKB-Rehabilitation zu eröffnen. Sie könnten so zukünftig dazu beitragen, multimodale Assessments zur frühzeitigen Identifikation von sensomotorischen Kontrolldefiziten bei VKB-Patienten zu entwickeln und zu optimieren
Literatur
[1] E. Tengman, L. Brax Olofsson, A.K. Stensdotter, K.G. Nilsson, and C.K. Häger, “Anterior cruciate ligament injury after more than 20 years. II. Concentric and eccentric knee muscle strength.,” Scandinavian Journal of Medicine and Science in Sports. vol. 24, no. 6, pp. e501–e509, 2014.
[2] N.K. Paschos, “Anterior cruciate ligament reconstruction and knee osteoarthritis.,” World Journal of Orthopaedics. vol. 8, no. 3, pp. 212–217, 2017.
[3] M. V. Paterno, M.J. Rauh, L.C. Schmitt, K.R. Ford, and T.E. Hewett, “Incidence of Second ACL Injuries 2 Years After Primary ACL Reconstruction and Return to Sport.,” The American Journal of Sports Medicine. vol. 42, no. 7, pp. 1567–1573, 2014.
[4] T. Neto, T. Sayer, D. Theisen, and A. Mierau, “Functional brain plasticity associated with ACL injury: A scoping review of current evidence.,” Neural Plasticity. vol. 2019, p. 2019.
[5] J. Baumeister, K. Reinecke, and M. Weiss, “Changed cortical activity after anterior cruciate ligament reconstruction in a joint position paradigm: An EEG study.,” Scandinavian Journal of Medicine and Science in Sports. vol. 18, no. 4, pp. 473–484, 2008.
[6] J. Baumeister, K. Reinecke, M. Schubert, and M. Weiß, “Altered electrocortical brain activity after ACL reconstruction during force control.,” Journal of Orthopaedic Research. vol. 29, no. 9, pp. 1383–1389, 2011.
[7] Y.W. An, A. Di Trani Lobacz, T. Lehmann, et al., “Neuroplastic changes in anterior cruciate ligament reconstruction patients from neuromechanical decoupling.,” Scandinavian Journal of Medicine and Science in Sports. pp. 1–8, 2018.
[8] C.R. Criss, J.A. Onate, and D.R. Grooms, “Neural activity for hip-knee control in those with anterior cruciate ligament reconstruction: A task-based functional connectivity analysis.,” Neuroscience Letters. vol. 730, no. May, p. 134985, 2020.
[9] S.W. Mayer, R.M. Queen, D. Taylor, et al., “Functional Testing Differences in Anterior Cruciate Ligament Reconstruction Patients Released Versus Not Released to Return to Sport.,” The American Journal of Sports Medicine. vol. 43, no. 7, pp. 1648–1655, 2015.
[10] J. Baumeister, “What the Brain can Tell us in Musculoskeletal Rehabilitation.,” Journal of Sports Medicine & Doping Studies. vol. 02, no. 03, pp. 2–3, 2012.
[11] S. Ladouce, D.I. Donaldson, P.A. Dudchenko, and M. Ietswaart, “Understanding minds in real-world environments: Toward a mobile cognition approach.,” Frontiers in Human Neuroscience. vol. 10, no. January, pp. 1–14, 2017.
[12] T. Lehmann, “Exploring Cortical Contributions to Postural Control in Patients After Anterior Cruciate Ligament Reconstruction,” (2021).
Autoren
studierte Sportwissenschaften an der Deutschen Sporthochschule in Köln (B.A.), sowie der
Universität Paderborn (M.A.). Er promovierte im Jahr 2020 an der Naturwissenschaftlichen Fakultät der Universität Paderborn im Arbeitsbereich Trainings- und Neurowissenschaften. Sein primäres Foschungsinteresse umfasst die angewandten Neurowissenschaften im Kontext der Rehabilitation muskuloskeletaler Verletzungen.




