Dr. rer. nat. Raphaela Schwappacher, Medizinische Klinik 1 – Gastroenterologie, Pneumologie und Endokrinologie, Universitätsklinikum Erlangen
Regelmäßige Bewegung reduziert das Krebsrisiko. Der Skelettmuskel selbst ist ein endokrines Organ, das durch Stimulation humorale Faktoren, sogenannte Myokine, sekretiert, die die Effekte körperlicher Bewegung vermitteln. Serumproben von Gesunden, Krebsüberlebenden oder Krebspatienten im Frühstadium konnten nach einer Sportintervention das Wachstum und Überleben von Karzinomzellen stören. In einer kürzlich veröffentlichten Studie konnten wir zeigen, dass das Serum von Patienten mit fortgeschrittener Krebserkrankung nach einem 12-wöchigen Sportprogramm die Proliferation von Karzinomzellkulturen inhibiert und deren Apoptose induziert.
Die Sporttherapie erfolgte mittels Ganzkörper (whole body)-Elektromyostimulation (WB-EMS), einem Widerstandstraining, das effizient und weniger erschöpfend als Alternative für Sport bei Patienten mit körperlichen Einschränkungen angewendet werden kann. Unsere Forschungsergebnisse beschreiben erstmals, dass 1) auch bei fortgeschrittener Krebserkrankung die Muskulatur so stimuliert werden kann, dass anti-tumorale Faktoren sekretiert werden und 2) die Bewegungsform der WB-EMS diese protektiven Faktoren induzieren kann.
Körperliches Training und anti-inflammatorische Umgebung
Körperliche Bewegung nimmt neben den verschiedenen positiven Auswirkungen auf Körper und Geist auch Einfluss auf die Inzidenz maligner Erkrankungen und kann bei bestehender Krebsdiagnose dem Fortschreiten der Erkrankung entgegenwirken [1, 2]. Körperlich aktive Krebsüberlebende haben ein geringeres Risiko für ein Rezidiv und eine verringerte Mortalität [3]. Die Teilnahme von Krebspatienten an angepassten Sport-/Bewegungsprogrammen während einer onkologischen Therapie wird mittlerweile befürwortet [4, 5]. Der anabole Effekt eines körperlichen Trainings auf den Muskelmetabolismus ist bekannt. Studien mit Krebserkrankten zeigten, dass Sport die Muskelmasse, -stärke und/oder -funktionalität steigert und sich dadurch die Lebensqualität der Betroffenen verbessert [6, 7]. Auch psychosoziale Faktoren und Fatigue sowie Morbidität und Mortalität wurden positiv beeinflusst [7 – 9]. Ein Großteil der Humanstudien zur Untersuchung der vielfältigen Effekte von Bewegung wurde mit Überlebenden einer Krebserkrankung durchgeführt. Krebserkrankte mit Kachexie leiden meist an Kraftlosigkeit und Ermüdungserscheinungen, wodurch konsequentes körperliches Training oft nicht möglich ist. Elektromyostimulation (EMS) bei Gesunden mit bewegungsarmer Lebensweise oder bei Sportlern führte zu einem nachweisbaren Zuwachs an Muskelmasse und/oder -stärke [10, 11]. Eine begleitende Therapieform bei Krebspatienten, vor allem mit Kachexie-Symptomatik, sehen wir in der Ganzkörper-Elektromyostimulation (WB-EMS). Das WB-
EMS-Widerstandstraining kann kontinuierlich und effizient angewendet werden und kann die Funktion der großen Skelettmuskelgruppen verbessern sowie muskelabbauenden Vorgängen entgegenwirken. Die Muskelstimulation erfolgt mittels Elektroden auf der Haut [10, 12, 13]. Unsere Arbeitsgruppe publizierte, dass ein 12-wöchiges WB-EMS-Training bei Patienten mit fortgeschrittenen soliden Tumoren oder hämatologischen Krebserkrankungen unter kurativer und palliativer Therapie machbar und gut verträglich ist und die Körperzusammensetzung und -funktion signifikant verbessern kann [7, 14, 15].
Die Effekte von Bewegung und Sport auf den Körper sind komplex, und inwieweit sich dadurch induzierte Mechanismen auf die Entstehung und das Fortschreiten einer Krebserkrankung auswirken, ist nicht vollständig geklärt. Der aktivierte Skelettmuskel sekretiert bestimmte Faktoren wie Cytokine und Interleukine; diese sogenannten Myokine schaffen eine anti-inflammatorische Umgebung und übertragen die Effekte körperlicher Bewegung [16 – 18]. Das „Muskelsekretom“ umfasst eine Vielzahl an Myokinen, die die Kommunikation innerhalb des Muskels und zwischen Muskel und verschiedenen Körpergeweben ermöglichen [16, 17]. Als Prototyp-Myokin gilt Interleukin 6 (IL6). Entgegen seiner anerkannten pro-inflammatorischen Aktivität wirkt IL6 aus dem Muskel entzündlichen Prozessen entgegen [16]. Weitere gut beschriebene Myokine sind u.a. Irisin, IL15 und Brain-derived neutrophic factor (BDNF) [1, 16, 19]. Es scheint eine direkte Verbindung zwischen Krebs und Bewegungs-induzierten Myokinen zu bestehen. Hojman et al. publizierten 2011 erstmals, dass durch Sport verändertes, somit konditioniertes Serum von trainierenden Mäusen das Wachstum von Krebszellen hemmt und deren Zelltod induziert [20]. Weitere in vivo– und in vitro-Human- und Mausstudien mit Gesunden – nach akutem oder Langzeittraining – folgten und beschrieben ähnliche Effekte auf Karzinomzellen [21 – 23]. Ein vergleichender Ansatz zeigte, dass das Serum von gesunden oder an Brustkrebs im Frühstadium erkrankten Frauen nach akuter Bewegung auch einen inhibitorischen Einfluss auf maligne Zellkulturen hatte [24]. Das Serum von Überlebenden einer Darmkrebserkrankung nach akuter Bewegung verringerte ebenfalls die Krebszellproliferation [25]. Einige dieser Beobachtungen konnte direkt auf Myokine wie Oncostatin M [20], Irisin [26, 27] und Secreted protein acidic and rich in cysteine (SPARC, [22]) zurückgeführt werden.
Myokineffekte auf Krebszellen
Jedoch ist sehr wenig darüber bekannt, wie sich Sport-konditioniertes Serum von fortgeschrittenen Tumorpatienten auf das Wachstum und Überleben von Karzinomzellen auswirkt. Unsere Forschungshypothese war es, dass die anti-tumoralen Effekte von Sport/Bewegung auch in körperlich geschwächten Krebserkrankten mit einem sich fortschreitend verschlechternden Muskelstatus induziert werden können. Daher untersuchten wir in einem in vitro-Ansatz Karzinomzellkulturen unter dem Einfluss von Sport-konditioniertem Serum von fortgeschrittenen Prostatakrebspatienten, die sich entweder einer 12-wöchigen WB-EMS-Intervention unterzogen hatten oder untrainiert geblieben sind (Abb. 1) [1, 7].

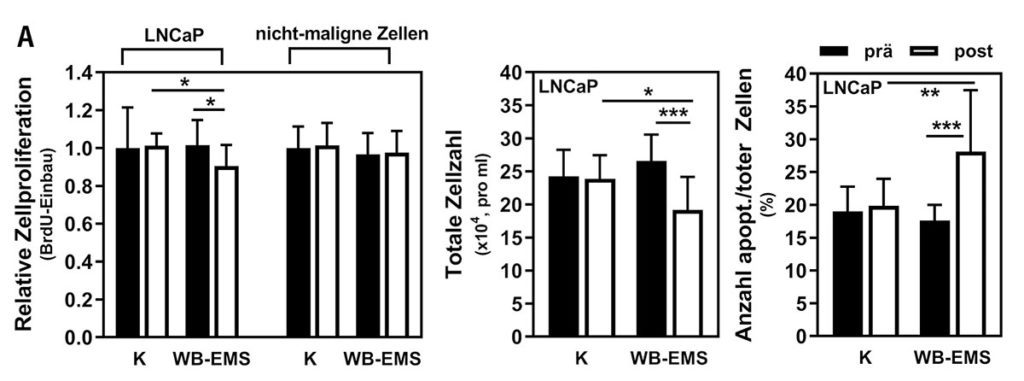
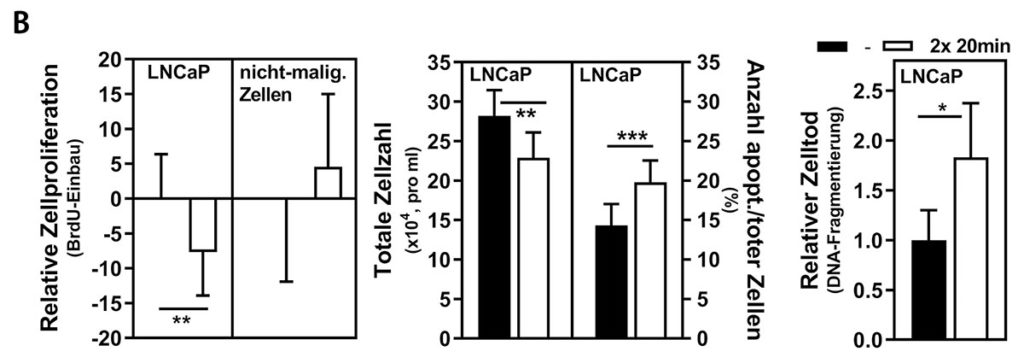
Die Kontroll- und WB-EMS-Patienten mit Prostatakarzinom unterschieden sich bei Studienbeginn nicht signifikant in relevanten Charakteristika wie Alter, Körpergewicht, Skelettmuskelmasse, physischer Funktionalität und Blutparametern. Nachdem wir Prostatakrebszellen mit Kontroll- oder WB-EMS-Patientenserum behandelt hatten, konnten wir beobachten, dass die Proliferation der Krebszellen durch das WB-EMS-Serum inhibiert wurde, bei gleichzeitiger Induktion von Apoptose (Abb. 2 a); interessanterweise war das Wachstumsverhalten von nicht-malignen Zellkulturen bei gleicher Behandlung unbeeinflusst. „Electric pulse stimulation (EPS)“ von Skelettmuskelzellkulturen ist ein in vitro-Modell für Bewegung [28, 29]. Durch die EPS-Behandlung von Muskelzellen konnten wir feststellen, dass bekannte EPS-responsive Gene sowie diverse gut beschriebene Myokine wie IL6, IL15 und BDNF, induziert wurden. Die Stimulation von Prostatakrebszellen mit EPS-konditioniertem Muskelzellmedium hatte, verglichen mit WB-EMS-Patientenserum, ähnliche wachstumshemmende und pro-apoptotische Effekte (Abb. 2 b). Diese Daten deuten darauf hin, dass Mechanismen, die durch Muskelstimulation (in vivo (WB-EMS) oder in vitro (EPS)) aktiviert werden, für die anti-tumoralen Effekte auf Krebszellen verantwortlich sind. Durch den direkten Vergleich der beiden Ansätze kann ein nicht-muskulärer Ursprung der beteiligten Faktoren ausgeschlossen werden. Myokine, die vom Muskel sekretiert werden, scheinen bei unseren Beobachtungen eine zentrale Rolle zu spielen. Des Weiteren konnten wir mittels einer Multiplex-Analyse von 730 Krebs-assoziierten Genen in Prostatakrebszellen Folgendes zeigen: Durch „Muskelstimulation“ wurde die Expression von Genen, die essentiell für den Zellzyklus sind (z. B. Cyclin E) oder Wachstumssignale vermitteln (z. B. WNT10A), signifikant moduliert. Auch konnte eine gesteigerte Genexpression und Aktivität der Apoptose-Vermittler Caspase 3 und 7 beobachtet werden, was auf eine mechanistische Verbindung zwischen Muskelstimulation und dem Einleiten des Zelltodes in malignen Zellen hindeutet.
Fazit
Zusammengefasst zeigen unsere Forschungsergebnisse erstmals, dass Sport – in Form von WB-EMS-Training – bei fortgeschrittenen Krebspatienten das in vitro-Wachstum von malignen Zellen hemmt, bei gleichzeitiger Induktion von Apoptose; hierbei scheint die Regulierung von Proliferations- und Apoptose-assoziierten Genen eine wichtige Rolle zu spielen. Wir konnten den Ursprung der Krebs-bekämpfenden Signale direkt auf den Muskel zurückführen, sodass eine Beteiligung von Myokinen als sehr wahrscheinlich gilt. Weiterführende Studien sollen nun durch WB-EMS-induzierte, anti-tumoral wirkende Myokine identifizieren. Wir hoffen, dass unsere Daten dazu beitragen werden, dass Sportprogramme als essentieller Teil multimodaler Therapiekonzepte für Krebserkrankte etabliert werden.
Literatur
1. Schwappacher, R., et al., Physical activity and advanced cancer: evidence of exercise-sensitive genes regulating prostate cancer cell proliferation and apoptosis. J Physiol, 2020.
2. Hojman, P., et al., Molecular Mechanisms Linking Exercise to Cancer Prevention and Treatment. Cell Metab, 2018. 27(1): p. 10 – 21.
3. Brown, J.C. and L.A. Gilmore, Physical Activity Reduces the Risk of Recurrence and Mortality in Cancer Patients. Exerc Sport Sci Rev, 2020. 48(2): p. 67 – 73.
4. Schwartz, A.L., H.D. de Heer, and J.W. Bea, Initiating Exercise Interventions to Promote Wellness in Cancer Patients and Survivors. Oncology (Williston Park), 2017. 31(10): p. 711 – 7.
5. Heywood, R., A.L. McCarthy, and T.L. Skinner, Safety and feasibility of exercise interventions in patients with advanced cancer: a systematic review. Support Care Cancer, 2017. 25(10): p. 3031 – 3050.
6. Stene, G.B., et al., Effect of physical exercise on muscle mass and strength in cancer patients during treatment–a systematic review. Crit Rev Oncol Hematol, 2013. 88(3): p. 573-93.
7. Schink, K., et al., Effects of whole-body electromyostimulation combined with individualized nutritional support on body composition in patients with advanced cancer: a controlled pilot trial. BMC Cancer, 2018. 18(1): p. 886.
8. Mishra, S.I., et al., Are exercise programs effective for improving health-related quality of life among cancer survivors? A systematic review and meta-analysis. Oncol Nurs Forum, 2014. 41(6): p. E326-42.
9. Hardee, J.P., et al., The effect of resistance exercise on all-cause mortality in cancer survivors. Mayo Clin Proc, 2014. 89(8): p. 1108-15.
10. Filipovic, A., et al., Electromyostimulation–a systematic review of the effects of different electromyostimulation methods on selected strength parameters in trained and elite athletes. J Strength Cond Res, 2012. 26(9): p. 2600-14.
11. Banerjee, P., et al., Prolonged electrical muscle stimulation exercise improves strength and aerobic capacity in healthy sedentary adults. J Appl Physiol (1985), 2005. 99(6): p. 2307-11.
12. Kemmler, W., et al., Effects of whole-body electromyostimulation on resting metabolic rate, body composition, and maximum strength in postmenopausal women: the Training and ElectroStimulation Trial. J Strength Cond Res, 2010. 24(7): p. 1880-7.
13. Kemmler, W. and S. von Stengel, Whole-body electromyostimulation as a means to impact muscle mass and abdominal body fat in lean, sedentary, older female adults: subanalysis of the TEST-III trial. Clin Interv Aging, 2013. 8: p. 1353-64.
14. Schink, K., et al., Assessment of gait parameters and physical function in patients with advanced cancer participating in a 12-week exercise and nutrition programme: A controlled clinical trial. Eur J Cancer Care (Engl), 2020. 29(2): p. e13199.
15. Schink, K., et al., Whole-Body Electromyostimulation Combined With Individualized Nutritional Support Improves Body Composition in Patients With Hematological Malignancies – A Pilot Study. Front Physiol, 2018. 9: p. 1808.
16. Karstoft, K. and B.K. Pedersen, Skeletal muscle as a gene regulatory endocrine organ. Curr Opin Clin Nutr Metab Care, 2016.
17. Hoffmann, C. and C. Weigert, Skeletal Muscle as an Endocrine Organ: The Role of Myokines in Exercise Adaptations. Cold Spring Harb Perspect Med, 2017. 7(11).
18. Piccirillo, R., Exercise-Induced Myokines With Therapeutic Potential for Muscle Wasting. Front Physiol, 2019. 10: p. 287.
19. Whitham, M. and M.A. Febbraio, The ever-expanding myokinome: discovery challenges and therapeutic implications. Nat Rev Drug Discov, 2016. 15(10): p. 719-29.
20. Hojman, P., et al., Exercise-induced muscle-derived cytokines inhibit mammary cancer cell growth. Am J Physiol Endocrinol Metab, 2011. 301(3): p. E504-10.
21. Ngo, T.H., et al., Effect of diet and exercise on serum insulin, IGF-I, and IGFBP-1 levels and growth of LNCaP cells in vitro (United States). Cancer Causes Control, 2002. 13(10): p. 929-35.
22. Aoi, W., et al., A novel myokine, secreted protein acidic and rich in cysteine (SPARC), suppresses colon tumorigenesis via regular exercise. Gut, 2013. 62(6): p. 882-9.
23. Rundqvist, H., et al., Effect of acute exercise on prostate cancer cell growth. PLoS One, 2013. 8(7): p. e67579.
24. Dethlefsen, C., et al., Exercise-Induced Catecholamines Activate the Hippo Tumor Suppressor Pathway to Reduce Risks of Breast Cancer Development. Cancer Res, 2017. 77(18): p. 4894-4904.
25. Devin, J.L., et al., Acute high intensity interval exercise reduces colon cancer cell growth. J Physiol, 2019. 597(8): p. 2177-2184.
26. Gannon, N.P., et al., Effects of the exercise-inducible myokine irisin on malignant and non-malignant breast epithelial cell behavior in vitro. Int J Cancer, 2015. 136(4): p. E197-202.
27. Liu, J., et al., Irisin inhibits pancreatic cancer cell growth via the AMPK-mTOR pathway. Sci Rep, 2018. 8(1): p. 15247.
28. Nikolic, N., et al., Electrical pulse stimulation of cultured skeletal muscle cells as a model for in vitro exercise – possibilities and limitations. Acta Physiol (Oxf), 2017. 220(3): p. 310-331.
29. Scheler, M., et al., Cytokine response of primary human myotubes in an in vitro exercise model. Am J Physiol Cell Physiol, 2013. 305(8): p. C877-86.
Autoren
ist Gastroenterologin und Ernährungsmedizinerin. Sie ist Professorin für Klinische und Experimentelle Ernährungsmedizin und Leiterin des Hector-Centers für Ernährung, Bewegung und Sport, Medizinische Klinik 1 – Gastroenterologie, Pneumologie und Endokrinologie Universitätsklinikum Erlangen.
www.medizin1.uk-erlangen.de/hector-center