Wissenschaftliche Forschung zur Rolle von Mikrobiom und Metabolom wird immer intensiver betrieben. Schon Claude Bernhard um 1870 beschrieb die „intestinalen Autointoxikation“ [1]. Ilja Iljitsch Metschnikow, der Begründer der modernen Immunologie beschrieb 1908 in seinem Buch „The Prolongation of Life“ die Effizienz von Kefir und Sauermilch wie auch anderen fermentierten Lebensmitteln auf die Gesundheit des Bauches, des Körpers und der Fittness [2]. Säuernde Fermentation im Darm verhindert wirksam die fäulnisbedingte Intoxikation.
F.X. Mayr forschte in Österreich weiter daran und veröffentlichte vor etwa 100 Jahren ein bis heute gültiges und reproduzierbar erfolgreiches Diagnostik- und Therapie-Konzept.
Silent Intoxication als Hauptursache der Silent Inflammation
Die „Stille Entzündung“ (Silent Inflammation) ist schon seit Jahren als Ursache chronischer Erkrankungen bekannt. Als eine der wesentlichen, bisher jedoch wenig beachteten Ursachen der Silent Inflammation rückt in letzter Zeit zunehmend die „Stille Intoxikation“ (Silent Intoxication) in den wissenschaftlichen Fokus. Daher werden immer mehr die verschiedenen Zusammenhänge des Darm-Milieus zu den Körper-Organen untersucht, die zunächst eine Intoxikation und dann auch eine Inflammation erleiden. Die 2022 im EMBO-Report [3] veröffentlichte Darstellung zeigt die umfassende Auswirkung des Mikrobioms und der Stoffwechselprodukte der Darmflora auf praktisch alle Organsysteme. Zusätzlich sind noch viele weitere, wie z. B. die Gut-Skin-Axis, also eine ursächliche Verbindung zwischen Darm und Hauterkrankungen, zu bedenken.
Was ist neu?
Neu ist die Bedeutung des Milieus im Stuhl. Das Darm-Milieu hängt von der Auswahl unserer Nahrung und der Qualität des Kauens und der Verdauung ab. Einige der im Darm produzierten Fäulnistoxine sind stark alkalisch [4]. Fehlt es zudem an Milchsäure (Laktat) und kurzkettigen Fettsäuren (SCFA) im Darmlumen, steigt der Stuhl-pH-Wert möglicherweise auf weit über 7. Dies ist in der so genannten „zivilisierten“ Welt bei den meisten Menschen nachweisbar. Die Betroffenen können das zunächst nur indirekt bemerken, durch Performance-Verlust, Erschöpfungssymptome, Infektanfälligkeit etc. Die dauerhafte Einstellung des Stuhl-pH-Werts auf 6,0 (und des ersten Morgenurins pH 7 – 8) ist ein wesentliches Ziel, gleichermaßen im Spitzensport wie auch zur Gesunderhaltung des Körpers. Der pH-Wert des Stuhls (Milieu im Darmlumen) und der pH des Harns oder des Speichels (näherungsweise Aussage über den pH im Körpergewebe) müssen differenziert betrachtet und bewertet werden, handelt es sich doch um verschiedene Kompartimente und Organsysteme. Die optimale Gesundheit ist nur möglich, wenn bakterielle Toxine entfernt werden und sich nicht wieder bilden [2, 4]. Studien zeigen, dass bereits das kleinste Ungleichgewicht im Verdauungssystem die muskuläre und neurologische Leistungsfähigkeit erheblich einschränkt [5 – 7].
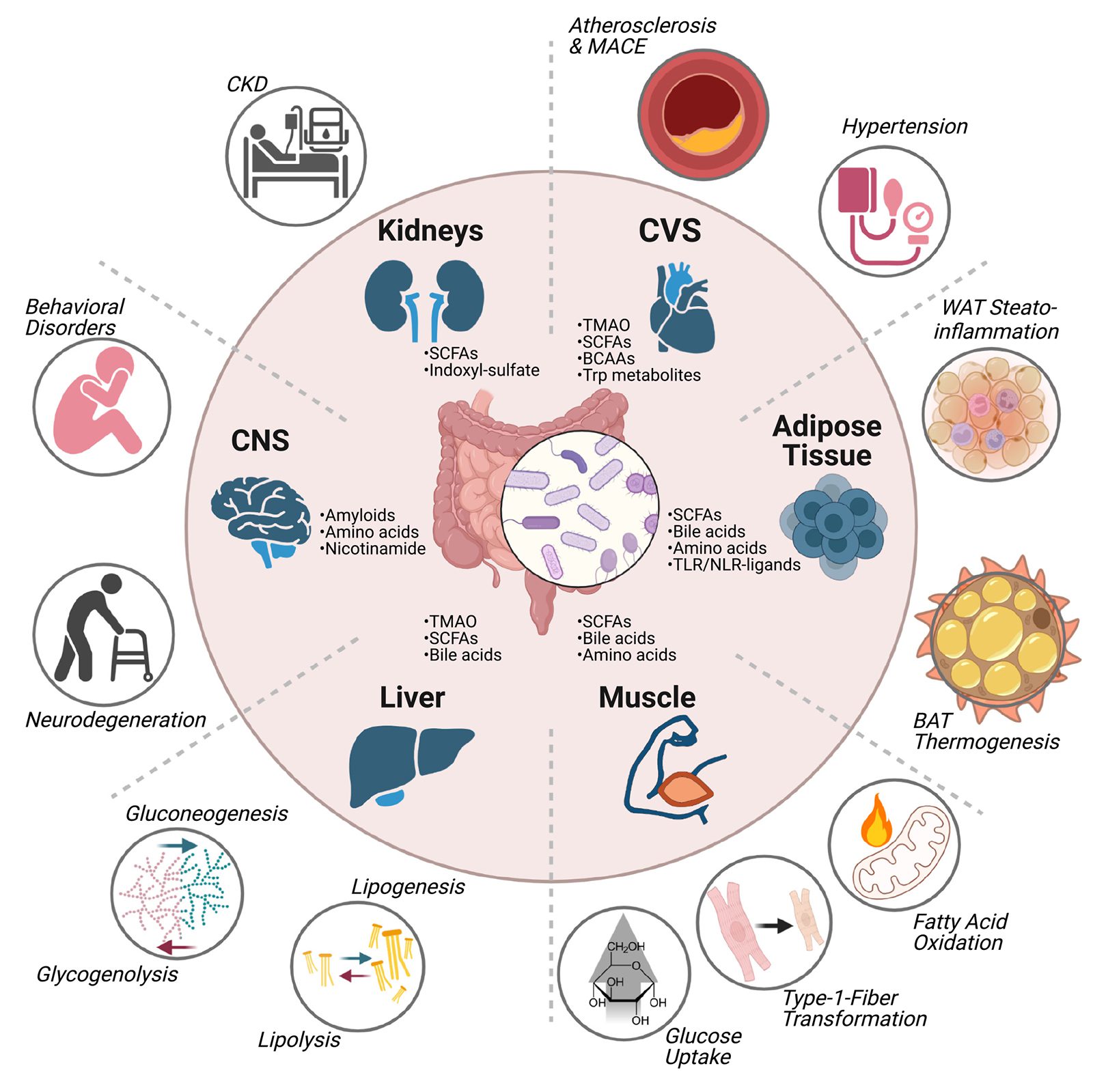
Foto: © EMBO Reports 2022 [2], Vol 23 (10) Fig. 2
Was bedeutet eine optimale Gesundheit im Verdauungssystem?
Ernährung = Nahrung + Verdauung
Die Funktion des Verdauungssystems muss wiederhergestellt werden, bevor eine optimale Nähstoffversorgung des Organismus stattfinden kann. Solange die „Verdauung“ gestört ist, kann der Körper nicht ausreichend mit Vitalstoffen versorgt werden. Richtiges „Essen“ ist das Ergebnis von Auswahl, Qualität, Quantität und der Kochmethode und erfordert:
- Gleichgewicht innerhalb der Makronährstoffe (Kohlenhydrate, Fette, Proteine)
- Optimale Versorgung mit Mikronährstoffen (Vitalstoffe inkl. Biophotonen, Elektronen und Enzyme, Mineralien, Spurenelemente)
- Ballaststoffe, Kräuter und Gewürze, die das Darmmilieu regulieren
- Geringstmöglicher Gehalt an Toxinen und Hemmstoffen (Schwermetalle, Pestizide, Hormone, Antibiotika etc.)
- Optimale Zubereitung der Mahlzeiten mit Schwerpunkt auf Erhalt der Vitalstoffe
- Optimales Zeitmanagement der Mahlzeiten über den Tag verteilt
- Eine der Hauptursachen für eine verminderte Leistungsfähigkeit aller Organe ist eine Fehlverdauung (= Dyspepsie = Fehlverdauung) [8].
100% Ernährung (Nahrung x Verdauung) = 0 % Silent Intoxication
Eine gute „Verdauung“ bedeutet, dass die Nahrung langsam und in einem entspannten Zustand gegessen wird. Übereilt gegessene Nahrung führt zu einer unvollständigen Verdauung und zu ungünstigen Folgen für die Performance [7].
Silent Intoxication
Vor der „stillen Entzündung“ kommt in der Regel zur „Silent Intoxication“. Viele Ernährungsempfehlungen raten zu mehr Eiweiß und reduzierten Kohlenhydraten. Große Mengen an Eiweiß können jedoch nur verdaut werden, wenn genügend Verdauungsenzyme zur Verfügung stehen. Es ist bekannt, dass Fäulnis und Fäulnisprozesse im Darm durch eine unvollständige Verdauung von Proteinen verursacht werden. Schon kleinste Mängel an Enzymen führen zu einer unvollständigen Verdauung. Die häufigste Ursache für solche Enzymdefizite ist der Mangel an Speichel in der geschluckten Nahrung. Der orale Speichel enthält sowohl relevante Mengen an Proteasen wie auch Mucin (Schleim). Wird Eiweiß im Mund nicht optimal gekaut und eingespeichelt sowie von der Magensäure nicht ausreichend verdaut (Anm.: Protonenpumpenhemmer, PPI), kommt es zu einem unvollständigen enzymatischen Abbau der Proteine in Aminosäuren. Die Anzahl der verfügbaren und produzierten Proteasen und Peptidasen reicht möglicherweise nicht aus, um 100 % aller anflutenden Proteine zu spalten. Die meisten der unverdauten Restproteine oder Peptide werden dann nicht resorbiert, sondern von proteolytischen Bakterien (Proteobakterien, H2S-Bildner, bestimmte Clostridien etc.) im Darm zersetzt [10]. Dies führt zu Metaboliten, die zytotoxische Eigenschaften haben [11]. Der bekannteste und am besten erforschte Schlüsselakteur ist Ammoniak.
Ammoniak induziert mitochondriale Dysfunktion
Der erste Nachweis der bakteriellen Bildung von Ammoniak und anderen Fäulnis- und Verwesungs-Toxinen im Darm liegt etwa 90 Jahre zurück [12]. Es hat sich gezeigt, dass diese körpereigenen Toxine (insbesondere Fäulnistoxine) die Mitochondrien in allen Zellen des Körpers schädigen [13]. Unsere Nervenzellen reagieren besonders empfindlich darauf, da sie etwa 10-mal mehr Mitochondrien pro Zelle haben als die meisten anderen Zellen im Körper. Aktuelle Studien zeigen den Zusammenhang zwischen Ammoniak aus dem Darm und einer Enzephalopathie (Hirnerkrankung), die sich zunächst meist im Sinne einer allgemeinen Erschöpfung äußert [13]. Mit zunehmender Intoxikation kommt es zur Verminderung (Degeneration) aller Funktionen des zentralen Nervensystems (ZNS): Burnout, M. Parkinson, Vergesslichkeit, Gedächtnisverlust bis hin zur Demenz, Stimmungsschwankungen bis hin zu Depressionen etc. [14 – 16]. Endprodukte der Darmfäulnis sind: Ammoniak, Skatol, p-Kresol-Sulfat, TMA/TMAO, Hexa-LPS, Indoxylsulfat, Phenole, Cadaverin u. w. Die meisten dieser Stoffe sind dosisabhängig toxisch und krebserregend [17]. Das Milieu im Darmlumen (Dünn- und Dickdarm) bestimmt, ob die Bakterien entweder toxische oder schützende Metabolite produzieren [18]. In diesem Zusammenhang ist die „hepatische Enzephalopathie“ wissenschaftlich am besten erforscht. Ammoniak spielt die Hauptrolle bei der Pathogenese [12, 19].
TMA/TMAO
Eine weitere Gruppe von Substanzen wurde in den letzten Jahren zunehmend erforscht: TMA/TMAO (Trimethylamin / Trimethylamin-N-oxid). TMA ist die Substanz, die verrottendem Fisch seinen typischen Geruch verleiht. Neuere Forschungen konzentrieren sich auf das von TMA/TMAO verursachte kardiovaskuläre Risiko [20]. Wie Ammoniak ist TMAO ein Fäulnis-Toxin, das im Darm von proteolytischen Bakterien produziert wird. Dieses Toxin reduziert ebenfalls die Mitochondrienfunktion [20 – 22].
Der pH-Wert im Stuhl als entscheidender Regulator
Im Rahmen der Alzheimer-Forschung wurde festgestellt, dass bestimmte Gallensäuren im Darm produziert werden und nach der Resorption das Gehirn schädigen [15, 23]. Insbesondere Ursodeoxycholsäure (UDCA), „protective sekundäre Gallensäuren (Bas), wie iso-3-Oxo-, Allo-, 3-Oxoallo- und Isoallo-Lithocholsäure (LCA)“ gelten als Schutz vor Silent Inflammation [24]. Zytotoxische Gallensäuren (z. B. Desoxycholsäure, DCA) werden produziert, wenn der pH-Wert des Stuhls über 6,5 steigt. Die Enzyme, die darüber entscheiden, ob neuroprotektive oder zytotoxische Gallensäuren produziert werden, sind (wie fast alle Enzyme) pH-abhängig. Je höher der pH-Wert im Stuhl ist, desto mehr zytotoxische und desto weniger neuroprotektive Gallensäuren werden produziert. Die Relevanz dieser Befunde wurde kürzlich in einer Nature-Veröffentlichung von Sato et al. vom 29.07.2021 zur Mikrobiomforschung an Hundertjährigen untersucht und bestätigt [24]. Andere toxische Metabolite aus dem Darm sind: Chinolinsäure (aus Tryptophan), Hippursäure, HPHPA (3-(3-Hydroxyphenyl)-3-hydroxypropionsäure), Indoxylsulfat, p-Kresolsulfat, Phenylacetyllglutamin, Tryptamin (abhängig von der produzierten Menge) u. w. Diese sind in der täglichen Praxis mit bisher unerreichter Präzision in Speziallaboren wie BIOVIS messbar geworden. Nur Ammoniak ist so instabil, dass es auf dem Weg ins Labor zerfällt und im Stuhl nicht nachweisbar ist.
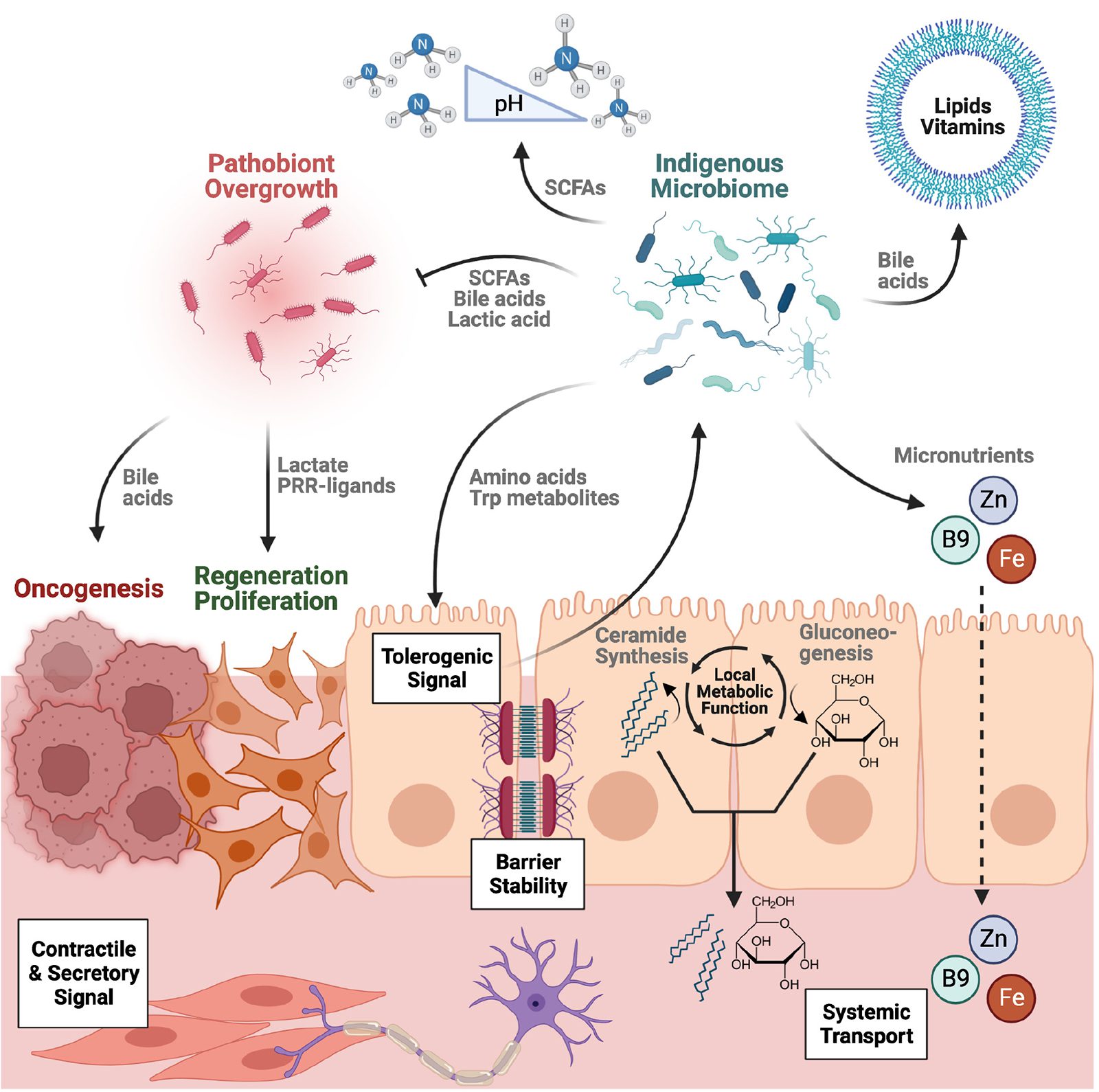
Foto: © EMBO Reports 2022, Vol 23 (10) Fig. 1
Säuerungsflora schützt vor Fäulnisgiften
Ilja Iljitsch Metschnikow beschrieb Anfang des 20. Jahrhunderts Lactobacillus bulgaricus und fand einen Zusammenhang zur Langlebigkeit bzw. der Gesundheitsspanne. Die Milchsäure der Säuerungsflora wurde zum Anti-Aging-Mittel. Actinobakterien und Proteobakterien konkurrieren im Darm um Nahrung. Sie versuchen, sich gegenseitig zu vergiften. Actinobakterien (gesunde Säuerungsflora) bilden z. B. Laktat und Butyrat, um über ein saures Milieu zu verhindern, dass Proteobakterien wachsen. Letztere brauchen es basisch. Umgekehrt produzieren Proteobakterien in einem basischen Milieu Fäulnisgifte, die als Hemmstoffe für die Säuerungsflora wirken [25, 26]. Actinobakterien verstoffwechseln vor allem Kohlenhydrate, Einfachzucker, Oligosaccharide, Stärke, aber auch Pektine, Glucane und Fruktane – also präbiotische Ballaststoffe aus Gemüse, Kräutern und Getreide.
Wenn man die Anzahl der Actinobakterien und ihre Stoffwechselaktivität erhöhen möchte, sollte man auf insulinogene Zucker verzichten und präbiotische Ballaststoffe hinzufügen, um das saure Milieu im Darm zu fördern. Die Säuerungsflora kann auch durch milieustabilisierende Probiotika günstig beeinflusst werden.
Starke energiebildende und entzündungshemmende Eigenschaften wurden insbesondere für das Faecalibacterium Prausnitzii und das Butyrat nachgewiesen.
- Buttersäure kann vor chronisch entzündlichen Darmerkrankungen (CED) und Darmkrebs schützen.
- Patienten mit Morbus Crohn haben auch einen Mangel an Faecalibacterium prausnitzii, einem Butyrat-bildenden Bakterium, das Substanzen absondert, die entzündungshemmende Wirkungen auf Darmzellen haben, indem es die NF-κB-Aktivierung und die IL-8-Produktion blockiert [27].
Slow Transit – Verstopfung & Bewegung und Darmflora
Die meisten Menschen mit der so genannten westlichen Lebensweise zeigen aufgrund des gravierenden Mangels an Ballaststoffen eine „slow transit constipation“. Sie haben nur noch wenige Stuhlgänge pro Woche, feste Konsistenz und einem Stuhl-pH-Wert von 7 bis 9 oder sogar noch höher. Weil diese Fäulnis die Mitochondrien der Darmwand schwächt, beschrieb F.X. Mayr vor etwa 100 Jahren den „schwachen Dünndarm“ zu Recht als ein weit unterschätztes Problem der Menschheit. Nicht nur die mechanische Unterstützung der Peristaltik im Darm, also ebenso der Darmpassage des Stuhls durch körperliche Bewegung wurde in vielen Arbeiten gezeigt, sondern auch der direkte Einfluss der Myokine, der Durchblutung wie auch der Resorptionskapazität der Enterozyten nachgewiesen [28].
Fazit
Für das häusliche Umfeld, wenn die Rücksprache mit einem spezialisierten Arzt nicht möglich ist, hat der Autor einen Leitfaden für Patienten zur schnellen und gründlichen Korrektur der Fäulnisdyspepsie mit Schonkost und Darmreinigung entwickelt, die Upgraders® Methode (www.upgraders.com/de)
- Die Beseitigung und anschließende Vermeidung von Verdauungsstörungen und Darmfehlbesiedelung ist das Hauptaugenmerk dieser Methode.
- Eine optimale sportliche Performance mit dauerhaft stabilem Gesundheitszustand des Darms und damit des gesamten Organismus kann nur mit optimaler Unterstützung der Säuerungsflora (pH 6,0 im Stuhl) erreicht werden.
- Die bestmögliche Förderung der Säuerungsflora erfordert den Verzehr größerer Mengen von resistenter Stärke, quellenden Ballaststoffen und fermentierten Lebensmitteln in individuell angepasster Dosierung und Vielfalt.
- Für Trainer und Therapeuten kann die UPGRADERS Schritt-für-Schritt-Anleitung eine Hilfe zur Information der Clienten/Patienten sein.
————————————–
The Toxin Factor
Das in Englisch kürzlich erschienene Buch „The Toxin Factor“
(Loorents / Sartor / Preyer) erscheint in Deutsch im Mai / Juni 2024.
————————————–
Anmerkung der Redaktion
Signale aus dem Darm an das Gehirn steigern die Motivation zur Bewegung “A microbiome-dependent gut–brain pathway regulates motivation for exercise” Dohnalova et al.: Nature volume 612, pages 739–747 (2022) www.nature.com/articles/s41586-022-05525-z
Literatur
- Claude Bernard, founder of modern Physiology, 1813-1878, cited in „Leçon sur les auto-intoxications dans les maladies“ by Charles Bouchard 1885
- The Prolongation of Life. Nature 77, 289–290 (1908). https://doi.org/10.1038/077289b0
- Spivak I, Fluhr L, Elinav E. Local and systemic effects of microbiome-derived metabolites. EMBO Rep. 2022 Oct 6;23(10):e55664. doi: 10.15252/embr.202255664. Epub 2022 Aug 29. PMID: 36031866; PMCID: PMC9535759.
- Sagar NA, Tarafdar S, Agarwal S, Tarafdar A, Sharma S. Polyamines: Functions, Metabolism, and Role in Human Disease Management. Med Sci (Basel). 2021 Jun 9;9(2):44. doi: 10.3390/medsci9020044. PMID: 34207607; PMCID: PMC8293435.
- Nagpal R, Mainali R, Ahmadi S, Wang S, Singh R, Kavanagh K, Kitzman DW, Kushugulova A, Marotta F, Yadav H. Gut microbiome and aging: Physiological and mechanistic insights. Nutr Healthy Aging. 2018 Jun 15;4(4):267-285. doi: 10.3233/NHA-170030. PMID: 29951588; PMCID: PMC6004897.
- Hughes RL, Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021 Dec 1;12(6):2190-2215. doi: 10.1093/advances/nmab077. PMID: 34229348; PMCID: PMC8634498.
- Itoh et al., Peak blood ammonia and lactate after submaximal, maximal and
supramaximal exercise in sprinters and long-distance runners.
Eur J Appl Physiol Occup Physiol. 1990;60(4):271-6. - Mutch et al., Ammonia metabolism in exercise and fatigue: a review., Med Sci Sports Exerc. 1983;15(1):41-50.
- Simons CC, Schouten LJ, Weijenberg MP, Goldbohm RA, van den Brandt PA. Bowel movement and constipation frequencies and the risk of colorectal cancer among men in the Netherlands Cohort Study on Diet and Cancer. Am J Epidemiol. 2010 Dec 15;172(12):1404-14. doi: 10.1093/aje/kwq307. Epub 2010 Oct 27. PMID: 20980354.
- Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808. doi: 10.2174/1389203718666170216153505. PMID: 28215168.
- Zhou ZL, Jia XB, Sun MF, et al. Neuroprotection of Fasting Mimicking Diet on MPTP-Induced Parkinson’s Disease Mice via Gut Microbiota and Metabolites. Neurotherapeutics. 2019;16(3):741-760. doi:10.1007/s13311-019-00719-2
- Hayaishi O. My life with tryptophan–never a dull moment. Protein Sci. 1993 Mar;2(3):472-5. doi: 10.1002/pro.5560020320. PMID: 8453383; PMCID: PMC2142392.
- Ninan J, Feldman L. Ammonia Levels and Hepatic Encephalopathy in Patients with Known Chronic Liver Disease. J Hosp Med. 2017 Aug;12(8):659-661. doi: 10.12788/jhm.2794. PMID: 28786433.
- Niknahad H, Jamshidzadeh A, Heidari R, Zarei M, Ommati MM. Ammonia-induced mitochondrial dysfunction and energy metabolism disturbances in isolated brain and liver mitochondria, and the effect of taurine administration: relevance to hepatic encephalopathy treatment. Clin Exp Hepatol. 2017;3(3):141-151. doi:10.5114/ceh.2017.68833
- Bobermin LD, Souza DO, Gonçalves CA, Quincozes-Santos A. Resveratrol prevents ammonia-induced mitochondrial dysfunction and cellular redox imbalance in C6 astroglial cells. Nutr Neurosci. 2018 May;21(4):276-285. doi: 10.1080/1028415X.2017.1284375. Epub 2017 Feb 6. PMID: 28165879.
- MahmoudianDehkordi S, Arnold M, Nho K, Ahmad S, Jia W, Xie G, Louie G, Kueider-Paisley A, Moseley MA, Thompson JW, St John Williams L, Tenenbaum JD, Blach C, Baillie R, Han X, Bhattacharyya S, Toledo JB, Schafferer S, Klein S, Koal T, Risacher SL, Kling MA, Motsinger-Reif A, Rotroff DM, Jack J, Hankemeier T, Bennett DA, De Jager PL, Trojanowski JQ, Shaw LM, Weiner MW, Doraiswamy PM, van Duijn CM, Saykin AJ, Kastenmüller G, Kaddurah-Daouk R; Alzheimer’s Disease Neuroimaging Initiative and the Alzheimer Disease Metabolomics Consortium. Altered bile acid profile associates with cognitive impairment in Alzheimer’s disease-An emerging role for gut microbiome. Alzheimers Dement. 2019 Jan;15(1):76-92. doi: 10.1016/j.jalz.2018.07.217. Epub 2018 Oct 15. Erratum in: Alzheimers Dement. 2019 Apr;15(4):604. PMID: 30337151; PMCID: PMC6487485.
- Itoh et al., Peak blood ammonia and lactate after submaximal, maximal and
supramaximal exercise in sprinters and long-distance runners.
Eur J Appl Physiol Occup Physiol. 1990;60(4):271-6. - Büngeler, W.: Die experimentelle Erzeugung von Leukämie und Lymphosarkom durch chronische Indol Vergiftung der Maus. Frankfurt. Z. Path. 44 (1933), 202
- Li X, Zhang B, Hu Y, Zhao Y. New Insights Into Gut-Bacteria-Derived Indole and Its Derivatives in Intestinal and Liver Diseases. Front Pharmacol. 2021 Dec 13;12:769501. doi: 10.3389/fphar.2021.769501. PMID: 34966278; PMCID: PMC8710772.
- González-Regueiro JA, Higuera-de la Tijera MF, Moreno-Alcántar R, Torre A. Pathophysiology of hepatic encephalopathy and future treatment options. Rev Gastroenterol Mex. 2019 Apr-Jun;84(2):195-203. English, Spanish. doi: 10.1016/j.rgmx.2019.02.004. Epub 2019 Apr 20. PMID: 31014748.
- Senthong V et al. Trimethylamine N-Oxide and Mortality Risk in Patients With Peripheral Artery Disease. J Am Heart Assoc. 2016; 5:e004237
- https://www.biovis-diagnostik.eu/wp-content/uploads/biovis-TMAO-DE.pdf
- Makrecka-Kuka M, Volska K, Antone U, Vilskersts R, Grinberga S, Bandere D, Liepinsh E, Dambrova M. Trimethylamine N-oxide impairs pyruvate and fatty acid oxidation in cardiac mitochondria. Toxicol Lett. 2017 Feb 5;267:32-38. doi: 10.1016/j.toxlet.2016.12.017. Epub 2016 Dec 31. PMID: 28049038.
- Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association 2019 15, 76-92DOI: (10.1016/j.jalz.2018.07.217)
- Sato, Y., Atarashi, K., Plichta, D.R. et al. Novel bile acid biosynthetic pathways are enriched in the microbiome of centenarians. Nature (2021 July 29th). https://doi.org/10.1038/s41586-021-03832-5
- Lamichhane S, Sen P, Dickens AM, Orešič M, Bertram HC. Gut metabolome meets microbiome: A methodological perspective to understand the relationship between host and microbe. Methods. 2018 Oct 1;149:3-12. doi: 10.1016/j.ymeth.2018.04.029. Epub 2018 Apr 30.
PMID: 29715508. - Binienda A, Twardowska A, Makaro A, Salaga M. Dietary Carbohydrates and Lipids in the Pathogenesis of Leaky Gut Syndrome: An Overview. Int J Mol Sci. 2020 Nov 8;21(21):8368. doi: 10.3390/ijms21218368. PMID: 33171587; PMCID: PMC7664638.
- Min L, Ablitip A, Wang R, Luciana T, Wei M, Ma X. Effects of Exercise on Gut Microbiota of Adults: A Systematic Review and Meta-Analysis. Nutrients. 2024 Apr 5;16(7):1070. doi: 10.3390/nu16071070. PMID: 38613103; PMCID: PMC11013040.
Autoren
ist Facharzt für Anästhesie und Facharzt für Allgemeinmedizin. Er ist Dozent in der Lanserhof-Akademie, im Institut für Salutologie, Wien und an der BIOVIS-Akademie.