Autoren: Christine Meyer, Aranka Brockmüller und Mehdi Shakibaei
Osteoporose stellt nach wie vor eine zentrale Herausforderung in der klinischen Medizin dar, die ohne frühzeitige Prophylaxe und adäquate Therapie mit erheblichen, langfristigen Einschränkungen der Lebensqualität für die Betroffenen verbunden ist. Insbesondere im fortgeschrittenen Stadium der Erkrankung, wenn bereits osteoporotische Frakturen aufgetreten sind, ist die aktive Förderung der intrinsischen Regeneration der extrazellulären Knochenmatrix (ECM) ein wesentlicher Faktor, um die Knochenheilung zu fördern und Folgefrakturen sowie muskuloskelettale Schmerzen zu vermeiden.
Monotargetale Osteoporose-Medikationen wie monoklonale Antikörper gegen receptor activator of NF-κB ligand (RANKL) hemmen zwar bedingt den weiteren Knochenabbau, stimulieren die Expression von osteogenen Transkriptionsfaktoren wie Runt-related transcription factor (Runx) jedoch nicht adäquat. Neue integrative Therapieansätze, die das physiologische Gleichgewicht des Knochenumbaus multimodal in der Langzeittherapie unterstützen, sind somit von enormem Bedarf. Besonders die chronischen Entzündungen, die bei Osteoporosepatienten zu beobachten sind, werden durch aktuelle, evidenz-basierte klinische Daten wesentlich auf Missverhältnisse im Darm zurückgeführt, woraus sich mit der gezielten Modulation des Darmmikrobioms ein moderner therapeutischer Ansatz ableitet. Nach neuesten wissenschaftlichen Erkenntnissen bietet eine prophylaktisch polyphenolreiche Ernährung erhebliche epigenetische Gesundheitsvorteile für das menschliche Darmmikrobiom. Eine Supplementierung mit Resveratrol repräsentiert einen vielversprechenden therapeutischen Weg, um das dynamische Ökosystem zu stabilisieren, die Symptome der Osteoporose zu lindern und das Fortschreiten der Erkrankung zu verlangsamen.
Darmmikrobiom
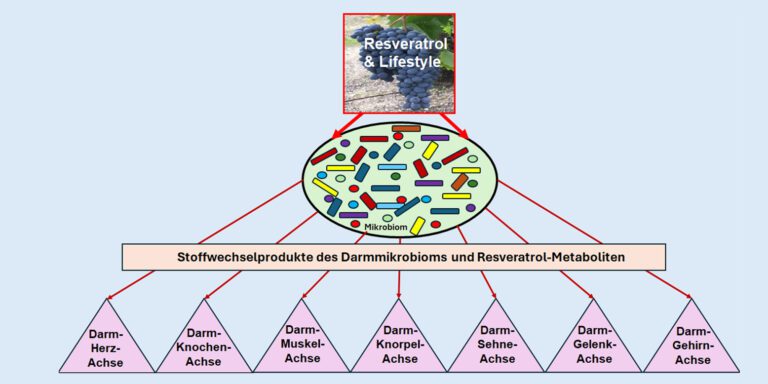
Das Darmmikrobiom besteht aus mehr als 100 Milliarden Mikroben mit mehr als 35000 Bakterien, von denen bisher nur ein Bruchteil bekannt ist [1]. Physiologisch befindet sich das Darmmikrobiom in einem empfindlichen Ökosystem mit dem Gesamtorganismus in Form einer natürlichen Symbiose [1, 2]. Nützliche Bakterienarten wie beispielsweise Bifidobakterien fermentieren bei ausreichender oraler Zufuhr von Ballaststoffen kurzkettige Fettsäuren (SCFA) wie Butyrat, die als Energielieferanten für die hoch stoffwechselaktiven Darmepithelzellen fungieren und somit essenziell für eine intakte Regeneration der Darmschleimhaut sind [3]. SCFA können außerdem die Regeneration zahlreicher Körperorgane und auch des Knochengewebes fördern, indem sie auf epigenetischer Ebene über die Modulation des zentralen Transkriptionsfaktors nuclear factor-kappa B (NF-κB) Entzündungsprozesse verringern und gleichzeitig regenerativ die Expression von weiteren Transkriptionsfaktoren wie Runx fördern [3, 4]. Diese Interaktion zwischen Darmmikrobiom-Metaboliten und Geweben sowie zahlreichen Organen führt zu verschiedenen Achsen wie der Darm-Knochen-Achse [4] oder der bisher am meisten erforschten Darm-Gehirn-Achse [5] (Abbildung 1). Dysbiotische Verhältnisse können daher über veränderte Darmmikrobiom-Metaboliten, einschließlich der Abnahme von SCFA und der Zunahme von pro-inflammatorischen Metaboliten wie Trimethylamin-N-oxid (TMAO) und Lipopolysaccharide (LPS), auf Gewebe und Organe auf epigenetischer Ebene wesentlich zur Entstehung sowie Aufrechterhaltung chronisch-entzündlicher Prozesse beitragen, was sich in einer Vielzahl von Erkrankungen [6], einschließlich Osteoporose [4], widerspiegelt.
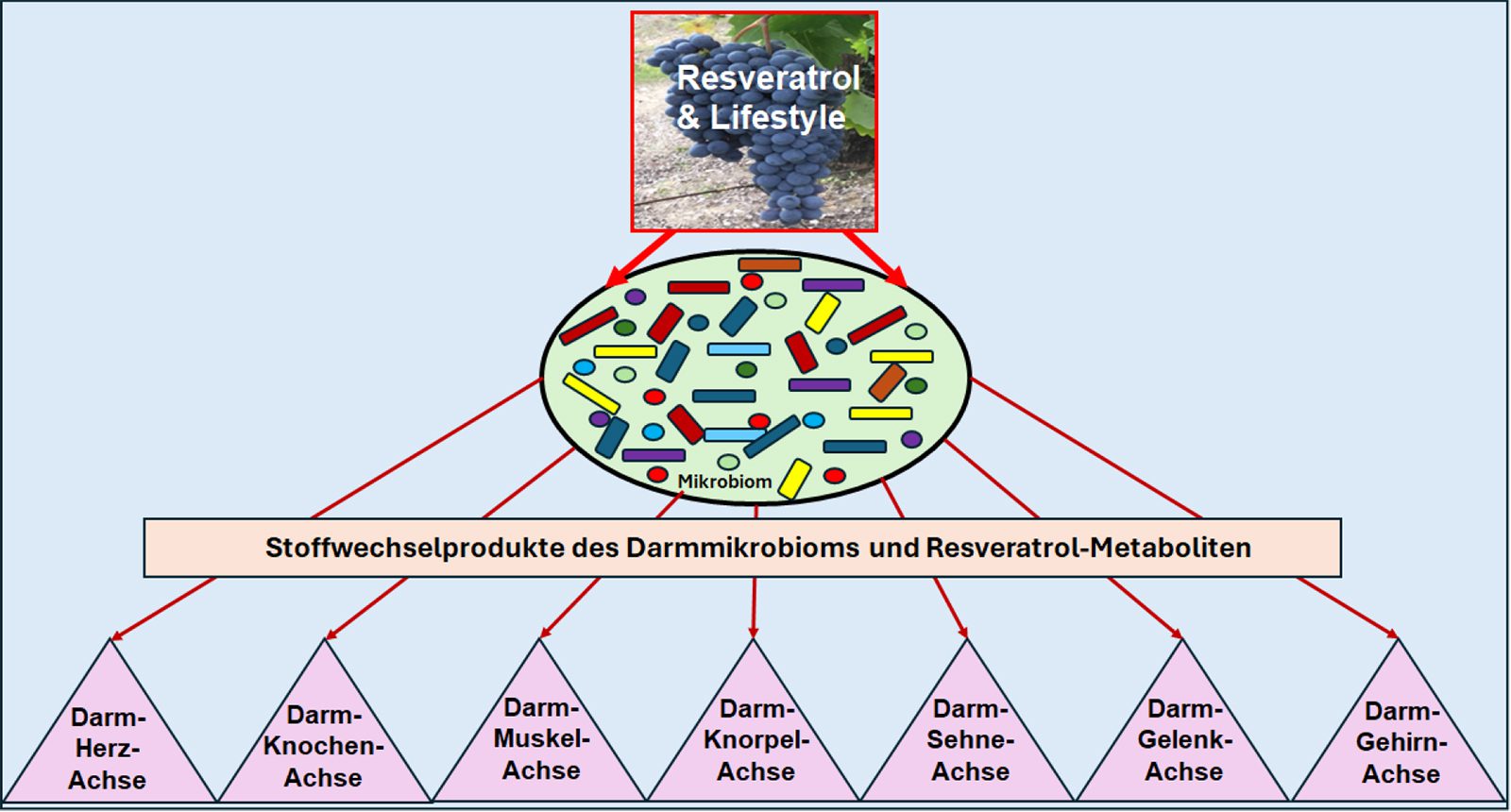
Klinisch wurde eine Korrelation zwischen der Zusammensetzung des humanen Darmmikrobioms und Biomarkern im Blut gefunden, die im Zusammenhang mit verschiedenen Lebensstilfaktoren stand, wobei spezifische Muster entweder eine physiologische oder pathologische Zusammensetzung des Darmmikrobioms (Dysbiose) förderten [7]. Studienergebnisse zeigten, dass eine westliche Ernährungsweise [8] einschließlich dem Konsum von hochverarbeiteten Lebensmitteln [9] und künstlichen Süßstoffen [10], entgegen einer polyphenolreichen mediterranen Ernährungsweise, zu einer Verarmung des Mikrobioms und Dysbiose führen [11]. Zudem wurde ein Mangel an Vitamin D [12] sowie reproduktiven Hormonen einschließlich Östrogenmangel [13] mit der Entwicklung einer Dysbiose in Verbindung gebracht. Interessanterweise können auch eine Vielzahl von Medikamenten wie Antibiotika [14], Analgetika wie nichtsteroidale Antirheumatika (NSAR) [15] und Opioide [16], Protonenpumpenhemmer [17], Antidepressiva [18] und Laxanzien [19] bei regelmäßiger Einnahme ein solches Ungleichgewicht induzieren.
Klinische Evidenzen belegen, dass eine Probiotika-Einnahmen mit bestimmten Laktobacillen [20] und Bifidobakterien [21] die Knochendichte bei postmenopausalen Frauen positiv beeinflussten. Diese Ergebnisse konnten außerdem ein erhöhtes Vitamin D3 Level sowie eine gesteigerte Osteoblasten-Aktivität nachweisen [21]. Ebenso korrelierte eine einjährige Einnahme von Lactobacillus reuteri mit reduzierten Entzündungsparametern [22]. Insgesamt bestätigte sich somit eine gezielte Modulation der Darm-Knochen-Achse als therapeutischer Ansatz bei Osteoporose.
Das zunehmende Verständnis der natürlichen Förderung dieser Bakterien-Arten ist darüber hinaus von essentieller Bedeutung, da bisher keine Daten über mögliche Langzeitfolgen des Konsums industriell hergestellter Probiotika in Kapselform über einen Zeitraum von mehreren Jahrzehnten vorliegen [23] und eine nachhaltige Modulation durch alltägliche Lebensstilgewohnheiten daher naheliegend ist. Es erscheint unerlässlich, die beeinflussbaren Faktoren für die Förderung und Aufrechterhaltung eines physiologischen Darmmikrobioms zu kennen und sowohl für die Prophylaxe als auch für die Co-Therapie der Osteoporose aktiv zu nutzen. Ein Kernpunkt stellt hierbei die tägliche Ernährung dar, wobei Forschungsergebnisse bestätigen, dass sowohl der Zeitraum der Nahrungsaufnahme [24] als auch die Zusammensetzung selbst einen entscheidenden Einflussfaktor darstellen [25]. Insbesondere eine polyphenolreiche Ernährung erscheint in diesem Zusammenhang relevant, da natürliche Polyphenole von bestimmten Darmbakterien metabolisiert werden und präbiotische Effekte [26] zeigen, die auf epigenetischer Ebene nachgewiesen werden konnten [27, 28].
Resveratrol
Das natürlich vorkommende Polyphenol Resveratrol ist aufgrund seiner multifunktionalen Wirkungsweise, die maßgeblich auf der epigenetischen Modulation von NF-κB beruht, insbesondere im Forschungsbereich der Anti-Aging-Medizin international wissenschaftlich anerkannt [29, 30]. Als Limitation für die klinische Anwendung wird häufig die geringe Bioverfügbarkeit von weniger als 1% des Moleküls angeführt [31]. In klinischen Studien konnte jedoch nachgewiesen werden, dass sowohl die Supplementierung mit Resveratrol als auch der Verzehr von natürlichen Lebensmitteln, die bekanntermaßen Resveratrol enthalten, mit einer signifikanten Modulation des Darmmikrobioms korreliert, die mit reduzierten Entzündungsparametern [32] und verbesserten kardiovaskulären Parametern [33] assoziiert ist. In diesem Zusammenhang wurde eine Zunahme von SCFA-produzierenden Bakterien beobachtet [33]. Interessanterweise kommen in natürlichen Lebensmitteln wie rotem Traubensaft, rotem Wein und Kakaopulver Vorstufen von Resveratrol wie Piceid zwei- bis dreimal häufiger vor als Resveratrol [34, 35]. Entscheidend für ihre Wirkung scheint ihre Metabolisierung durch Darmbakterien zu sein, da für Piceid, im Gegensatz zu Resveratrol, keine messbaren anti-inflammatorischen Effekte nachgewiesen werden konnten [35], was die Bedeutung und den Synergismus einer intakten Darm-Polyphenol-Achse unterstützt. Ergebnisse haben zudem gezeigt, dass die Metabolisierung von Resveratrol durch bestimmte Darmbakterien zu zahlreichen Resveratrol-Metaboliten wie Lunularin oder Dihydroresveratrol führt, die wesentlich zur Wirkung von Resveratrol beitragen [36]. Interessanterweise scheint es beim Menschen unterschiedliche Metabolisierungstypen zu geben, sodass einige die Fähigkeit besitzen, Resveratrol in Lunularin umzuwandeln, während dies bei anderen nicht der Fall ist [37]. Hinweise auf eine modulierende Wirkung von Resveratrol-Metaboliten auf das Knochengewebe konnten präklinisch bisher für Piceatannol gezeigt werden, welches über die Stimulation von knochenmorphogenetischem Protein (BMP2) mit einer gesteigerten Osteogenese in Verbindung gebracht wurde [38].
Die Tatsache, dass sowohl Resveratrol als auch seine Metaboliten epigenetisch regenerativ wirken, unterstützt im Darm eine intakte Aufnahme von Makro- und Mikronährstoffen sowie eine Stärkung der Darmbarriere über die Stimulation der Expression von Tight-Junction-Proteinen [33, 39]. Insbesondere für Patienten mit sekundärer Osteoporose als Folge von entzündlichen Darmerkrankungen und damit verbundenen Nahrungsmittelunverträglichkeiten ergibt sich hieraus ein erheblicher therapeutischer Zusatznutzen [40]. Aber auch bei Patienten mit primärer Osteoporose kann dies im Rahmen einer Basistherapie mit Vitamin D- und Kalzium-Supplementierung von Vorteil sein [41, 42]. Gleichzeitig reguliert Resveratrol nachgewiesenermaßen pro-inflammatorische Mediatoren einschließlich Tumornekrosefaktoren und Interleukinen über die Modulation des NF-κB-Weges [43, 44]. Zudem ist anerkannt, dass Resveratrol über die Sirtuin1/Runx2-Achse epigenetisch die osteogene Differenzierung mesenchymaler Stammzellen stimuliert [45]. Erfreulicherweise bestätigen Langzeitstudien eine gute Verträglichkeit des Naturstoffes Resveratrol [46].
Fazit
Die intestinale Dysbiose kann ein möglicher Frühindikator für eine beginnende Osteoporose sein. Zur Modulation und Aufrechterhaltung eines physiologischen Darmmikrobioms ist bei Osteoporosepatienten eine polyphenolreiche Ernährung inklusive Resveratrol im Rahmen eines integrativen Gesamttherapiekonzeptes unter Einbeziehung der Anpassung von weiteren Lebensstilfaktoren wie regelmäßiger Bewegung, Regeneration und Stressreduktion anzustreben.
Abkürzungen
BMP2 – Bone morphogenic protein
ECM – extrazelluläre Knochenmatrix
LPS – Lipopolysaccharide
NF-κB – nuclear factor-kappa B
NSAR – nichtsteroidale Antirheumatika
RANKL – receptor activator of NF-κB ligand
Runx – Runt-related transcription factor
SCFA – kurzkettige Fettsäuren
TMAO – Trimethylamin-N-oxid
Zum Vertiefen:
Microbiota and Resveratrol: How Are They Linked to Osteoporosis?
Christine Meyer, Aranka Brockmueller, Vicenç Ruiz de Porras, Mehdi Shakibaei
Referenzen
- Rinninella, E., et al., What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms, 2019. 7(1).
- Goyal, A., et al., Ecology-guided prediction of cross-feeding interactions in the human gut microbiome. Nature Communications, 2021. 12(1): p. 1335.
- Martin-Gallausiaux, C., et al., SCFA: mechanisms and functional importance in the gut. Proceedings of the Nutrition Society, 2021. 80(1): p. 37-49.
- Jeyaraman, M., A. Nallakumarasamy, and V.K. Jain, Gut Microbiome – Should we treat the gut and not the bones? J Clin Orthop Trauma, 2023. 39: p. 102149.
- Agirman, G., K.B. Yu, and E.Y. Hsiao, Signaling inflammation across the gut-brain axis. Science, 2021. 374(6571): p. 1087-1092.
- Ruigrok, R.A.A.A., R.K. Weersma, and A. Vich Vila, The emerging role of the small intestinal microbiota in human health and disease. Gut Microbes, 2023. 15(1): p. 2201155.
- Manor, O., et al., Health and disease markers correlate with gut microbiome composition across thousands of people. Nature communications, 2020. 11(1): p. 5206.
- Vangay, P., et al., US immigration westernizes the human gut microbiome. Cell, 2018. 175(4): p. 962-972. e10.
- Song, Z., et al., Effects of ultra-processed foods on the microbiota-gut-brain axis: The bread-and-butter issue. Food Research International, 2023: p. 112730.
- Suez, J., et al., Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 2014. 514(7521): p. 181-186.
- Zhang, Y.-W., et al., Diets intervene osteoporosis via gut-bone axis. Gut Microbes, 2024. 16(1): p. 2295432.
- Singh, P., et al., The potential role of vitamin D supplementation as a gut microbiota modifier in healthy individuals. Scientific Reports, 2020. 10(1): p. 21641.
- Guan, Z., et al., Estrogen deficiency induces bone loss through the gut microbiota. Pharmacological Research, 2023. 196: p. 106930.
- Palleja, A., et al., Recovery of gut microbiota of healthy adults following antibiotic exposure. Nature Microbiology, 2018. 3(11): p. 1255-1265.
- Rogers, M.A. and D.M. Aronoff, The influence of non-steroidal anti-inflammatory drugs on the gut microbiome. Clinical Microbiology and Infection, 2016. 22(2): p. 178. e1-178. e9.
- Banerjee, S., et al., Opioid-induced gut microbial disruption and bile dysregulation leads to gut barrier compromise and sustained systemic inflammation. Mucosal immunology, 2016. 9(6): p. 1418-1428.
- Weersma, R.K., A. Zhernakova, and J. Fu, Interaction between drugs and the gut microbiome. Gut, 2020. 69(8): p. 1510-1519.
- Zhang, W., et al., Antidepressants fluoxetine and amitriptyline induce alterations in intestinal microbiota and gut microbiome function in rats exposed to chronic unpredictable mild stress. Translational psychiatry, 2021. 11(1): p. 131.
- Drago, L., C. Valentina, and P. Fabio, Gut microbiota, dysbiosis and colon lavage. Digestive and Liver Disease, 2019. 51(9): p. 1209-1213.
- Jansson, P.A., et al., Probiotic treatment using a mix of three Lactobacillus strains for lumbar spine bone loss in postmenopausal women: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet Rheumatol, 2019. 1(3): p. e154-e162.
- Zhao, F., et al., Bifidobacterium lactis Probio-M8 improves bone metabolism in patients with postmenopausal osteoporosis, possibly by modulating the gut microbiota. Eur J Nutr, 2023. 62(2): p. 965-976.
- Li, P., et al., One-year supplementation with Lactobacillus reuteri ATCC PTA 6475 counteracts a degradation of gut microbiota in older women with low bone mineral density. NPJ Biofilms Microbiomes, 2022. 8(1): p. 84.
- Suez, J., et al., The pros, cons, and many unknowns of probiotics. Nature medicine, 2019. 25(5): p. 716-729.
- Xie, S., et al., Intermittent fasting promotes repair of rotator cuff injury in the early postoperative period by regulating the gut microbiota. Journal of Orthopaedic Translation, 2022. 36: p. 216-224.
- David, L.A., et al., Diet rapidly and reproducibly alters the human gut microbiome. Nature, 2014. 505(7484): p. 559-563.
- Brito Sampaio, K., et al., Nutraceutical formulations combining Limosilactobacillus fermentum, quercetin, and or resveratrol with beneficial impacts on the abundance of intestinal bacterial populations, metabolite production, and antioxidant capacity during colonic fermentation. Food Research International, 2022. 161: p. 111800.
- Arcanjo, N.O., et al., Resveratrol protects Lactobacillus reuteri against H2O2- induced oxidative stress and stimulates antioxidant defenses through upregulation of the dhaT gene. Free Radical Biology and Medicine, 2019. 135: p. 38-45.
- Chen, M.L., et al., Resveratrol Attenuates Trimethylamine-N-Oxide (TMAO)-Induced Atherosclerosis by Regulating TMAO Synthesis and Bile Acid Metabolism via Remodeling of the Gut Microbiota. mBio, 2016. 7(2): p. e02210-15.
- Hubbard, B.P. and D.A. Sinclair, Small molecule SIRT1 activators for the treatment of aging and age-related diseases. Trends in pharmacological sciences, 2014. 35(3): p. 146-154.
- Baur, J.A. and D.A. Sinclair, Therapeutic potential of resveratrol: the in vivo evidence. Nature reviews Drug discovery, 2006. 5(6): p. 493-506.
- Walle, T., Bioavailability of resveratrol. Annals of the new York Academy of Sciences, 2011. 1215(1): p. 9-15.
- Queipo-Ortuño, M.I., et al., Influence of red wine polyphenols and ethanol on the gut microbiota ecology and biochemical biomarkers1234. The American Journal of Clinical Nutrition, 2012. 95(6): p. 1323-1334.
- Del Bo, C., et al., A polyphenol-rich dietary pattern improves intestinal permeability, evaluated as serum zonulin levels, in older subjects: The MaPLE randomised controlled trial. Clinical Nutrition, 2021. 40(5): p. 3006-3018.
- Hurst, W.J., et al., Survey of the trans-Resveratrol and trans-Piceid Content of Cocoa-Containing and Chocolate Products. Journal of Agricultural and Food Chemistry, 2008. 56(18): p. 8374-8378.
- Basholli-Salihu, M., et al., Bioconversion of piceid to resveratrol by selected probiotic cell extracts. Bioprocess and Biosystems Engineering, 2016. 39(12): p. 1879-1885.
- Li, F., et al., Gut microbiota-derived resveratrol metabolites, dihydroresveratrol and lunularin, significantly contribute to the biological activities of resveratrol. Frontiers in Nutrition, 2022. 9: p. 912591.
- Iglesias-Aguirre, C.E., et al., Lunularin Producers versus Non-producers: Novel Human Metabotypes Associated with the Metabolism of Resveratrol by the Gut Microbiota. Journal of Agricultural and Food Chemistry, 2022. 70(34): p. 10521-10531.
- Chang, J.K., et al., Piceatannol stimulates osteoblast differentiation that may be mediated by increased bone morphogenetic protein-2 production. Eur J Pharmacol, 2006. 551(1-3): p. 1-9.
- Zhang, B., et al., Intestinal pharmacokinetics of resveratrol and regulatory effects of resveratrol metabolites on gut barrier and gut microbiota. Food Chemistry, 2021. 357: p. 129532.
- Shulpekova, Y.O., et al., Food intolerance: the role of histamine. Nutrients, 2021. 13(9): p. 3207.
- Bo, S., et al., Effects of resveratrol on bone health in type 2 diabetic patients. A double-blind randomized-controlled trial. Nutr Diabetes, 2018. 8(1): p. 51.
- Zhou, J., et al., Lactobacillus acidophilus (LA) Fermenting Astragalus Polysaccharides (APS) Improves Calcium Absorption and Osteoporosis by Altering Gut Microbiota. Foods, 2023. 12(2): p. 275.
- Buhrmann, C., et al., Evidence that TNF-β suppresses osteoblast differentiation of mesenchymal stem cells and resveratrol reverses it through modulation of NF-κB, Sirt1 and Runx2. Cell and tissue research, 2020. 381: p. 83-98.
- Shakibaei, M., C. Buhrmann, and A. Mobasheri, Resveratrol-mediated SIRT-1 interactions with p300 modulate receptor activator of NF-κB ligand (RANKL) activation of NF-κB signaling and inhibit osteoclastogenesis in bone-derived cells. Journal of Biological Chemistry, 2011. 286(13): p. 11492-11505.
- Shakibaei, M., et al., Resveratrol mediated modulation of Sirt-1/Runx2 promotes osteogenic differentiation of mesenchymal stem cells: potential role of Runx2 deacetylation. PLoS One, 2012. 7(4): p. e35712.
- Zaw, J.J.T., P.R. Howe, and R.H. Wong, Long-term effects of resveratrol on cognition, cerebrovascular function and cardio-metabolic markers in postmenopausal women: A 24-month randomised, double-blind, placebo-controlled, crossover study. Clinical Nutrition, 2021. 40(3): p. 820-829.
Autoren
war Anatom an der LMU München, ist mit über 35 Jahren wissenschaftlicher Erfahrung einer der weltweit führenden Experten auf dem Gebiet der Grundlagenforschung zur Entzündungsmodulation des muskuloskelettalen Systems und der Tumorbiologie mittels Phytopharmaka.
ist Ärztin und hat in der Arbeitsgruppe von Prof. Shakibaei promoviert mit dem Forschungsschwerpunkt der Phytopharmaka-basierten Entzündungsmodulation in Tumorzellen und muskuloskelettalem Gewebe.