Klinischer Hintergrund: Knorpelschäden treten insbesondere bei häufig Sportlern auf [8]. Zeigt sich ein symptomatischer fokaler Knorpelschaden, kann dieser je nach Größe und Begleitpathologie mit den etablierten knorpelregenerativen Verfahren wie der Mikrofrakturierung, autologen matrixinduzierten Chondrogenese (AMIC), autologen Chondrozytentransplantation (ACT), osteochondralen Transplantation (OCT) oder der neuen Knorpelstimulation mit eigenem Knorpel (MCT) behandelt werden [17].
Bei fortgeschrittener Degeneration können jedoch die klassischen knorpelregenerativen Verfahren nicht angewendet werden. Arthrose führt zu einer das gesamte Gelenk betreffenden Degeneration des Knorpels mit zunehmender Schädigung des subchondralen Knochens, Entstehung von Geröllzysten, Osteophyten und Entstehung eines inflammatorischen Milieus mit erhöhter Konzentration proinflammatorischer Zytokine. Insbesondere das inflammatorische Geschehen im Synovium zeigt sich als entscheidend für die Arthroseprogression [1]. Aktuelle konservative Therapieoptionen nach Leitlinie der konservativen Arthrosetherapie beinhalten die Schmerztherapie, intraartikuläre Hyaluronsäureinjektion, intraartikuläre Plättchen-reiches Plasma Injektion, Cortisoninjektion, sowie Physiotherapie und lassen sich als symptomorientierte Therapie beschreiben, die Arthroseprogression kann hierdurch nicht aufgehalten werden. Zudem ist nach Cortisoninjektion ein beschleunigter Arthroseprogress beschrieben, sodass insbesondere bei der Dosierung und Häufigkeit der Verabreichung Vorsicht geboten ist. Ist die konservative Therapie ausgereizt, bleibt als letztes Mittel der Wahl die endoprothetische Versorgung. Allgemein zeigt die Endoprothetik gute klinische Resultate, jedoch ist aufgrund der begrenzten Haltbarkeit bei starker Beanspruchung insbesondere für junge, sportlich aktive Patienten ein künstlicher Gelenkersatz nicht zufriedenstellend. Ein seit nun über zwei Jahrzenten erforschtes Therapiefeld ist die Stammzelltherapie mit MSC und stellt ein vielversprechendes Feld der Arthrosetherapie dar.
Definition MSC
Mesenchymale Stammzellen haben die initial beschriebene Eigenschaft, sich selbst erneuern zu können und unter bestimmten Bedingungen in sämtliche Zelltypen eines Gewebes zu differenzieren. Sie können aus verschiedenen Geweben, wie dem Knochenmark, Fettgewebe, Nabelschnurblut oder der Plazenta isoliert werden. Hierbei ist zu beachten, dass der eigentliche Stammzellbeweis nur für das Knochenmark erbracht ist [15]. Daher ist bei der korrekten Beschreibung bei Zellen aus anderem mesenchymalen Gewebe, wie dem Knochenmark, von mesenchymalen Stromazellen zu sprechen. Zuerst beschrieben wurde der Zelltyp von Alexander Friedenstein, der fibroblastische Zellen aus dem Knochenmark isolierte und in Osteophyten differenzieren ließ. Das ursprüngliche Modell, dass alle mesenchymalen Gewebe die gleichen Stammzellen enthalten, ist heutzutage widerlegt [5]. Vielmehr zeigt sich, dass Stammzellen in jedem Organ spezifisch sind und ihre eigenen Fraktionen besitzen [3]. So unterscheiden sich die Stammzellen im Kniegewebe von denen im Knochenmark oder Fettgewebe in Bezug auf ihr Proliferations-, Sekretions- und Differenzierungspotenzial. Die Verteilung in der Nähe von Blutgefäßen deutet darauf hin, dass MSC aus einer perivaskulären Nische entstammen. Im Kniegelenk haben MSC ähnliche Eigenschaften wie die Stammzellen des Knochenmarks in Bezug auf das Regenerations- und Differenzierungspotenzial. Sie sind jedoch im Vergleich zu den Stammzellen im Knochenmark ortsständig und nicht in der Lage, bei Trauma an den Ort der Verletzung zu gelangen [7]. Zudem gibt es Subtypen je nach Lokalisation im Kniegelenk, u.a. Knorpel, Meniskus, Kreuzbänder, Fettgewebe, die sich in ihren Eigenschaften unterscheiden (Abb. 1).
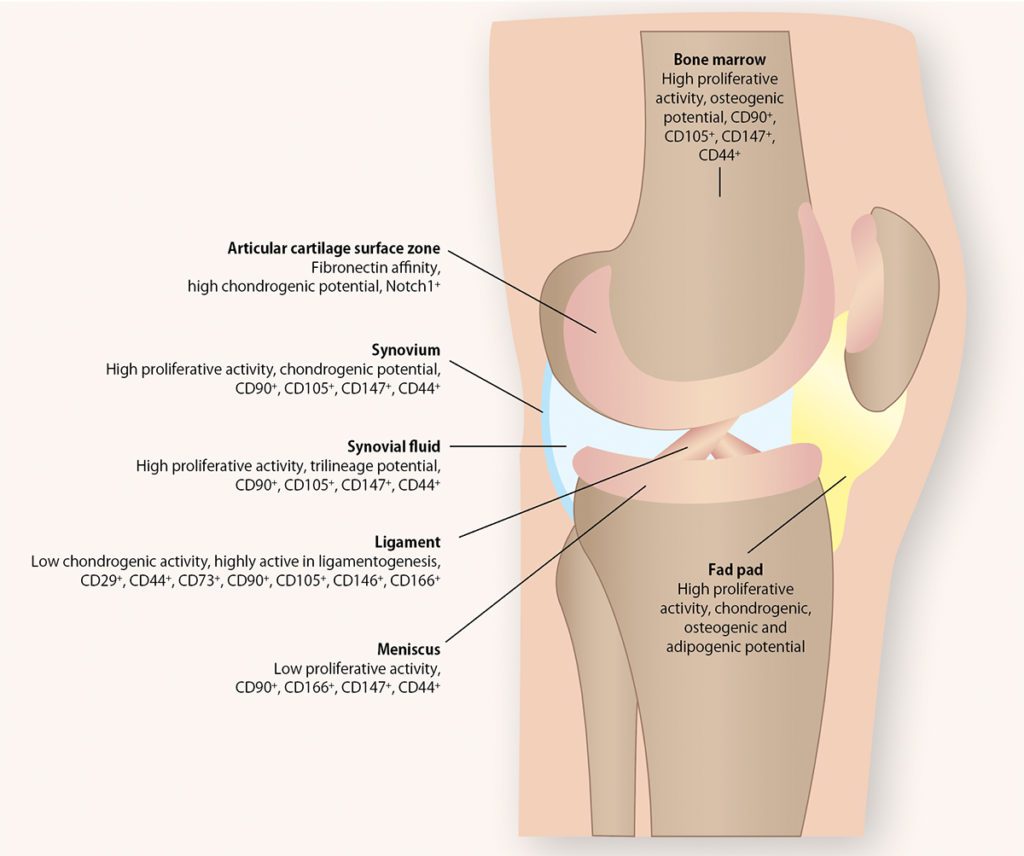
MSC bei Arthrose
Bei Arthrose ist die regenerative Funktion der ortsständigen MSC im Kniegelenk negativ beeinträchtigt. Murphy et al. konnten im Tiermodell ein Funktionsdefizit von MSC bei Arthrose sowohl in Phänotyp, Proliferation als auch Differenzierung zeigen [12]. Die mesenchymalen Stammzellen stehen somit im Mittelpunkt der Arthroseprogression – aufgrund der gestörten Knorpelhomöostase ist die Kapazität an Reperaturmechanismen insuffizient.
Der parakrine Effekt in der Arthrosetherapie mit MSC
Die ursprüngliche Idee der Therapie mit MSC war die der Defektfüllung nach Adhärenz durch Differenzierung der Stammzelle zum Zielgewebe [4]. Murphy et al. konnten jedoch in einem Tiermodell zeigen, dass lediglich 3 % der Zellen nach wenigen Tagen noch detektierbar waren [13]. Der größte Teil hiervon befand sich adhärent an Meniskus, Bandstrukturen, jedoch nur vereinzelt Zellen am Knorpelgewebe. Trotzdem zeigen viele Studien eine deutliche klinische Symptomreduktion sowie einen positiven Einfluss auf die Arthrosprogression bei Stammzelltherapie [10]. Dies lässt sich mit dem Konzept des parakrinen Effekts erklären. Eine Vielzahl an MSC spezifisch für das jeweilige Gewebe wie Knochenmark, Synovium, Meniskus, Ligamente und Knorpel befinden sich im Kniegelenk. Sie bilden ein Reservoir um Reparationsvorgänge zu induzieren, sowie Immunmodulation durch Unterdrückung von Inflammation zu erreichen [2]. Bei Arthrosetherapie mit MSC erfolgt die Injektion von Stammzellsuspensionen nach Zellexpansion z. B. aus Knochenmarkaspirat oder Fettgewebe (bMSC, svF stromale vaskuläre Fraktion). Die Applikation zeigte in zahlreichen Studien eine Verbesserung der Knorpelhomöostase trotz fehlender Migration und Integration [10]. Erklärt werden kann dies durch den parakrinen Effekt. Transplantierte MSC beeinflussen lokale MSC und setzen hierdurch einen Reparaturprozess in Gang. Vier wesentliche Bestandteile lassen sich beim parakrinen Effekt unterscheiden. 1. Es erfolgt eine Immunmodulation von T-Zellen, B-Zellen, dendritischen Zellen sowie Makrophagen. 2. Die MSC fungieren als Sekretom mit Ausschüttung von Zytokinen, Chemokinen, extrazellulärer Matrix sowie Proteasen, die einen Regenerationsprozess stimulieren. 3. Die Apoptose der transplantierten Zelle verstärkt hierbei den immunmodulativen Effekt durch Ausschüttung von Reperaturmediatoren wie Wachstumsfaktoren und inhibiert die Sekretion proinflammatorischer Zytokine durch Monozyten und Apoptotic Bodies. 4. Es werden extravesikuläre Vesikel wie Exosome, Mikrovesikel und Apoptotic Bodies ausgeschüttet, die sich positiv auf die Gelenkhomöostase auswirken. Insgesamt findet eine komplexe Immuninteraktion statt, die zu einer Verbesserung der Symptomatik und Stimulation der Knorpelregeneration führt [14]. Caplan und Kollegen forderten aus diesen Überlegungen 2017 für die MSC die neue Definition “Medicinal signaling cell” [6].
Klinische Ergebnisse
Die aktuellen Daten bei intraartikulärer Injektion von expandierten mesenchymalen Stammzellen bei Kniegelenksarthrose zeigen eine signifikante Wirksamkeit für klinische Scores [11, 16]. Kim et al. zeigten in einer Metaanalyse von kontrolliert randomisierter Studien ohne zusätzliche chirurgische Maßnahmen eine signifikante Schmerzreduktion der behandelten Patienten mit Arthrose im 6-12 monatigen Follow up [9]. Die qualitative Untersuchung mittels MRT im Follow up mit der Bestimmung des WORMS Scores (Whole-Organ Magnetic Resonance Imaging Score) erbrachte keine signifikanten Unterschiede. Es gilt jedoch insbesondere zu beachten, dass erhebliche Unterschiede in den Studienprotokollen vorhanden sind, so dass ein Vergleich zwischen den einzelnen Studien sehr schwierig ist. Zudem fehlen Langzeitergebnisse von qualitativ hochwertigen RCT, um einen länger bestehenden Einfluss der Stammzelltherapie zu untersuchen.
Fazit
Der parakrine Effekt zeigt sich als maßgeblich für die klinische Wirksamkeit der intraartikulären Stammzelltherapie mit mesenchymalen Stammzellen. Ziel der Stammzelltherapie nach aktuellem Stand ist jedoch nicht, die Arthrose zu heilen, sondern die Progression zu verlangsamen. Die biologischen Effekte sind nur in Bruchteilen verstanden. Der positive parakrine Effekt ist jedoch nun mittlerweile klar. Klinische Studien können eine klinische Effektivität klar darstellen (symptommodifying). Eine Reparatur am Gewebe (disease-modifying) konnte bisher nicht nachgewiesen werden. Durch eine signifikante Reduktion der bei Arthrose bestehenden Inflammation kann die Symptomatik des Patienten am Ort des Geschehens, intraartikulär, auf Dauer verbessert werden. Damit kann der Betroffene der gewollten Aktivität mit weniger Schmerz sowie Schwellung und damit einer erhöhten Aktivität nachgehen.
Literatur
REFERENCES
1. Ayral X, Pickering EH, Woodworth TG, Mackillop N, Dougados M. Synovitis: a potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis — results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and cartilage. 2005;13(5):361-367.
2. Barry F. MSC Therapy for Osteoarthritis: An Unfinished Story. Journal of orthopaedic research : official publication of the Orthopaedic Research Society. 2019;37(6):1229-1235.
3. Barry F, Murphy M. Mesenchymal stem cells in joint disease and repair. Nature reviews. Rheumatology. 2013;9(10):584-594.
4. Caplan AI. Mesenchymal stem cells. Journal of orthopaedic research : official publication of the Orthopaedic Research Society. 1991;9(5):641-650.
5. Caplan AI. Why are MSCs therapeutic? New data: new insight. The Journal of pathology. 2009;217(2):318-324.
6. Caplan AI. Mesenchymal Stem Cells: Time to Change the Name! Stem cells translational medicine. 2017;6(6):1445-1451.
7. Cheng M-T, Yang H-W, Chen T-H, Lee OK-S. Isolation and characterization of multipotent stem cells from human cruciate ligaments. Cell proliferation. 2009;42(4):448-460.
8. Flanigan DC, Harris JD, Trinh TQ, Siston RA, Brophy RH. Prevalence of chondral defects in athletes‘ knees: a systematic review. Medicine and science in sports and exercise. 2010;42(10):1795-1801.
9. Kim SH, Djaja YP, Park Y-B, Park J-G, Ko Y-B, Ha C-W. Intra-articular Injection of Culture-Expanded Mesenchymal Stem Cells Without Adjuvant Surgery in Knee Osteoarthritis: A Systematic Review and Meta-analysis. The American journal of sports medicine. 2019:363546519892278.
10. McIntyre JA, Jones IA, Han B, Vangsness CT. Intra-articular Mesenchymal Stem Cell Therapy for the Human Joint: A Systematic Review. The American journal of sports medicine. 2018;46(14):3550-3563.
11. McIntyre JA, Jones IA, Han B, Vangsness CT. Intra-articular Mesenchymal Stem Cell Therapy for the Human Joint: A Systematic Review. The American journal of sports medicine. 2018;46(14):3550-3563.
12. Murphy JM, Dixon K, Beck S, Fabian D, Feldman A, Barry F. Reduced chondrogenic and adipogenic activity of mesenchymal stem cells from patients with advanced osteoarthritis. Arthritis and rheumatism. 2002;46(3):704-713.
13. Murphy JM, Fink DJ, Hunziker EB, Barry FP. Stem cell therapy in a caprine model of osteoarthritis. Arthritis and rheumatism. 2003;48(12):3464-3474.
14. Pittenger MF, Discher DE, Péault BM, Phinney DG, Hare JM, Caplan AI. Mesenchymal stem cell perspective: cell biology to clinical progress. NPJ Regenerative medicine. 2019;4:22.
15. Sacchetti B, Funari A, Michienzi S, et al. Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell. 2007;131(2):324-336.
16. Yubo M, Yanyan L, Li L, Tao S, Bo L, Lin C. Clinical efficacy and safety of mesenchymal stem cell transplantation for osteoarthritis treatment: A meta-analysis. PloS one. 2017;12(4):e0175449.
17. Zhao Z, Fan C, Chen F, et al. Progress in Articular Cartilage Tissue Engineering: A Review on Therapeutic Cells and Macromolecular Scaffolds. Macromolecular bioscience. 2020;20(2):e1900278.
Autoren
ist Facharzt für Orthopädie und Unfallchirurgie. Er hat seinen Lehrauftrag an der medizinischen Fakultät der Universität Freiburg im Breisgau. Sein Fachgebiet ist die Kniechirurgie. Er ist Partner am Gelenkzentrum Rhein-Main und Leitender Oberarzt Sektion Kniechirurgie an der Schulthess Klinik in Zürich. Professor Salzmann ist AGA Instruktor und beratender Arzt der Eintracht Frankfurt, Fußball.
ist Assistenzarzt Orthopädie/ Unfallchirurgie an der Uniklinik Bonn. Sein Forschungsschwerpunkt ist die regenerative Knorpelchirurgie. Neben einem Forschungsaufenthalt AO Institut Davos hat er 2016 den Alwin Jäger Preis für klinisch innovative, arthroskopische Arbeiten erhalten.




