Osteoarthritis, Arthritis, Tendinitis, Knochen-, Knorpel-, Sehnendefekte… Die Liste der von destruktiven Prozessen begleiteten muskuloskelettalen Erkrankungen ist so umfangreich wie die zahlreichen Versuche therapeutischer Ansätze. Aus Sicht der Grundlagenforschung gehen diese Verletzungen meistens mit lokalen Entzündungen einher, welche über die Kaskade des pro-inflammatorischen Transkriptionsfaktors nuclear factor kappa-light-chain-enhancer of activated B-cells (NF-kB) deren Entstehung begünstigen oder deren Heilung behindern. Der Einsatz von mesenchymalen Stammzellen (MSCs) könnte diesbezüglich zukünftig eine therapeutische Option darstellen. Hierbei handelt es sich um multipotente Stammzellen des Knochenmarks oder Fettgewebes, welche sich in unterschiedliche Typen von Bindegewebszellen differenzieren können. Spezifische Wachstumsfaktoren und Förderungsmedien lassen aus MSCs in vitro beispielsweise Osteoblasten, Chondrozyten, Adipozyten (Csaki, Matis et al. 2007) und Tenozyten (Schneider, Buhrmann et al. 2011) entstehen. Faszinierenderweise sind MSCs nicht nur in der Lage, Bindegewebsschäden zu reparieren und regenerieren, sondern unterdrücken gleichzeitig die Signalwege, die durch Entzündung oder Fibrosebildung zu bleibenden Schäden führen. Als weiterer großer Vorteil sind sie nicht immunogen und können daher autolog oder allogen risikoarm transplantiert werden (Voswinkel and Chapel 2012). Insgesamt weisen zahlreiche Ergebnisse auf eine vielversprechende Zellersatzstrategie durch MSCs im orthopädischen, unfallchirurgischen und sportmedizinischen Bereich hin (Schneider, Neuss et al. 2010), doch die Forschung an diesen Stammzellen erweist sich als komplex und langwierig (EuroStemCell 2016). Wie kann ihr proliferatives Potenzial also optimal genutzt werden?
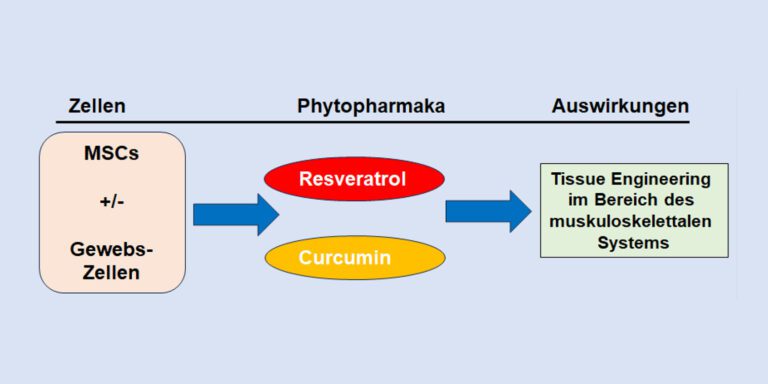
Zum einen spielt das Modell der Zellkultivierung eine Rolle, wobei sich dreidimensionale Co-Kulturen (High density culture) aus MSCs und den gewünschten ausdifferenzierten Bindegewebszellen als vorteilhaft zeigten (Abbildung 1). Mithilfe dieser Methode konnte die Tenogenese aus MSCs in vitro zum ersten Mal nachgewiesen werden (Schneider, Buhrmann et al. 2011) und die chondrogene sowie osteogene Kapazität im Vergleich zu Monolayer-Kulturen signifikant gesteigert werden (Csaki, Matis et al. 2009, Patnaik, Jannati et al. 2023). Zum anderen wurde ein unterstützender Effekt durch Phytopharmaka demonstriert. Resveratrol, ein natürliches Polyphenol aus roten Früchten wie Trauben, Beeren und Nüssen (Brockmueller, Sajeev et al. 2024), steigert die Osteogenese aus MSCs in Zellkulturversuchen erheblich durch die Aktivierung des Sirtuin (Sirt)-1 Signalweges sowie durch die Steigerung der Expression des knochenspezifischen Transkriptionsfaktors Runt-related transcription factor 2 (Runx2) (Shakibaei, Shayan et al. 2012). Diese molekularen Mechanismen werden durch den Pflanzenstoff sowohl zur Stärkung der Osteoblastendifferenzierung genutzt als auch zur Suppression entzündlicher Prozesse, die durch Zytokine wie Tumornekrosefaktoren und den Transkriptionsfaktor NF-kB induziert werden (Constanze, Popper et al. 2020). Darüber hinaus gibt es interessanterweise Hinweise auf eine Resveratrol-assoziierte Förderung einer molekularen Achse zwischen Sirt-1 und dem knorpelspezifischen Transkriptionsfaktor Sox9 während der Chondrogenese aus MSCs. Es ist für die Differenzierung von Chondrozyten und die Bildung von Knorpel unerlässlich. Auch hier scheint die Hemmung von NF-kB eine zentrale Rolle zu spielen (Buhrmann, Busch et al. 2014) (Abbildung 1). Curcumin, ein weiterer sekundärer Pflanzenstoff, welcher aus der Curcuma longa Wurzel stammt (Brockmueller, Samuel et al. 2023), kann ebenfalls dazu beitragen, pro-inflammatorische Zytokine sowie die NF-kB-Aktivierung zu reduzieren und dadurch eine Chondrogenese-freundliche Umgebung zu schaffen, welche die Differenzierung und Proliferation von MSCs unterstützt (Buhrmann, Mobasheri et al. 2010, Patnaik, Jannati et al. 2023). Die lokale Anwendung von Curcumin und MSCs bei Achillessehnen-Verletzungen wurde bereits in vivo an Ratten getestet, was zu einer gesteigerten Synthese von Kollagen sowie dem sehnenspezifischen Protein Tenomodulin und letztlich zu positiven Effekten auf die Heilung führte (Öztürk, Özyazgan et al. 2023) (Abbildung 1).

Insgesamt schaffen die Ergebnisse präklinischer Versuche Hoffnung, dass sekundäre Pflanzenstoffe bei der Züchtung von Bindegewebszellen aus MSCs förderlich eingesetzt werden könnten. Eine gute Verträglichkeit sowie reichliche Verfügbarkeit sind weitere vorteilhafte Aspekte, die für die Erforschung des Einsatzes von Phytopharmaka sprechen. Klinische Studien, welche die Transplantation von MSCs unter den Effekten einer Curcumin- oder Resveratrol-Behandlung untersuchen, sind bisher nicht publiziert. Vielleicht ein nächster Schritt in der Vision, Bindegewebsschäden langfristig zu regenerieren…
Referenzen
- Brockmueller, A., A. Sajeev, L. Koklesova, S. M. Samuel, P. Kubatka, D. Büsselberg, A. B. Kunnumakkara and M. Shakibaei (2024). „Resveratrol as sensitizer in colorectal cancer plasticity.“ Cancer Metastasis Rev 43(1): 55-85.
- Brockmueller, A., S. M. Samuel, A. Mazurakova, D. Büsselberg, P. Kubatka and M. Shakibaei (2023). „Curcumin, calebin A and chemosensitization: How are they linked to colorectal cancer?“ Life Sci 318: 121504.
- Buhrmann, C., F. Busch, P. Shayan and M. Shakibaei (2014). „Sirtuin-1 (SIRT1) is required for promoting chondrogenic differentiation of mesenchymal stem cells.“ J Biol Chem 289(32): 22048-22062.
- Buhrmann, C., A. Mobasheri, U. Matis and M. Shakibaei (2010). „Curcumin mediated suppression of nuclear factor-κB promotes chondrogenic differentiation of mesenchymal stem cells in a high-density co-culture microenvironment.“ Arthritis Res Ther 12(4): R127. Constanze, B., B. Popper, B. B. Aggarwal and
- M. Shakibaei (2020). „Evidence that TNF-β suppresses osteoblast differentiation of mesenchymal stem cells and resveratrol reverses it through modulation of NF-κB, Sirt1 and Runx2.“ Cell Tissue Res 381(1): 83-98.
- Csaki, C., U. Matis, A. Mobasheri and M. Shakibaei (2009). „Co-culture of canine mesenchymal stem cells with primary bone-derived osteoblasts promotes osteogenic differentiation.“ Histochem Cell Biol 131(2): 251-266.
- Csaki, C., U. Matis, A. Mobasheri, H. Ye and M. Shakibaei (2007). „Chondrogenesis, osteogenesis and adipogenesis of canine mesenchymal stem cells: a biochemical, morphological and ultrastructural study.“
- Histochem Cell Biol 128(6): 507-520. EuroStemCell. (2016). „Mesenchymale Stammzellen: die „anderen“ Knochenmark-Stammzellen.“ Retrieved 03.05., 2024, from https://www.eurostemcell.org/sites/default/files/documents/did-you-
know/Factsheet_DE_MSC.pdf. - Öztürk, T. M., İ. Özyazgan, G. Sezer, B. Yalçın, R. Göç, M. Ülger, H. Özocak and B. Yakan (2023). „Investigation of the effects of umbilical cord-derived mesenchymal stem cells and curcumin on Achilles tendon healing – can they act synergistically?“ Ulus Travma Acil Cerrahi Derg 29(11): 1218-1227.
- Patnaik, R., S. Jannati, B. M. Sivani, M. Rizzo, N. Naidoo and Y. Banerjee (2023). „Efficient Generation of
- Chondrocytes From Bone Marrow-Derived Mesenchymal Stem Cells in a 3D Culture System: Protocol for a
- Practical Model for Assessing Anti-Inflammatory Therapies.“ JMIR Res Protoc 12: e42964.
- Schneider, P. R., C. Buhrmann, A. Mobasheri, U. Matis and M. Shakibaei (2011). „Three-dimensional high-density co-culture with primary tenocytes induces tenogenic differentiation in mesenchymal stem cells.“ J Orthop Res 29(9): 1351-1360.
- Schneider, R. K., S. Neuss, R. Knüchel and A. Perez-Bouza (2010). „[Mesenchymal stem cells for bone tissue engineering].“ Pathologe 31 Suppl 2: 138-146.
- Shakibaei, M., P. Shayan, F. Busch, C. Aldinger, C. Buhrmann, C. Lueders and A. Mobasheri (2012). „Resveratrol mediated modulation of Sirt-1/Runx2 promotes osteogenic differentiation of mesenchymal stem cells: potential role of Runx2 deacetylation.“ PLoS One 7(4): e35712.
- Voswinkel, J. and A. Chapel (2012). „[Mesenchymal stem cells and rheumatism. State of the art].“ Z Rheumatol 71(7): 619-623.
Newsletter – Verpassen Sie keinen Content mehr und melden Sie sich für unseren Newsletter an.
Autoren
war Anatom an der LMU München, ist mit über 35 Jahren wissenschaftlicher Erfahrung einer der weltweit führenden Experten auf dem Gebiet der Grundlagenforschung zur Entzündungsmodulation des muskuloskelettalen Systems und der Tumorbiologie mittels Phytopharmaka.
ist Ärztin und hat in der Arbeitsgruppe von Prof. Shakibaei promoviert mit dem Forschungsschwerpunkt der Phytopharmaka-basierten Entzündungsmodulation in Tumorzellen und muskuloskelettalem Gewebe.