Wie wichtig die Rolle von Vitamin D im Knochenstoffwechsel und damit im Sport ist, wurde in den letzten Jahren eingehend untersucht. Die Bedeutung einer ausreichenden Vitamin D Versorgung in der Sportmedizin liegt jedoch nicht nur in der Regeneration nach knöchernen Verletzungen, sondern längst in der Prävention und dem positiven Einfluss auf das Immunsystem.
Wie in dem Artikel von Prof. Ghanaati, Dr. Volz et. al. in der Ausgabe 04/2020 der sportärztezeitung (S.96 – 98) dargestellt, spielen folgende Funktionen eine weitere Rolle:
- Antinflammatorischer Effekt über Zytokine
- Expression von Proteinen als Transkriptionsfaktor über Vitamin D Rezeptoren auf Körperzellen (Muskulatur)
- Immunmodulation
- Verbesserte Belastbarkeit kardiopulmonaler Systeme
Vitamin D und Vitamin K
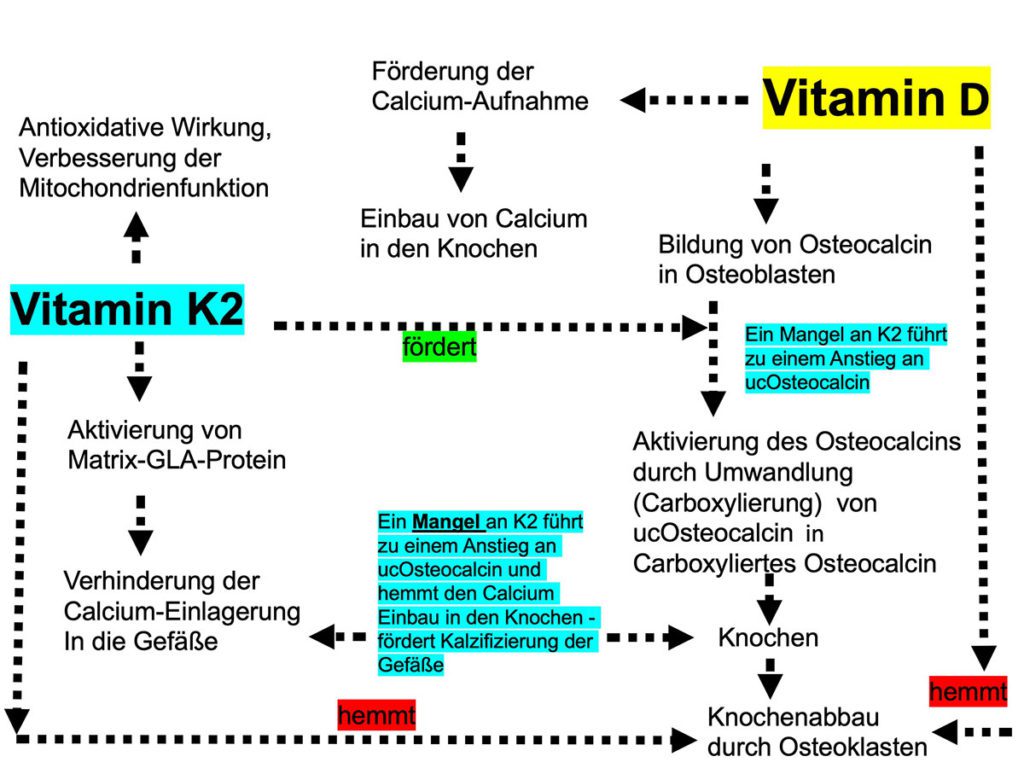
Ohne Vitamin D kann das mit der Nahrung zugeführte Calcium nicht vom Körper aufgenommen und verwertet werden. Vitamin D steuert die Synthese der Proteine, die später durch Vitamin K aktiviert werden müssen. Namensgebend für die Vitamin-K-Gruppe war die indirekte Wirkung auf die Blutgerinnung (Koagulation). Heute wird von den verschiedenen Formen des fettlöslichen Vitamins vor allem K1 und K2 mit seinen Untereinheiten (Menachinone- MK) unterschieden.
Vitamin K Formen – Zufuhr über Ernährung und Synthese
Vitamin K1 (Phyllochinon) wird von Pflanzen und Algen synthetisiert. Es wird mit 70 – 90 % über grünes Blattgemüse wie Grünkohl, Rosenkohl, Brokkoli und Spinat sowie in geringen Mengen über Sojaöl, Rapsöl, Leber und Eier aufgenommen. Vitamin K2 (Menachinon) entsteht einerseits in geringen Mengen im Menschen durch enzymatische Umwandlung von K1, andererseits wird K2 in seinen Unterformen über fermentierte Produkte wie Joghurt und Käse aufgenommen, von Bakterien gebildet und beträgt meist weniger als 25 % [1, 2]. Vitamin K2 ist nach Prüfung durch die europäische Aufsichtsbehörde EFSA im Jahr 2009 zur Verwendung in europäischen Lebensmittel- und Nahrungsergänzungszubereitungen zugelassen. Menaquinon-4 (MK-4) und Menaquinon-7 (MK-7) sind unter präventiven und therapeutischen Aspekten die wichtigsten beiden Vertreter der Vitamin-K-Gruppe [9, 10]. In Japan existiert mit Natto ein traditionelles Lebensmittel aus Sojabohnen, das durch Bacillus subtilis fermentiert wird und sehr hohe Gehalte an MK-7 enthält [3]. 10 – 50 % des K2-Bedarfs wird durch bestimmte überhaupt K2 produzierende Bakterien des Darmes gedeckt [5, 6] und setzt eine gesunde individuellen Zusammensetzung des Darmmikrobioms für die Vitamin-K-abhängigen physiologischen Prozesse voraus. Lediglich Vitamin K2 (MK-4) kann als einziges Menachinon nicht durch Bakterien des Darmmikrobioms gebildet werden, sondern erst in den einzelnen Organen aus pflanzlichem K1 (Phyllochinon) [4]. Da sich die Darmgesundheit deutlich verschlechtert hat und fermentierte Lebensmittel weniger zugeführt werden, bezweifeln Studien, dass die körpereigene Produktion ausreicht, um den K2-Bedarf zu decken und gehen von einem weit verbreiteten Vitamin-K2-Mangel in den westlichen Ländern aus [5 – 8].
Stoffwechsel – Carboxylierung
Herz-Kreislauf
Von den extrahepatischen Vitamin-K-abhängigen Proteinen sind Matrix-GLA Protein (MGP) und Osteocalcin am besten untersucht [11]. Während Osteocalcin den Einbau von Calcium in die Knochenmatrix fördert und damit den Knochenstoffwechsel unterstützt, wirkt das Vitamin-K-abhängige MGP der Gefäßkalzifizierung, der Entwicklung entzündlicher Atherosklerose mit fokaler Plaques-Bildung sowie altersbedingten Verschleißerscheinungen der Arterien entgegen. Damit schützt es die Blutgefäße vor einer Calcium-Überladung [12, 13]. Vitamin K2 aktiviert das MGP durch die sogenannte „Carboxylierung“. Es bindet und transportiert nur in diesem carboxylierten Zustand freies Calcium im Blut [14, 15]. Bei einem Vitamin-K2-Mangel sind die Calcium-bindenden Proteine untercarboxyliert und damit inaktiv. Die Rotterdam-Herz-Studie 2004 zeigte über zehn Jahre an 4.807 Teilnehmern, dass Menschen, die sich mit Nahrungsmitteln mit hohem Anteil an natürlichem Vitamin K2 (min. 32 µg täglich) ernährten, deutlich weniger Kalziumablagerungen in den Arterien aufwiesen. Vitamin K2 senkte das Risiko um 50 %, eine Gefäßverkalkung zu entwickeln oder an einer Herz-Kreislauf-Erkrankung zu sterben [16]. Eine erhöhte Vitamin K2 Einnahme konnte bei älteren Patienten das Mortalitätsrisiko um 25 % senken [18]. Dies zeigte sich nur für Vitamin K2, nicht jedoch für Vitamin K1, welches zum Teil in K2 umgewandelt wird, auch in weiteren Studien [17]. Dieser Zusammenhang scheint sich in Form verstärkter Gefäßverkalkung unter der Therapie mit Vitamin-K-Antagonisten zu bestätigen [19]. In einer anderen Studie wurden Ratten ein Vitamin-K-Antagonist verabreicht, um eine Verkalkung der Arterien herbeizuführen. Erhielten Ratten Vitamin-K2-haltiges Futter, führte dies bei den Tieren zu einer Reduktion des Kalziumgehalts in den Arterien um 50 %. Somit konnte Vitamin K2 die Kalzifikation nicht nur verhindern, sondern sogar umkehren [20]. Vitamin K2 ist ein Isoprenoidchinon wie CoQ10, zeigt damit strukturelle und funktionelle Homologie zum Coenzym Q10 und wirkt in einigen Bakterienspezies als Elektronenträger. Daher wurde Vitamin K2 eine essenzielle Funktion als Elektronentransporter in den Mitochondrien eukaryontischer Zellen zugeschrieben und in Bezug auf die Mitochondrien die Rolle eines Q-Mimetikums, welches die mitochondriale ATP-Produktion in der Atmungskette unterstützt [21]. 2019 konnte jedoch gezeigt werden, dass Vitamin K2 nicht Coenzym Q 10 als Elektronenträger in der mitochondrialen Atmungskette von Säugetierzellen (Mäusen mit Gendefekt) ersetzen kann. Daher sind weitere Untersuchungen hierzu notwendig [22].
Knochen
Aktives Vitamin D kontrolliert Osteocalcin transkriptionell und funktioniert nur, wenn es durch Vitamin K carboxyliert vorliegt. So ergänzen sich Vitamin D und K synergistisch beim Knochenaufbau. Vitamin K, vor allem MK-7, inhibiert wohl auch den Transkriptionsfaktor NFκB und trägt über diesen Weg zu einem verbesserten Knochenaufbau bei [24]. Unzureichend carboxiliertes Calciotonin hat eine geringere Affinität zum Kalziumphosphat der Knochenmatrix. Erst carboxyliertes Osteocalcin (cOc) fördert dagegen die Mineralisierung der Knochenmatrix, erhöht die Knochenfestigkeit und senkt das Frakturrisiko. Patienten mit Vorhofflimmern, die nicht mit Vitamin K antikoaguliert wurden, hatten ein geringeres Osteoporoserisiko [23]. Ältere Frauen mit osteo-porotischen Hüftfrakturen zeigten deutlich niedrigere Serumkonzentrationen an Vitamin K [25]. Eine geringe diätetische Vitamin-K-Zufuhr und ein hoher Anteil an untercarboxiliertem Osteocalcin (ucOc) sind eigenständige Risikofaktoren für Hüftgelenkfrakturen [27 – 29]. In Japan werden pharmakologische Dosen an MK-4 (10 – 90 mg/d) standardmäßig zur Behandlung von Osteoporose eingesetzt und zeigen bei postmenopausalen Frauen mit Osteoporose über ein bis drei Jahre einen positiven Effekt auf die Erhaltung der Knochendichte und das Frakturrisiko, wie in einer Metaanalyse von 6.759 Teilnehmern gezeigt wurde [30].
K2-Mangel – untercarboxyliertes Osteocalcin (ucOc)
Bei einem Vitamin-K2-Mangel sind die Calcium-bindende Proteine untercarboxyliert und damit inaktiv. Blutproben gesunder Personen zeigten, dass obwohl alle Koagulationsproteine durch Vitamin K vollständig carboxyliert waren, bei einem Großteil der untersuchten Personen eine hohe Konzentration an untercarboxylierten γ-Carboxyglutaminsäure-Proteinen (Osteocalcin, Matrix-Gla-Protein) vorlagen. Untercarboxyliertes Osteocalcin (ucOc) und Matrix-Gla-Protein (ucMGP) sind funktionelle Laborparameter für einen Vitamin-K-Mangel und mit einem erhöhten Risiko für Knochenfrakturen bzw. Gefäßkomplikationen assoziiert. Nach den Ergebnissen dieser Untersuchung muss davon ausgegangen werden, dass ein Großteil der Bevölkerung nicht ausreichend mit Vitamin K2 versorgt ist [31].
Gabe von Vitamin K2
Es gibt zunehmend Hinweise dafür, dass der empfohlene Vitamin-K-Bedarf der Ernährungsfachgesellschaften für die γ-Carboxylierung des Osteocalcins und Matrix-Gla-Proteins durch die normale diätetische Zufuhr nicht ausreicht [32]. Sowohl MK4 als auch MK7 werden aus Nahrungsmitteln und Supplementen fast vollständig aufgenommen. Große Unterschiede gibt es dafür in der Halbwertszeit im Körper: MK 4 wird bereits nach wenigen Stunden ausgeschieden, wohingegen MK7 über volle 72 Stunden im Blut verfügbar bleibt. Dadurch zeigt MK7 eine weitaus bessere und längere Wirksamkeit [33 – 35]. Der Körper kann nur die trans-Form von MK7 verarbeiten, was daher besonders wichtig bei der Auswahl eines Vitamin K2-Präparats ist [48]. Trotzdem zeigte sich 2018, dass einige Produkte nur einen geringen wirksamen trans-Anteil enthielten [49]. Da unter täglicher Supplementierung von MK7 eine signifikante Störung der Einstellung der Blutgerinnung auftreten kann, raten Autoren von der Gabe bei Patienten unter einer Therapie mit Vitamin-K-Antagonisten ab [35, 36]. Ein erhöhtes ucOsteocalcin steigert auch das Risiko für weitere chronisch entzündliche Erkrankungen, wie z. B. Diabetes Typ II. In einer Studie 2020 konnte die individuelle oder kombinierte Ergänzung mit Vitaminen D3 und K2 den Glukosespiegel und den Anteil der funktionellen Pankreas-Beta-Zellen signifikant senken. Die Gabe von D3 + K2 induzierte eine Verringerung des uOC /cOC-Index [37]. Neben seiner Funktion in durch Vitamin D angeschobenen, Calcium-abhängigen Stoffwechselwegen, entfaltet Vitamin K auch eine eigene antientzündliche Wirkung durch Hemmung der Expression pro-entzündlicher Zytokine. Vitamin K schützt als Elektronenfänger vor oxidativem Stress und wirkt damit entzündlichen Prozessen entgegen. Sowohl Tier- als auch Humanstudien haben gezeigt, dass Vitamin K2 die Insulinsensitivität durch Beteiligung von Vitamin K abhängigem Protein Osteocalcin, die Regulierung des Adipokinspiegels, entzündungshemmende Eigenschaften, Glukosetoleranz und lipidsenkende Wirkungen bei Diabetes Typ II verbessert [38, 39].
Labor
Bestimmung von Vitamin K2-Spiegelbestimmung im Blut ist zur Statusanalyse ungeeignet, da es als fettlösliches Vitamin nur tagesaktuelle Blutspiegel, nicht den Speicher im Gewebe erfasst. Es handelt sich um ein instabiles Molekül mit schwieriger Präanalytik, über Zentrifugierung sowie eingefrorenen Transport ins Labor gesendet. Zudem bestehen starke Spiegelschwankungen wegen der kurzen biologischen Halbwertzeit von (MK4 – 1h, MK7 ca. 72 h). Vitamin K1 steigert zwar die Carboxylierung von Osteocalcin, aber nur die Einnahme von MK7 führt zu einer weiteren Zunahme des Carboxylierungsgrades. Vitamin K2 ist essenzieller Kofaktor der Carboxylierung von Osteocalcin, also der Umwandlung von untercarboxyliertem „uc“Osteocalcin in seine carboxylierte Form. Untercarboxyliertes Osteocalcin korreliert mit geringer Knochendichte und erhöhtem Frakturrisiko [40]. Bei schlechter Vitamin K2-Versorgung bzw. einer geringeren Bioaktivität wird ein nur geringer Anteil des Osteocalcins carboxyliert. Dies führt zu einem Anstieg des ucOsteocalcins. Erhöhte Werte deuten auf einen absoluten und/oder funktionellen Vitamin K2-Mangel hin. Von verschiedenen Autoren wird empfohlen, uOC / cOC oder cOC / uOC-Indizes oder einen Index mit der Gesamtosteocalcin-Konzentration (uOC / tOC) zu bestimmen [41 – 43].
Sport
Vitamin K2 verbessert bei Insulinresistenz die Mitochondrienfunktion durch Verbesserung der Atmungskapazität, Erhöhung der Biogenese und der enzymatischen Aktivitäten von Mitochondrienkomplexen durch SIRT1 (Sirtuin 1) -Signalübertragung [44, 45]. Sirtuin-1 ist beteiligt an der Differenzierung von Muskelzellen, Umschaltung des Stoffwechsels auf Lipolyse und Verlangsamung der Apoptose. Eine in vitro Studie konnte 2018 zeigen, dass Vitamin K2 (MK-4) einen positiven Effekt auf die Migration und Proliferation von Muskelzellen hat, was zwei wichtige Schritte während der frühen Myogenese sind [46]. Konnte bis dahin nur an erkrankten Patienten eine bessere Herzfunktion unter K2-Gabe gezeigt werden, gelang dies 2017 auch bei gesunden Sportlern. Bei 26 aerob trainierten männlichen und weiblichen Athleten war die achtwöchige Einnahme von Vitamin K2 mit einem Anstieg des maximalen Herzzeitvolumens um 12 % im Ergometer-Test verbunden [47].
Fußball
Vitamin D: Bei 28 Spieler im Rahmen der Eingangsuntersuchungen eines Fußball Bundesliga Kaders lag im Sommer der durchschnittliche Vitamin D Spiegel bei 47,45 µg/l (24,1-75). Im Januar bei 26 Spielern bei 32,5 µg/l (14,5 -62,2), wobei 8 Spieler mehr oder weniger regelmäßig supplementierten.
Bei nicht supplementierten Spielern soll die Tabelle an sechs Spielern zeigen wie stark der Vitamin D Spiegel abfallen kann.
| Vitamin D Spiegel in µg/l | ||||||
| Spieler | 1 | 2 | 3 | 4 | 5 | 6 |
| Sommer /August | 36,4 | 65,8 | 67,7 | 58 | 69 | 62 |
| Winter / Januar | 14,5 | 32,4 | 22,5 | 34,2 | 25 | 33 |
| Abfall in µg/l |
21,9 | 33,4 | 45,2 | 23,8 | 43 | 29 |
Vitamin K 2: Bei 28 Teilnehmern der Eingangsuntersuchung wurde bei 14 Spielern ein erhöhtes ucOsteocalcin festgestellt. Dies ist ein Hinweis auf Vitamin K2 Mangel.
Hier könnte eine Ernährungsberatung und Mikrobiom (Darm) Untersuchung erfolgen. Die Gabe von Vitamin D sollte mit K2 kombiniert werden.
Fazit
- Vitamin K2 spielt neben seiner Wirkung für die Knochengesundheit vermutlich auch eine wichtige Rolle beim Schutz der Arterienwände vor Verkalkung.
- Vitamin K2 als MK7 in der trans-Form scheint die beste Form der Supplementierung.
- Keine Gabe von Vitamin K unter einer medikamentösen Therapie mit Vitamin-K-Antagonisten.
- Bestimmung von Vitamin K2-Spiegelbestimmung im Blut ist zur Statusanalyse ungeeignet.
- Erhöhte Werte des ucOsteocalcins deuten auf einen absoluten und/oder funktionellen Vitamin K2-Mangel hin. (Einige Autoren empfehlen auch, Quotienten aus ucOsteocalcins/ gesamten Claciotonin oder ucOsteocalcins /cCaciotonin zu bestimmen).
- Vor allem dann ist bei Vitamin D Gabe diese kombiniert mit K2 zu empfehlen.
- Vitamin K2 wirkt sich positiv bei Diabetes aus.
- Es gibt Hinweise auf verbesserte mitochondriale Funktionen und aerobe Leistungssteigerung.
Literatur
1
Conly JM, Stein K. The production of menaquinones (vitamin K-2) by intestinal bacteria and their role in maintaining coagulation homeostasis. Prog Food Nutr Sci 1992;16:307-343
2
Suttie JW. The importance of menaquinones in human nutrition. Annu Rev Nutr 1995;15:399-417
3
Booth SL. Vitamin K: food composition and dietary intakes. Food Nutr Res 2012;56
4
Okano T, Shimomura Y, Yamane M et al. Conversion of phylloquinone (vitamin K1) into menaquinone-4 (vitamin K2) in mice: two possible routes for menaquinone-4 accumulation in cerebra of mice. J Biol Chem 2008;283:11270-11279
5
Conly JM, Stein KE. The absorption and bioactivity of bacterially synthesized menaquinones. Clin Invest Med.1993;16(1):45-57.
6.
Conly JM, Stein K. The production of menaquinones (vitamin K2) by intestinal bacteria and their role in maintainingcoagulation homeostasis. Prog Food Nutr Sci. 1992;16(4):307-343.
Walther B, Chollet M. Menaquinones, Bacteria, and Foods: Vitamin K2 in the Diet. In: Gordeladze JO, ed. Vitamin K2 – Vital for Health and Wellbeing. InTech; 2017. doi:10.5772/63712
Shea M, Booth S. Concepts and Controversies in Evaluating Vitamin K Status in Population-Based Studies. Nutrients. 2016;8(1):8. doi:10.3390/nu8010008
Dam H, Schonheyder F, Tage-Hansen E, Studies on the mode of action of vitamin K. Biochem J, 1936;30:1075–1079.
10.
McKee RW, Binkley SB, MacCorquodale DW, Thayer SA, Doisy EA. The isolation of vitamins K1 and K2. J Am Chem Soc, 1939; 61: 1295.
Elke Theuwissen, Ellen C Cranenburg, Marjo H Knapen, Elke J Magdeleyns, Kirsten J Teunissen, Leon J Schurgers, Egbert Smit, Cees Vermeer. Low-dose menaquinone-7 supplementation improved extra-hepatic vitamin K status, but had no effect on thrombin generation in healthy subjects. Br J Nutr. 2012 Nov 14;108(9):1652-7. doi: 10.1017/S0007114511007185. Epub 2012 Jan 31.
12
Braam LA, Hoeks AP, Brouns F et al. Beneficial effects of vitamin K on the elastic properties of the vessel wall in postmenopausal women: a follow-up study. Thromb Haemost. 2004; 91(2): 373-380.
13
Vermeer C, Shearer MJ, Zittermann A, et al. Beyond deficiency: potential benefits of increased intakes of vitamin K for bone and vascular health. Eur J Nutr, 2004; 43(6):1-11.
14
Booth SL. Roles for vitamin K beyond coagulation. Annu Rev Nutr 2009;29:89-110
15
Karsenty G. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature
1997;386:78-81
16.
Geleijnse u. a.: Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study In: J Nutr., 2004 Nov, 134(11), S. 3100–3105, PMID 15514282
17
Fusaro M, Noale M, Viola V et al. Vitamin K, Vertebral Fractures, Vascular Calcifications, and Mortality:
VItamin K Italian (VIKI) Dialysis Study. JBMR 2012;27:2271-2278
18
Beulens JW, Bots ML, Atsma F et al. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis 2009;203:489-493
19
ChatrouML, Winckers K, Hackeng TM et al. Vascular calcification: the price to pay for anticoagulation therapy
with vitamin K-antagonists. Blood Rev 2012;26:155-166
Schurgers u. a.: Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats In: Blood, 2007 Apr 1, 109(7), S. 2823–2831, PMID 17138823
M. Vos et al. Vitamin K2 Is a Mitochondrial Electron Carrier That Rescues. Pink1 Deficiency. Science. 336, 2012, S. 1306–1310
22.
Cristina Cerqua, Alberto Casarin, Fabien Pierrel, Luis Vazquez Fonseca, Giampiero Viola, Leonardo Salviati, Eva Trevisson. Sci Rep. 2019 Apr 25;9(1):6553.doi: 10.1038/s41598-019-43014-y. Vitamin K2 cannot substitute Coenzyme Q 10 as electron carrier in the mitochondrial respiratory chain of mammalian cells.
Huei-Kai Huang, Peter Pin-Sung Liu, Jin-Yi Hsu, Shu-Man Lin, Carol Chiung-Hui Peng , Jen-Hung Wang, Jih-I Yeh, Ching-Hui Loh. Risk of Osteoporosis in Patients With Atrial Fibrillation Using Non-Vitamin K Antagonist Oral Anticoagulants or Warfarin. J Am Heart Assoc. 2020 Jan 21;9(2):e013845.doi: 10.1161/JAHA.119.013845. Epub 2020 Jan 10.
24.
Masayoshi Yamaguchi 1 , M Neale Weitzmann. Vitamin K2 stimulates osteoblastogenesis and suppresses osteoclastogenesis by suppressing NF-κB activation. Int J Mol Med. 2011 Jan;27(1):3-14.doi: 10.3892/ijmm.2010.562. Epub 2010 Nov 11.
S J Hodges , K Akesson, P Vergnaud, K Obrant, P D Delmas. Circulating levels of vitamins K1 and K2 decreased in elderly women with hip fracture. J Bone Miner Res. 1993 Oct;8(10):1241-5.doi: 10.1002/jbmr.5650081012.
26
Szulc P, Chapuy M-C, Meunier PJ et al. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest, 1993; 91(4): 1769-1774.
27
Feskanich D, Weber P, Willett WC et al. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr, 1999; 69(1): 74-79.
28
Yamauchi M, Yamaguchi T, Nawata K et al. Relationships between undercarboxylated osteocalcin and vitamin K intakes, bone turnover, and bone mineral density in healthy women. Clin Nutr, 2010; 29(6): 761-765.
29
Price PA. Role of vitamin-K-dependent proteins in bone metabolism. Annu Rev Nutr, 1988; 8: 565-583.
Z-B Huang , S-L Wan, Y-J Lu, L Ning, C Liu, S-W Fan. Does vitamin K2 play a role in the prevention and treatment of osteoporosis for postmenopausal women: a meta-analysis of randomized controlled trials. Osteoporos Int. 2015 Mar;26(3):1175-86. doi: 10.1007/s00198-014-2989-6. Epub 2014 Dec 17.
Theuwissen E, Magdeleyns EJ, Braam LA, Vitamin K-status in healthy volunteers. Food Funct, 2014; 5(2):229-234.
32
Theuwissen E, Magdeleyns EJ, Braam LA, Vitamin K-status in healthy volunteers. Food Funct, 2014; 5(2):229-234.
33
Sato T, Schurgers LJ, Uenishi K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women. Nutr J. 2012;11:93. doi:10.1186/1475-2891-11-93
34
Koitaya N, Ezaki J, Nishimuta M, et al. Effect of Low Dose Vitamin K2 (MK-4) Supplementation on Bio-Indices in Postmenopausal Japanese Women. Journal of Nutritional Science and Vitaminology. 2009;55(1):15-21. doi:10.3177/jnsv.55.15
35
Sato T, Schurgers LJ, Uenishi K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women. Nutr J, 2012; 11:93. doi: 10.1186/1475-2891-11-93
36
Theuwissen E, Teunissen KJ, Spronk HM et al. Effect of low-dose supplements of menaquinone-7 (vitamin K2) on the stability of oral anticoagulant treatment: dose-response relationship in healthy volunteers. J Thromb Haemost, 2013; 11(6): 1085-1092.
37
J I Aguayo-Ruiz , T A García-Cobián, S Pascoe-González, S Sánchez-Enríquez, I M Llamas-Covarrubias, T García-Iglesias, A López-Quintero , M A Llamas-Covarrubias, J Trujillo-Quiroz, E A Rivera-Leon. Effect of supplementation with vitamins D3 and K2 on undercarboxylated osteocalcin and insulin serum levels in patients with type 2 diabetes mellitus: a randomized, double-blind, clinical trial. Diabetol Metab Syndr. 2020 Aug 18;12:73.doi: 10.1186/s13098-020-00580-w. eCollection 2020.
38
Prasenjit Manna, Jatin Kalita. Beneficial role of vitamin K supplementation on insulin sensitivity, glucose metabolism, and the reduced risk of type 2 diabetes: A review. Nutrition. Jul-Aug 2016;32(7-8):732-9. doi: 10.1016/j.nut.2016.01.011. Epub 2016 Jan 25.
39
Yan Li, Jie Peng Chen, Lili Duan , Shuzhuang Li. Effect of vitamin K2 on type 2 diabetes mellitus: A review. Diabetes Res Clin Pract. 2018 Feb;136:39-51.doi: 10.1016/j.diabres.2017.11.020. Epub 2017 Dec 2.
40
Yoshio Suzuki, Asako Maruyama-Nagao, Keishoku Sakuraba, Sachio Kawai. Level of serum undercarboxylated osteocalcin correlates with bone quality assessed by calcaneal quantitative ultrasound sonometry in young Japanese females. Exp Ther Med. 2017 May;13(5):1937-1943. doi: 10.3892/etm.2017.4206. Epub 2017 Mar 9.
41
Bourron Olivier, Phan Franck. Vitamin K: a nutrient which plays a littleknown role in glucose metabolism. Curr Opin Clin Nutr Metab Care. 2019;22(2):174–81.
42
Razny U, Fedak D, Kiec-Wilk B, Goralska J, Gruca A, Zdzienicka A, Kiec- Klimczak M, Solnica B, Hubalewska-Dydejczyk A, Malczewska-Malec M. Carboxylated and undercarboxylated osteocalcin in metabolic complications of human obesity and prediabetes: osteocalcin in obese and prediabetic patients. Diabetes/Metab Res Rev. 2017;33(3):e2862.
43
Villafán-Bernal JR, Llamas-Covarrubias MA, Muñoz-Valle JF, Rivera-León EA, González-Hita ME, Bastidas-Ramírez BE, Gurrola-Díaz CM, Armendáriz- Borunda JS, Sánchez-Enríquez S. A cut-point value of uncarboxylated to carboxylated index is associated with glycemic status markers in type 2 diabetes. J Investig Med. 2014;62(1):33–6.
44
Xiangni Su , Wenchen Wang, Congwen Fang , Chunping Ni , Jian Zhou, Xiaohui Wang, Lei Zhang , Xiaona Xu , Rui Cao , Hongjuan Lang , Feng Wang. Vitamin K2 Alleviates Insulin Resistance in Skeletal Muscle by Improving Mitochondrial Function Via SIRT1 Signaling. Antioxid Redox Signal. 2021 Jan 10;34(2):99-117. doi: 10.1089/ars.2019.7908. Epub 2020 Aug 19.
45
Hao-Hao Zhang, Gui-Jun Qin, Xia-Lian Li, Ying-Hui Zhang, Pei-Jie Du, Peng-Yu Zhang, Yan-Yan Zhao, Jing Wu. SIRT1 overexpression in skeletal muscle in vivo induces increased insulin sensitivity and enhanced complex I but not complex II-V functions in individual subsarcolemmal and intermyofibrillar mitochondria. J Physiol Biochem. 2015 Jun;71(2):177-90. doi: 10.1007/s13105-015-0396-x. Epub 2015 Mar 18.
46
Sissel Beate Rønning, Mona Elisabeth Pedersen, Ragnhild Stenberg Berg, Bente Kirkhus , Rune Rødbotten. Vitamin K2 improves proliferation and migration of bovine skeletal muscle cells in vitro. PLoS One. 2018 Apr 4;13(4):e0195432. doi: 10.1371/journal.pone.0195432. eCollection 2018.
47
Brian K McFarlin, Andrea L Henning, Adam S Venable. Oral Consumption of Vitamin K2 for 8 Weeks Associated With Increased Maximal Cardiac Output During Exercise. Altern Ther Health Med. 2017 Jul;23(4):26-32.
48
Wu, S., Liu, S., Davis, C. H., Stafford, D. W., Kulman, J. D., & Pedersen, L. G. (2011). A hetero-dimer model for concerted action of vitamin K carboxylase and vitamin K reductase in vitamin K cycle. Journal of theoretical biology, 279(1), 143-149
49
Szterk A, Zmysłowski A, Bus K (2018) Identification of cis / trans isomers of menaquinone-7 in food as exemplified by dietary supplements. Food Chemistry 243:403–409 DOI: 10.1016/j.foodchem.2017.10.001
Autoren
ist leitender Arzt BAD Gesundheitsvorsorge und Sicherheitstechnik GmbH. Von 2011 bis 2016 und 2019 bis 2020 war er Teamarzt des SV Darmstadt 98 und von 2015–2022 Arzt im Nachwuchsleistungszentrum. Von 2022–2023 ergänzte er das medizinische Team des 1. FC Kaiserslautern in den Bereichen Ernährungsmedizin, Regeneration und Leistungsmedizin und als Mannschaftsarzt. Von 2002 bis 2014 war er medizinischer Leiter Ironman Germany und ist im wiss. Beirat der Deutschen Triathlon Union (DTU). Außerdem ist er wiss. Beirat der sportärztezeitung.




