Muskel-, Bänder- und Sehnenverletzungen sind aufgrund der Gewebeschädigung mit einem entzündlichen Prozess assoziiert, was sich in den fünf Kardinalsymptomen der Entzündung, Schmerz – Schwellung – Rötung – Erwärmung – Funktionsverlust, äußert. Die akute Entzündung
ist nichtsdestotrotz ein physiologisch wichtiger Prozess, mit dem Ziel, das geschädigte Gewebe zu reparieren, zu regenerieren und die Homöostase wiederherzustellen [1].
Die chronische, nichtaufgelöste Entzündung dagegen ist destruktiv, auch wenn sie nur schwach ausgeprägt ist, und trägt zu prominenten Erkrankungen wie Arthritis / Arthrosen, Asthma, Morbus Crohn, Parkinson und Alzheimer bis hin zu Arteriosklerose, Diabetes und Krebs bei [2]. Somit ist es nicht überraschend, dass entzündungshemmende Kortikoide und nichtsteroidale Antirheumatika (NSAR) wie Ibuprofen, Aspirin oder Diclofenac zu den am häufigsten eingenommenen Arzneistoffen gehören. Allerdings ist deren therapeutische Wirksamkeit, insbesondere bei Langezeitanwendung, oft nicht zufriedenstellend, die Nebenwirkungen wie Immunsuppression, Nierenfunktionsstörungen und Magengeschwüre sind dagegen schwerwiegend und oft Grund für das Absetzen der Medikamente [3].
Förderung der Entzündungsauflösung als neuer therapeutischer Ansatz
Um alternative Strategien der Pharmakotherapie zu entwickeln, ist die Grundlagenforschung bemüht, den Entzündungsprozess in seinen Phasen (i) Entstehung, (ii) Progression, (iii) Aufrechterhaltung, (iv) Entzündungsauflösung (= Resolution) und (v) Reparatur und Regeneration des Gewebes (Abb. 1), besser zu verstehen. Hierbei hat man erkannt, dass im Gegensatz zur klassischen Therapie mit Kortikoiden und NSAR nicht die Hemmung der Entzündung, sondern die Förderung der Entzündungsresolution eine attraktive Therapieoption darstellen könnte (Abb. 1) [4]. Für letztere stehen jedoch bislang keine zugelassene Arzneistoffe zur Verfügung. Tatsächlich dachte man lange Zeit, die Entzündungsauflösung sei ein passiver Vorgang, bei dem Entzündungsbotenstoffe wegfallen. Neue Erkenntnisse aus der aktuellen Forschung zeigen jedoch, dass die Resolution ein aktiver gesteuerter Prozess ist, an dem sogar Botenstoffe ganz entscheidend beteiligt sind [5]. Die Entzündungsresolution ist also essenziell für eine erfolgreiche Regenerationsphase und damit wichtig für die Ausheilung einer Gewebeverletzung. Doch wie ist dieser spezielle Resolutionsprozess reguliert und welche Botenstoffe und molekularen Mechanismen sind beteiligt?

Lipidmediatoren regulieren alle Phasen der Entzündung
Lipidmediatoren sind körpereigene Botenstoffe, die vorwiegend in immunkompetenten Zellen und Endothelzellen aus mehrfach ungesättigten Fettsäuren gebildet werden und an allen Phasen der Entzündung beteiligt sind, d. h. an der Entstehung, Progression, Resolution und Geweberegeneration [5, 6]. Während die omega-6-Fettsäure Arachidonsäure von Cyclooxygenasen und 5-Lipoxygenase zu entzündungsfördernden Prostaglandinen (PG) und Leukotrienen (so genannte Eicosanoide) umgewandelt werden, können aus omega-3-Fettsäuren wie Eicosapentaensäure und Docosahexaensäure mittels diverser Lipoxygenasen die so genannte specialized pro-resolving mediators (SPM) gebildet werden (Abb. 2). Diese SPM umfassen eine große Familie (derzeit 47 bekannter) entzündungsauflösender Lipidmediatoren, die in Lipoxine, Resolvine, Protektine und Maresine unterteilt und maßgeblich von 12/15-Lipoxygenasen gebildet werden. Interessanterweise haben Eicosanoide, die gleich zu Beginn der Entzündung massiv auftreten und SPM, die später im Verlauf gebildet werden (Abb. 1), meist gegensätzliche Wirkungen im Entzündungsprozess:
Eicosanoide
- induzieren Entzündung, Schmerz, Fieber und Bronchokonstriktion
- erhöhen die vaskuläre Permeabilität
- stimulieren die exzessive Phagozytenmigration und -aktivierung
- induzieren die Ausschüttung von Sauerstoffradikalen, Proteasen und Zytokinen
Die SPM dagegen
- fördern die Entzündungsauflösung und führen zur Schmerzstillung
- hemmen die massive Phagozyteneinwanderung und Ausschüttung pro-inflammatorischer Zytokine
- stimulieren die Phagozytose und die Efferozytose von apototischen Zellen und Zelltrümmern
- verbessern die Wundheilung und Geweberegeneration und sind organprotektiv
-
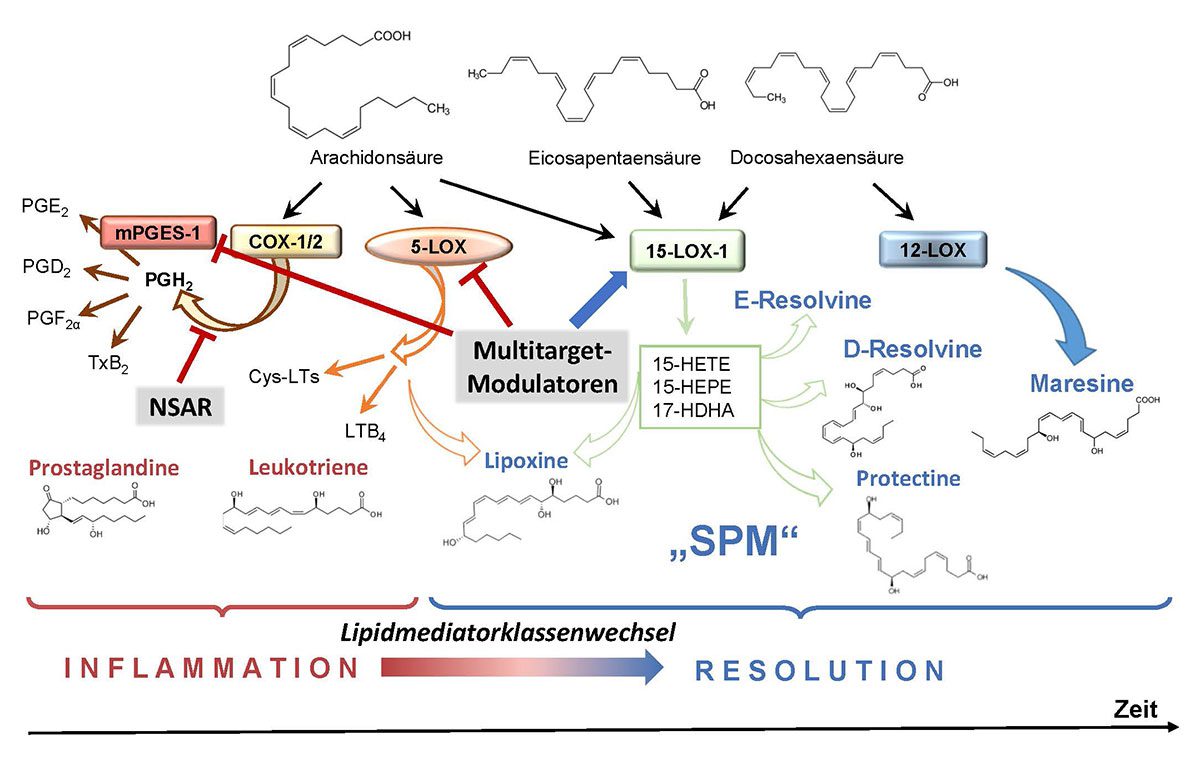
Abb. 2 Lipidmediatorbiosynthese (vereinfach) und Angriffspunkte von Wirkstoffen. Prostaglandine und Leukotriene fördern die Entzündung, während der „Lipidmediatorklassenwechsel“ zur SPM-Produktion führt und damit die Resolution einleitet. NSAR hemmen durch Blockade der Cyclooxygenasen (COX) die Bildung aller Prostglandine. Multitarget-Modulatoren hemmen gezielt die Leukotrien- und Prostaglandin E2-Bildung durch Blockade der 5-Lipoxygenase (5-LOX) und mPGES-1, und erhöhen durch Aktivierung der 15-Lipoxygenase (15-LOX) die SPM-Produktion. Dadurch wird der „Lipidmediatorklassenwechsel“ und somit die Resolution gefördert.
Trotz ihres entzündungsfördernden Charakters haben PG aber auch vorteilhafte und für die Homöostase wichtige Eigenschaften. Dazu gehören u. a. die Regulation der Thrombozytenaggregation, Broncho- und Vasodilatation, Magenprotektion, Nieren- und Uterusfunktion. Von besonderem Interesse sind die gegensätzlichen Wirkungen des PGE2 im Entzündungsgeschehen. Je nach (i) Expressionsmuster der vier PGE2-Rezeptoren in den Zielzellen, (ii) Menge an PGE2, und (iii) zeitlichem Verlauf der Entzündung, wirkt PGE2 in hohen Mengen in der frühen Entzündungsphase pro-inflammatorisch, in niedrigen Konzentrationen in der späten Phase jedoch anti-inflammatorisch und fördert die SPM-Bildung und Resolution/Geweberegenration [7]; auch die homöstatischen PGE2-Wirkungen (Magenprotektion, Nierenfunktion) werden durch niedrige Konzentrationen vermittelt [8].
Traditionelle und neue Strategien der Entzündungstherapie
Die traditionelle Entzündungstherapie mittels NSAR basiert auf Blockade der COX-1/2 und damit auf der Suppression der kompletten PG-Bildung (Abb. 2). Vor dem Hintergrund der vielfältigen Wirkungen des PGE2 stellt sich die Frage: Wie wirkt sich die Hemmung der PGE2-Biosynthese durch NSAR auf die Resolution/Regeneration aus? Experimentelle und klinische Studien zeigen, dass NSAR wie Ibuprofen, Indometacin oder Celecoxib die Entzündungsauflösung tatsächlich zurückdrängen, indem sie z. B. die Leukotrienbildung fördern und zugleich die SPM-Produktion hemmen [3, 9 – 11]. Somit können sich NSAR negativ auf die Heilung einer Gewebeverletzung auswirken. Doch welche Alternativen der pharmakologischen Entzündungsintervention gibt es, die nicht resolutionshemmend sind, sondern gezielt die Entzündungsauflösung fördern? Ein derzeit verfolgter Ansatz ist die direkte Applikation von SPM [12]. Allerdings sind SPM relativ instabil, die Herstellung in ausreichenden Mengen aufwändig sowie teuer und die zielgerichtete Anwendung (Targeting) kompliziert. Eine weitere Strategie, die Resolution durch SPMs zu fördern, besteht in der Supplementierung von omega-3-Fettsäuren (DHA und EPA) und/oder SPM-Vorstufen (18-HETE, 17-HDHA, 14-HDHA), um die endogene SPM-Bildung zu erhöhen, was jedoch mehreren klinischen Studien zufolge nicht immer gelingt; so sind die SPM-Plasmaspiegel nach DHA/EPA-Supplementierung oft unverändert [13].
Neue Strategien verfolgen die Manipulation der endogenen SPM-Bildung durch Modulation der biosynthetischen Enzyme. Hierbei versucht man mittels spezieller Wirkstoffe, die Verlagerung der Bildung von Eicosanoiden hin zu SPM (so genannter „Lipidmediatorklassenwechsel“ [7]), der mit der Resolution einhergeht, günstig zu beeinflussen (Abb. 2). Damit könnte gezielt die Ausheilung einer entzündlichen Erkrankung beschleunigt werden, ohne die NSAR-typischen Nebenwirkungen hervorzurufen [14]. Hierfür wurden bereits einige Substanzen identifiziert, wobei interessanterweise vor allem Naturstoffe und Phytopharmaka aktiv sind, was durch Aufklärung der molekularen Wirkungsmechanismen und experimenteller Studien belegt werden konnte. Das pharmakologische Prinzip besteht, im Gegensatz zu den COX-blockierenden NSAR darin, ganz gezielt jene Enzyme im Lipidmediatorstoffwechsel zu hemmen, die hohe Mengen an Eicosanoiden in der Akutphase in inflammatorischen Zellen produzieren, ohne dabei anti-inflammatorische PG (insb. PGD2 und PGE2) in der Spätphase zu erfassen und zudem die SPM-produzierenden Enzyme zu aktivieren [14]. Konkret sind dies Substanzen, welche idealerweise drei molekulare Wirkmechanismen kombinieren: Hemmung der (i) mikrosomale PGE2-Synthase-1 (mPGES-1; PGE2) und (ii) der 5-Lipoxygenase (Leukotriene) sowie (iii) Stimulation der 12/15-Lipoxygenasen (SPM) (Abb. 2). Da diese Enzyme allesamt Fettsäuren bzw. oxygenierte Fettsäuren als Substrate haben und teilweise von diesen Molekülen allosterisch reguliert werden, eignen sich so genannte Fettsäuremimetika als „Multitarget-Modulatoren“ [8].
Naturstoffe zur Förderung der Entzündungsauflösung und Regeneration
Zahlreiche klinische Studien belegen die Wirksamkeit Naturstoff-basierter Arzneimittel bei entzündlichen Erkrankungen, wie z. B. eine Metaanalyse von sechs kontrollierten Studien mit Patienten mit Kniegelenksarthrosen zeigt: ein Enzym-Flavonoid-Kombinationspräparat (Wobenzym) war hinsichtlich Wirksamkeit vergleichbar mit Diclofenac bei jedoch besserer Verträglichkeit und geringeren Nebenwirkungen [15].
Die wohl prominentesten Naturstoffe zur Entzündungsauflösung sind Boswelliasäuren (pentacyclische Triterpensäuren und damit Fettsäuremimetika) aus dem Harz von Weihrauchbäumen, die als Multitarget-Modulatoren zur Förderung des „Lipidmediatorklassenwechsel“ identifiziert wurden [16]. Weihrauchharzextrakte werden seit vielen Jahren in der Volksmedizin zur Therapie entzündlicher Erkrankungen genutzt und mehr als ein Dutzend klinischer Studien belegen die Wirksamkeit bei Osteoarthrose, rheumatoider Arthritis, chronischer Darmentzündungen und Asthma [16]. Diese entzündungshemmenden Wirkungen werden schon seit mehr als 30 Jahren mit der Modulation der Lipidmediatorbiosynthese erklärt, wenngleich die exakten molekularen Mechanismen erst seit kurzem bekannt sind. So wurde kürzlich gezeigt, dass die Leitsubstanz Acetyl-Keto-Boswelliasäure (AKBA) in der Lage ist, die 5-Lipoxygenase in entzündungsrelevanten Immunzellen durch allosterische Bindung so zu programmieren, dass die Bildung der Leukotriene inhibiert wird und das Enzym die Funktion einer 12/15-Lipoxygenase übernimmt und damit vermehrt SPM produziert [17]. Die SPM-Bildung wird in Immunzellen weiterhin verstärkt, indem AKBA an eine ganz spezielle Stelle der 15-Lipoxygenase-1 bindet und damit dieses Enzym direkt zur SPM-Bildung aktiviert [18]. Ergebnisse aus Experimenten mit Mäusen in einem Entzündungsmodell bestätigen diese Wirkweise auch im lebenden Organismus und belegen eine beschleunigte Entzündungsauflösung. Zudem wirkt die klassische Boswelliasäure zusätzlich als Inhibitor der mPGES-1 und hemmt z. B. im Peritonitismodell die überschießende PGE2-Bildung und Entzündung in Mäusen [19]. Damit sind Boswelliasäuren Prototypen der Modulation des „Lipidmediatorklassenwechsel“ und Vorbilder für weitere Wirkstoffe, die zur Förderung der Entzündungsresolution genutzt werden könnten. Tatsächlich zeigt Celastrol, eine pentacyclische Triterpensäure aus der entzündungshemmenden Wilfords Dreiflügelfrucht, ähnliche molekulare Wechselwirkungen mit der 5-Lipoxygenase und 15-Lipoxygenase-1 wie AKBA. Es supprimiert somit die Bildung der Leukotriene und stimuliert die der SPM [20]. Aber auch strukturell abweichende Wirkstoffe wie Chalkone aus der asiatischen Heilpflanze Melodorum fruticosum [21], ein Biflavonoid aus dem Kambodscha-Drachenbaum (Dracaena cambodiana) [22] oder die maßgeschneiderte synthetische Substanz BRP-201 [23] fördern den „Lipidmediatorklassenwechsel“ in menschlichen Immunzellen und im Maus-Peritonitismodell durch gezielte Multitarget-Modulation. Schließlich konnte für das zugelassene Phytotherapeutikum Traumeel® S, aus 14 vorwiegend pflanzlichen Inhaltsstoffen, u. a. aus Arnika, Hamamelis, Echinacea, Calendula und Beinwell bestehend, Resolutions-fördernde Wirkung gezeigt werden [24]. Die verschiedenen Wirkstoffe greifen an mehreren Stellen des Entzündungsprozesses ein und verbesserten das Verhältnis von Eicosanoiden zu SPM in menschlichen Zellen in vitro und im Maus-Peritonitismodell in vivo.
Fazit
Zusammenfassend bietet die zielgerichtete Modulation multipler Enzyme im Lipidmediatorstoffwechsel durch diese Wirkstoffe neue Optionen für die Entwicklung alternativer Strategien der Entzündungstherapie zu NSAR, mit dem Ziel, die Entzündungsauflösung und die Regeneration zu fördern. Und zwar ohne Nebenwirkungen der bisherigen Entzündungsblocker.
Literatur
[1] M.L. Meizlish, R.A. Franklin, X. Zhou, R. Medzhitov, Tissue Homeostasis and Inflammation, Annu Rev Immunol 39 (2021) 557-581.
[2] I. Tabas, C.K. Glass, Anti-inflammatory therapy in chronic disease: challenges and opportunities, Science 339(6116) (2013) 166-72.
[3] K.D. Rainsford, Anti-inflammatory drugs in the 21st century, Subcell Biochem 42 (2007) 3-27.
[4] C.N. Serhan, B.D. Levy, Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators, The Journal of clinical investigation 128(7) (2018) 2657-2669.
[5] C.N. Serhan, Pro-resolving lipid mediators are leads for resolution physiology, Nature 510(7503) (2014) 92-101.
[6] P.C. Calder, Eicosanoids, Essays Biochem 64(3) (2020) 423-441.
[7] B.D. Levy, C.B. Clish, B. Schmidt, K. Gronert, C.N. Serhan, Lipid mediator class switching during acute inflammation: signals in resolution, Nat Immunol 2(7) (2001) 612-9.
[8] A. Koeberle, O. Werz, Natural products as inhibitors of prostaglandin E2 and pro-inflammatory 5-lipoxygenase-derived lipid mediator biosynthesis, Biotechnol Adv 36(6) (2018) 1709-1723.
[9] D.W. Gilroy, P.R. Colville-Nash, D. Willis, J. Chivers, M.J. Paul-Clark, D.A. Willoughby, Inducible cyclooxygenase may have anti-inflammatory properties, Nat Med 5(6) (1999) 698-701.
[10] J.F. Markworth, L. Vella, B.S. Lingard, D.L. Tull, T.W. Rupasinghe, A.J. Sinclair, K.R. Maddipati, D. Cameron-Smith, Human inflammatory and resolving lipid mediator responses to resistance exercise and ibuprofen treatment, Am J Physiol Regul Integr Comp Physiol 305(11) (2013) R1281-96.
[11] M. Werner, P.M. Jordan, E. Romp, A. Czapka, Z. Rao, C. Kretzer, A. Koeberle, U. Garscha, S. Pace, H.E. Claesson, C.N. Serhan, O. Werz, J. Gerstmeier, Targeting biosynthetic networks of the proinflammatory and proresolving lipid metabolome, FASEB J (2019) fj201802509R.
[12] N. Chiang, C.N. Serhan, Specialized pro-resolving mediator network: an update on production and actions, Essays Biochem 64(3) (2020) 443-462.
[13] P.C. Calder, Eicosapentaenoic and docosahexaenoic acid derived specialised pro-resolving mediators: Concentrations in humans and the effects of age, sex, disease and increased omega-3 fatty acid intake, Biochimie 178 (2020) 105-123.
[14] N.C. Gilbert, M.E. Newcomer, O. Werz, Untangling the web of 5-lipoxygenase-derived products from a molecular and structural perspective: The battle between pro- and anti-inflammatory lipid mediators, Biochem Pharmacol 193 (2021) 114759.
[15] M. Abdel-Tawab, O. Werz, M. Schubert-Zsilavecz, Boswellia serrata: an overall assessment of in vitro, preclinical, pharmacokinetic and clinical data, Clin Pharmacokinet 50(6) (2011) 349-69.
[16] N.C. Gilbert, J. Gerstmeier, E.E. Schexnaydre, F. Börner, U. Garscha, D.B. Neau, O. Werz, M.E. Newcomer, Structural and mechanistic insights into 5-lipoxygenase inhibition by natural products, Nature chemical biology 16(7) (2020) 783-790.
[17] F. Borner, S. Pace, P.M. Jordan, J. Gerstmeier, M. Gomez, A. Rossi, N.C. Gilbert, M.E. Newcomer, O. Werz, Allosteric Activation of 15-Lipoxygenase-1 by Boswellic Acid Induces the Lipid Mediator Class Switch to Promote Resolution of Inflammation, Adv Sci (Weinh) (2022) e2205604.
[18] U. Siemoneit, A. Koeberle, A. Rossi, F. Dehm, M. Verhoff, S. Reckel, T.J. Maier, J. Jauch, H. Northoff, F. Bernhard, V. Doetsch, L. Sautebin, O. Werz, Inhibition of microsomal prostaglandin E2 synthase-1 as a molecular basis for the anti-inflammatory actions of boswellic acids from frankincense, Br J Pharmacol 162(1) (2011) 147-62.
[19] S. Pace, K. Zhang, P.M. Jordan, R. Bilancia, W. Wang, F. Börner, R.K. Hofstetter, M. Potenza, C. Kretzer, J. Gerstmeier, Anti-inflammatory celastrol promotes a switch from leukotriene biosynthesis to formation of specialized pro-resolving lipid mediators, Pharmacological Research 167 (2021) 105556.
[20] C. Kretzer, P.M. Jordan, K.P. Meyer, D. Hoff, M. Werner, R.K. Hofstetter, A. Koeberle, A.C. Peralta, G. Viault, D. Seraphin, Natural chalcones elicit formation of specialized pro-resolving mediators and related 15-lipoxygenase products in human macrophages, Biochemical Pharmacology 195 (2022) 114825.
[21] T.T. Van Anh, A. Mostafa, Z. Rao, S. Pace, S. Schwaiger, C. Kretzer, V. Temml, C. Giesel, P.M. Jordan, R. Bilancia, C. Weinigel, S. Rummler, B. Waltenberger, T. Hung, A. Rossi, H. Stuppner, O. Werz, A. Koeberle, From Vietnamese plants to a biflavonoid that relieves inflammation by triggering the lipid mediator class switch to resolution, Acta Pharm Sin B 11(6) (2021) 1629-1647.
[22] C. Kretzer, P.M. Jordan, R. Bilancia, A. Rossi, T. Gur Maz, E. Banoglu, U.S. Schubert, O. Werz, Shifting the Biosynthesis of Leukotrienes Toward Specialized Pro-Resolving Mediators by the 5-Lipoxygenase-Activating Protein (FLAP) Antagonist BRP-201, J Inflamm Res 15 (2022) 911-925.
[23] P.M. Jordan, E. van Goethem, A.M. Muller, K. Hemmer, V. Gavioli, V. Baillif, Y. Burmeister, N. Krommelbein, M. Dubourdeau, B. Seilheimer, O. Werz, The Natural Combination Medicine Traumeel (Tr14) Improves Resolution of Inflammation by Promoting the Biosynthesis of Specialized Pro-Resolving Mediators, Pharmaceuticals (Basel) 14(11) (2021).
Autoren
leitet den Lehrstuhl für Pharmazeutische Medizinische Chemie am Institut für Pharmazie der Friedrich-Schiller-Universität Jena. Er erforscht die Grundlagen der Entzündungsregulation und sucht nach neuen pharmakologischen Strategien und Wirkstoffen zur Intervention mit entzündlichen Erkrankungen.



