Der Schlaf als Quelle der Regeneration ist der Sportmedizin weitreichend bekannt. Andere Funktionen des Schlafs, wie sie für das Erlernen automatisierter Bewegungsabläufe oder für die Motivation und Performance im Breiten- und Spitzensport eine entscheidende Rolle spielen, hingegen wenig. Neueste Forschungserkenntnisse aus der Schlafphysiologie und Schlafmedizin haben zelluläre und systemphysiologische Mechanismen aufklären können, wie der Schlaf an Gedächtnis, Neuroplastizität oder Performance über die 24h-Periode beteiligt ist.
Schlaf ist ein natürlich wiederkehrender, jederzeit reversibler Zustand, der keinen einheitlichen Bewusstseinsverlust darstellt. Noch vor etwa 80 Jahren glaubte man, Schlaf sei ein passiver Zustand, in dem die Nervenzellen ihre Aktivität vermindern und im Wachen wieder erhöhen. Heute weiß man, dass Schlaf ein Zustand ist, bei dem sich Phasen der reduzierten Informationsaufnahme in einer vorhersagbaren Weise mit Phasen der aktiven Informationsverarbeitung abwechseln. Dieser Prozess ist aktiv gesteuert und – einmal angestoßen – kaum willentlich zu beeinflussen. Für den Laien steht der Schlaf für das subjektive Wohlbefinden, wissenschaftlich verbirgt sich hinter dem Wohlbefinden eine Unzahl regenerativer und aktiver Prozesse, die unverzichtbar für die Gesundheit sind und bei Störungen zu Schäden in unterschiedlichen Körperfunktionen führen.
Grundbegriffe des Schlafs
Der Schlaf wird mittels Biosignalen von Gehirn (EEG), von den Kinnmuskeln (EMG) und von den Augenbewegungen (EOG) gemessen. Anhand dieser drei Biosignale definiert man zwei unterschiedliche Schlafanteile, den Non-REM- (NREM) und den REM-Schlaf. Der REM-Schlaf zeichnet sich durch rasche Augenbewegungen (rapid-eye movements; REM), einem niedrigen Muskeltonus und lebhafte Träume aus. Der NREM-Schlaf wird zusätzlich in drei Unterstadien N1-N3 eingeteilt. N1 entspricht einem oberflächlichen und N2 einem mittleren Schlaf, N3 bezeichnet Tiefschlaf. Sowohl die NREM- wie auch die REM Schlafstadien haben eine festgelegte Abfolge, aus der ein Hypogramm erstellt wird (Abb. 1). Die Abfolge von NREM-REM Schlaf wird Schlafzyklus genannt, der relativ genau 90 Minuten dauert. Der gesunde Schlaf ist in vier bis fünf NREM-REM Zyklen organisiert, wobei Tiefschlaf zu Beginn der Nacht und REM-Schlaf vor allem in den Morgenstunden auftritt.

Die Regulation des Schlaf-Wach Rhythmus
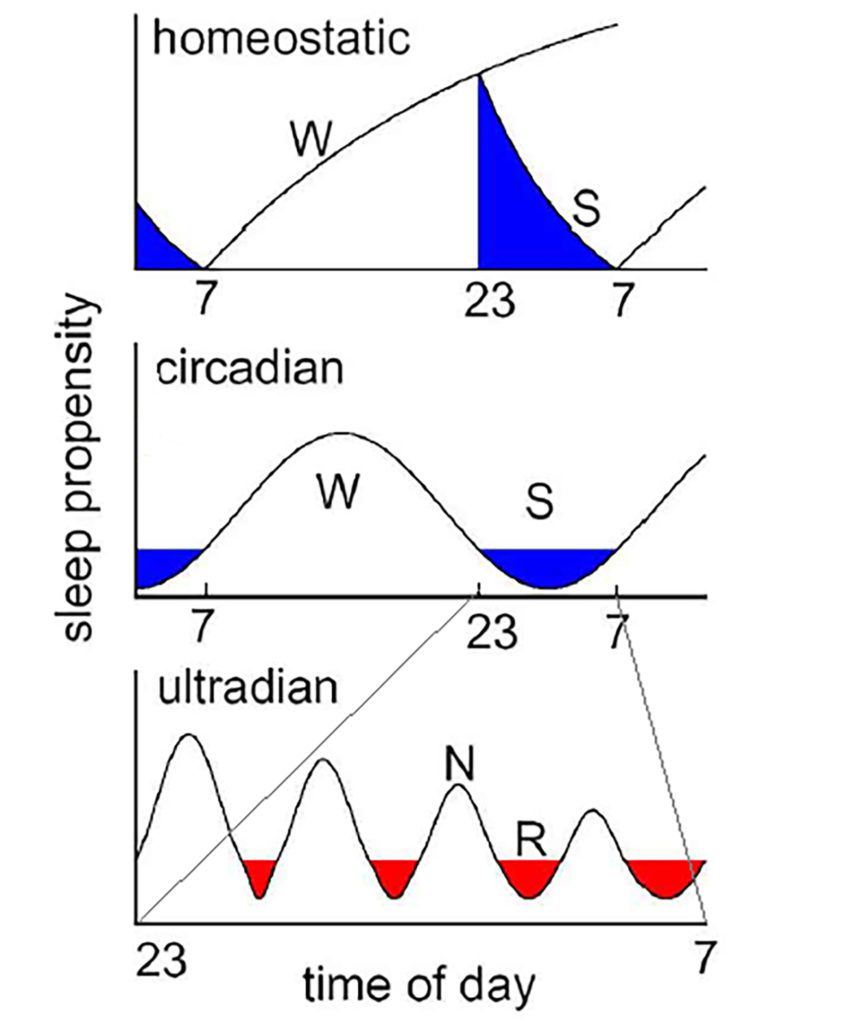
Der Schlaf-Wach Rhythmus wird durch drei Hauptprozesse gesteuert, von denen zwei aus sich selbst generierenden Rhythmen – im 24-h- und im 4-h Bereich bestehen [1]. Der 24h Rhythmus wird zirkadian („zirka“= etwa“, „dian“ = Tag) und der 4h Rhythmus ultradian genannt. Die dritte Komponente spiegelt einen homeostatischen Prozess der Schlafregulation wieder. Der wichtige zirkadiane 24h Prozess ist eng mit dem Begriff Chronobiologie verbunden. Die Chronobiologie bezieht sich auf sämtliche zelluläre und systemphysiologische Vorgänge des Körpers, die sich selbsterhaltend alle 24h wiederholen [2]. Beispiele sind neben dem Schlaf, sinusoidale Schwankungen der Körperkerntemperatur, zyklische Hormonausschüttungen oder periodische transkriptionale Proteinregulationen. Der Ursprung des zirkadianen Rhythmus ist in jeder einzelnen Körperzelle verankert und genetisch determiniert. Die Maschinerie befindet sich im Zellkern und besteht aus komplexen Transkriptions- / Translationsprozessen, die nachts bestimmte Gene (z. B. sogenannte „per“ Gene, von „period“ abgeleitet) transkribiert und in das Zellplasma befördert, um dort tagsüber zelluläre Vorgänge zu steuern und nachts über eng verkettete feedback loops zurück im Zellkern sich selbst zu hemmen [3]. Die in jeder Zelle vorkommenden zirkadianen Rhythmen werden von einer Master Clock im Gehirn im Ncl. suprachismaticus (SCN) gesteuert, ähnlich einem Dirigent eines großen Orchesters. Der zweite, ultradiane Rhythmus ist in den zirkadianen Rhythmus eingebettet. Im Schlaf ist der ultradiane Rhythmus für die reguläre Abfolge von NREM-REM Zyklen verantwortlich. Die homeostatische Komponente der Schlafregulation ist als Zunahme der Einschlafneigung („Schlafdruck“) während der Wachphase und dessen Abbau während der Schlafzeit konzipiert und wird im Folgenden näher erläutert.
Homeostatische Schlafregulation
Homeostase beschreibt die Eigenschaft eines Systems, seine Zustände stabil halten zu können. Viele lebenswichtige biologische Vorgänge sind homeostatisch reguliert und ermöglichen es dem Körper, Abweichungen in bestimmten Grenzen konstant zu halten. Die homeostatische Schlaf-Wach Regulation bezieht sich auf die Fähigkeit des Gehirns, einen vorübergehenden Verlust von Schlaf durch eine verstärkte Schlafintensität auszugleichen. Wie funktioniert dieser Mechanismus und wie kann er gemessen werden? Die bereits erwähnten Schlafstadien sind durch typische EEG Muster charakterisiert, von denen die langsamen Wellen des NREM-Schlafs für die Schlafregulation eine besondere Rolle spielen. Ein wichtiger Marker aus dem langsamwelligen Frequenzbereich (0.75 – 4.5 Hz) des NREM-Schlafs ist die slow wave sleep activity (SWA), mit deren Hilfe sich die homeostatische Schlaf- / Wachregulation bestimmen lässt [4]. Verpasst ein gesunder Mensch beispielsweise eine siebenstündigen Schlaf, so intensiviert das Gehirn den Tiefschlaf in der folgenden Erholungsnacht, indem es die Amplituden dieser langsamen Wellen erhöht und die Frequenz erniedrigt. Der Betroffene muss also in der Erholungsnacht nicht die verpasste Schlafzeit in einem 1:1 Verhältnis nachholen, sondern schläft im NREM-Schlaf (vor allem N3) intensiver.
Das 2-Prozess Modell der Schlafregulation
Im 2-Prozess Modell der Schlafregulation ist die Schlafhomeostase als einer der beiden Hauptkomponenten als „Process S” konzipiert [5] (Abb. 2). Die zweite Hauptkomponente ist der bereits erwähnte zirkadiane Rhythmus, der im 2-Prozess Modell als Prozess C bezeichnet wird. Beide Prozesse interagieren miteinander und bestimmen den individuellen Zeitpunkt und Dauer der Schlaf- und Wachzeiten. Während Prozess C weitgehend unbeeinflusst von vorangehender Schlaf und Wachzeit ist, ist die Höhe des „Process S” expotenziell proportional zur Wachzeit (Abb. 2). Konzeptionell spiegelt Process S die „Einschlafneigung“ oder den „Schlafdruck“ wider. Entsprechend steigt das Niveau von Prozess S zur verlängerten Wachzeit und fällt expotenziell während des Nachtschlafs (oder auch bei Tagesnaps) ab. In einer einfachen Analogie kann der Process S als Akku verstanden werden, der im Wachen entlädt und im Schlaf wieder aufgeladen wird. Je länger die Wachzeit andauert und je mehr Energie im Wachen verbraucht wird, desto geringer ist das verbleibende Energieniveau (desto „schläfriger“ und desto höher der Wert von Process S), desto mehr Energie muss im Schlaf wieder aufgeladen werden (desto intensiver ist der Tiefschlaf). Der Ladeprozess während des Schlafs wird ausschließlich im NREM nicht aber im REM-Schlaf ermöglicht.
Welche Funktion hat die homeostatische Schlafregulation?
Warum ist der Schlaf so exakt reguliert und warum gleichen cerebrale Prozesse ein akutes Schlafdefizit sofort und quasi automatisch aus? Beobachtungen beim Tier und beim Menschen haben gezeigt, dass die Schlafhomeostase nicht in allen Hirnarealen gleichmäßig verteilt ist, sondern die höchsten SWA Werte in den Hirnarealen zu finden waren, die tagsüber am stärksten gebraucht wurden [6, 7]. Weil die SWA Werte sich sogar experimentell steuern ließen, entstand die Hypothese, dass die Schlafhomeostase ein lokaler „use dependent“ Prozess ist. Beweisend beim Menschen waren Experimente zum impliziten motorischen Gedächtnis, wie sie auch im Sport dem Erlernen von automatisieren Bewegungsabläufen zugrunde liegen. Bei einer motorischen Lernaufgabe, die auf ein regional eng umschriebenes Kortexareal begrenzt war, fanden die Forscher in diesem Areal in der Folgenacht eine lokal erhöhte SWA [8]. Der lokale Tiefschlafbedarf war in diesem Hirnareal also besonders hoch. Komplementäre Experimente zu LTD (Long Term Depression) bzw. LTP (Long Term Potentiation), beides essenzielle Vorgänge für die Gedächtnisbildung, haben bewiesen, dass Lernen nicht nur ein zeit-, sondern ein schlafabhängiger Prozess ist [9]. Nur Probanden, die tatsächlich schliefen –und nicht nur ruhten – hatten einen Lerneffekt. Umgekehrt führte eine experimentelle Inaktivierung von Hirnarealen zur Verminderung von lokalem Tiefschlaf. Tierexperimentelle Studien zeigten zudem, dass im Tiefschlaf vermehrt metabolische und toxische Abbauprodukte aus dem Gehirn transportiert werden [10]. Zusammenfassend lassen diese Experimente folgende Konklusionen zu:
1) der homeostatisch gesteuerte Tiefschlaf ist im Gehirn nicht überall gleichmäßig verteilt, d. h. unser Gehirn schläft nachts nicht überall gleich tief. Schlaf ist vielmehr ein lokaler und nicht (nur) ein globalen Prozess.
2) weil Lernen nicht nur ein zeit-, sondern auch ein schlafabhängiger Prozess ist, muss der Tiefschlaf an plastischen Vorgängen beteiligt sein. Untersuchungen an der Fruchtfliege haben Einblicke in diese Vorgänge gegeben, weil es möglich ist, den Effekt von Schlaf an einzelnen Neuronen genau zu beobachten. Der Tiefschlaf bei Fliegen führt dazu, dass synaptische Neuronenverbindungen reduziert werden, schlafentzogene Fliegen mussten hingegen für den gleichen Lerneffekt vermehrt Synapsen bilden [11].
3) die homeostatische Erhöhung von Tiefschlaf ermöglicht die Clearance von Abbauprodukten, die sich während des Wachseins in der Zelle anhäufen und so das Gehirn vor potenziellen Schäden schützen [10].
Die Hypothese der Synaptic Homeostasis Hypothesis (SHY)
Aus diesen Erkenntnissen wurde die Hypothese der synaptischen Homeostase des Schlafs (SHE) entwickelt [12]. Nach dieser Theorie ist eine wichtige Funktion des Schlafs, synaptische Verbindungen, welche tagsüber im Überfluss entstehen, nachts effizient zu gestalten. Bestimmte synaptische Verbindungen werden verstärkt, unwichtige Synapsen abgebaut [13]. Molekularbiologische und genetische Studien konnten die massiven Veränderungen synaptischer Marker und genetischer Expressionen im Schlaf bestätigen [14]. Offenbar benötigt das Gehirn für diese Vorgänge den Schlaf als einen Zustand der relativen Abgeschiedenheit, in dem keine weiteren externen Stimuli verarbeitet werden. Da synaptische Verbindungen dem Körper sehr viel Energie kosten, ist der Abbau von überflüssigen Synapsen biologisch sinnvoll und energetisch lebenswichtig [15].
SHY auch für die Hirnreifung wichtig
Die Reduktion überzähliger Synapsen ist auch während der natürlichen Hirnreifung im Kindes- und im Jugendalter ein wichtiger physiologischer Vorgang, der „Pruning“ genannt wird. In diesem Alter führt das Pruning zu einer massiven Reduktion der kortikalen Synapsen und zur Abnahme der Dicke der Hirnrinde. Es ist bekannt, dass der Schlafbedarf im Jugendalter massiv ansteigt. Während man früher glaubte, dass Umweltfaktoren und soziale Einflüsse dieses Schlafverhalten erklären, ist man heute überzeugt, dass biologische Vorgänge der Hirnreifung für das hohe Schlafbedürfnis verantwortlich sind. In Longitudinalstudien zum Schlafverhalten und Messung der SWA als Marker der Schlafhomeostase bei Kindern und Jugendlichen fand sich ein enger Zusammenhang zwischen der physiologischen altersabhängigen Abnahme der Hirnrinde und der SWA [16]. Ob die SWA lediglich als Marker die Hirnreifungsvorgänge widerspiegelt oder kausal damit in Verbindung steht, muss durch zukünftige Studien geklärt werden.
Chronischer Schlafmangel – die Grenzen der homeostatischen Kompensation
Die Fähigkeit des Gehirns, Schlafdefizit zu kompensieren, gerät beim chronischen Schlafmangel an ihre Grenzen, weil die SWA nicht endlos erhöht werden kann. Die Intensivierung des Tiefschlafs ist also limitiert und ab einem bestimmten individuellen Grenzwert kommt es zu zahlreichen kurz- und langfristigen Konsequenzen. Auf Verhaltensebene sind diese Konsequenzen Müdigkeit, Motivationsverlust und Leistungsminderung. Untersuchungen zu chronischem Schlafentzug beim jungen gesunden Menschen über 7 bis 14 Tage haben gezeigt, dass bereits eine experimentelle Reduktion von 4 – 6h Schlaf pro Nacht während einer Woche zu Müdigkeit und Minderung der Performance führt, die einem akuten Schlafdefizit von 24 h entspricht [17]. Eine Verlängerung von zwei Wochen experimentellem Schlafmangels entsprach gar einer Performanceleistung der Kontrollgruppe mit 72 h akuten Schlafdefizit. Interessanterweise sind die Effekte des chronischen Schlafentzugs langfristig. Während die Gruppen mit akutem Schlafdefizit ihr Leistungsdefizit nach einer Erholungsnacht weitgehend kompensieren konnten, gelang dies der Gruppe mit chronischen Schlafdefizit selbst nach drei Erholungsnächten nicht [18]. Als Erklärung hierfür werden adaptive Vorgänge genannt, die das Gehirn vor potenziellen Schäden schützt. Würde das Gehirn die Performance nicht herunterfahren, sondern unverändert aufrechterhalten, würde es mehr Energie benötigen, die aber durch den Schlafmangel nicht zur Verfügung steht. Folglich könnten irreversible Schäden entstehen. Diese adaptiven Erklärungsmodelle erscheinen plausibel, müssen allerdings noch experimentell bewiesen werden [19]. Allerdings zeigen genetische Studien bereits heute, dass ein experimenteller Schlafmangel über 6 h für eine Woche massive Veränderungen der Genexpression zur Folge hat und Gene getroffen sind, die im Metabolismus und der Stressregulation involviert sind [15].
Fazit
Die neuen Erkenntnisse zur Schlafregulation haben wichtige Einblicke in deren funktionelle Implikationen aufgezeigt. Schlaf ist für bestimmte Körperfunktionen unverzichtbar und eine beliebige Reduktion der Schlafmenge ist nicht ohne tiefgreifende Konsequenzen möglich. Neben dem NREM-Schlaf und der SWA sind auch der REM-Schlaf und weitere EEG Marker im NREM-Schlaf (wie Schlafspindeln) funktionell relevant, können aber in diesem Artikel nicht besprochen werden. Neue interventionelle Ansätze mit Stimulationsverfahren, welche Tiefschlafwellen verstärken, sind derzeit in der Entwicklungsphase. Diese Ansätze sind interessant, ihre Effekte auf die Hirn- und
Körperfunktionen jedoch noch nicht konklusiv beurteilbar.
Literatur
[1] Dijk, D.J. & Czeisler, C.A. (1995) Contribution of the circadian pacemaker and the sleep homeostat to sleep propensity, sleep structure, electroencephalographic slow waves, and sleep spindle activity in humans. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15, 3526–3538.
[2] Reppert, S.M. & Weaver, D.R. (2002) Coordination of circadian timing in mammals. Nature, 418, 935–941.
[3] Reppert, S.M. & Sauman, I. (1995) period and timeless tango: a dance of two clock genes. Neuron, 15, 983–986.
[4] Achermann, P., Dijk, D.J., Brunner, D.P. & Borbely, A.A. (1993) A model of human sleep homeostasis based on EEG slow-wave activity: quantitative comparison of data and simulations. Brain research bulletin, 31, 97–113.
[5] Borbely, A.A. (1982) A two process model of sleep regulation. Hum Neurobiol, 1, 195–204.
[6] Tinguely, G., Finelli, L.A., Landolt, H.P., Borbely, A.A. & Achermann, P. (2006) Functional EEG topography in sleep and waking: state-dependent and state-independent features. NeuroImage, 32, 283-292.
[7] Deboer, T., Vyazovskiy, V.V. & Tobler, I. (2000) Long photoperiod restores the 24-h rhythm of sleep and EEG slow-wave activity in the Djungarian hamster (Phodopus sungorus). Journal of biological rhythms, 15, 429-436.
[8] Huber, R., Ghilardi, M.F., Massimini, M. & Tononi, G. (2004) Local sleep and learning. Nature, 430, 78-81.
[9] Huber, R., Esser, S.K., Ferrarelli, F., Massimini, M., Peterson, M.J. & Tononi, G. (2007) TMS-induced cortical potentiation during wakefulness locally increases slow wave activity during sleep. PloS one, 2, e276.
[10] Xie, L., Kang, H., Xu, Q., Chen, M.J., Liao, Y., Thiyagarajan, M., O’Donnell, J., Christensen, D.J., Nicholson, C., Iliff, J.J., Takano, T., Deane, R. & Nedergaard, M. (2013) Sleep drives metabolite clearance from the adult brain. Science, 342, 373-377.
[11] Bushey, D., Tononi, G. & Cirelli, C. (2011) Sleep and synaptic homeostasis: structural evidence in Drosophila. Science, 332, 1576-1581.
[12] Tononi, G. & Cirelli, C. (2003) Sleep and synaptic homeostasis: a hypothesis. Brain research bulletin, 62, 143-150.
[13] Tononi, G. & Cirelli, C. (2012) Time to be SHY? Some comments on sleep and synaptic homeostasis. Neural Plast, 2012, 415250.
[14] Vyazovskiy, V.V., Cirelli, C., Pfister-Genskow, M., Faraguna, U. & Tononi, G. (2008) Molecular and electrophysiological evidence for net synaptic potentiation in wake and depression in sleep. Nature neuroscience, 11, 200-208.
[15] Moller-Levet, C.S., Archer, S.N., Bucca, G., Laing, E.E., Slak, A., Kabiljo, R., Lo, J.C., Santhi, N., von Schantz, M., Smith, C.P. & Dijk, D.J. (2013) Effects of insufficient sleep on circadian rhythmicity and expression amplitude of the human blood transcriptome. Proceedings of the National Academy of Sciences of the United States of America, 110, E1132-1141.
[16] Buchmann, A., Ringli, M., Kurth, S., Schaerer, M., Geiger, A., Jenni, O.G. & Huber, R. (2011) EEG sleep slow-wave activity as a mirror of cortical maturation. Cerebral cortex, 21, 607-615.
[17] Van Dongen, H.P., Maislin, G., Mullington, J.M. & Dinges, D.F. (2003) The cumulative cost of additional wakefulness: dose-response effects on neurobehavioral functions and sleep physiology from chronic sleep restriction and total sleep deprivation. Sleep, 26, 117-126.
[18] Belenky, G., Wesensten, N.J., Thorne, D.R., Thomas, M.L., Sing, H.C., Redmond, D.P., Russo, M.B. & Balkin, T.J. (2003) Patterns of performance degradation and restoration during sleep restriction and subsequent recovery: a sleep dose-response study. Journal of sleep research, 12, 1-12.
[19] McCauley, P., Kalachev, L.V., Smith, A.D., Belenky, G., Dinges, D.F. & Van Dongen, H.P. (2009) A new mathematical model for the homeostatic effects of sleep loss on neurobehavioral performance. Journal of theoretical biology, 256, 227-239.
Autoren
ist Facharzt für Neurologie und seit 2009 Leiter/Leitender Arzt Schlafmedizin an der Klinik Barmelweid, Schweiz. Zuvor war er u.a. Leiter der EEG-Abteilung, Neurologische Klinik Campus Virchow-Klinikum, Humboldt-Universität, Berlin und Oberarzt an der Neurologischen Klinik, Universitätsspital Zürich. Seine Arbeitsgebiete sind Schlafmedizin, Epileptologie und Geschäftsleitung der Klinik.