Nerven, die schmerzen. Schmerzen, die nerven.
Autologes Conditioniertes Serum (ACS) wird seit über 20 Jahren erfolgreich bei Patienten mit Sportverletzungen, Rückenschmerzen und Osteoarthritis eingesetzt. Jetzt wurde die Wirksamkeit von ACS auch bei der Behandlung von Neuropathischen Schmerzen im Tiermodell bewiesen.
ACS, das aus dem eigenen Blut hergestellt wird, wird von Sportlern gelobt, die sich bei akuten und chronischen Verletzungen behandeln lassen. Die Schmerzlinderung durch dieses orthobiologische Produkt wurde in der Vergangenheit auf die Fülle von Wachstumsfaktoren und entzündungshemmenden Zytokinen im injizierten Serum zurückgeführt. Obwohl diese Proteine die Entzündung regulieren, ist ihre Wirkungsdauer in der Regel begrenzt und erklärt nicht vollständig die längerfristigen Vorteile, die bei der klinischen Anwendung von ACS beobachtet werden. ACS scheint einen „Schalter“ umzulegen, der die Wiederherstellung der Homöostase und die Heilung des schmerzhaften Gewebes fördert. Was jedoch die genaue Ursache für diese längerfristigen Vorteile ist, blieb bisher unklar.
Um diese schmerzlindernden Mechanismen weiter zu untersuchen, entschied sich unser Team, eine durch Paclitaxel verursachte Neuropathie zu untersuchen. Dieses Chemotherapeutikum verursacht in der Regel Taubheitsgefühle, Kribbeln und Schmerzen in Händen und Füßen. Paclitaxel (PTX) stört den axonalen Transport, was zu ATP-Mangel, oxidativem Stress und mitochondrialer Schädigung führt (1). PTX provoziert auch Entzündungen und axonale Schäden im Rückenmark und in den Spinalganglien. Diese neuroinflammatorische Schädigung erhöht die Expression von Zytokinen wie IL-1β, IL-8 und TNF-α sowie von Komplement C3, was eine Glia-Aktivierung und dadurch Schmerzen verursacht. Erhöhte ROS (Sauerstoffradikale, verursacht von geschädigten Mitochondrien) und MMP13-Produktion spielen ebenfalls eine wichtige Rolle bei der PTX-Symptomatik (2). Durch ACS werden diese Dysbalancen herunterreguliert.
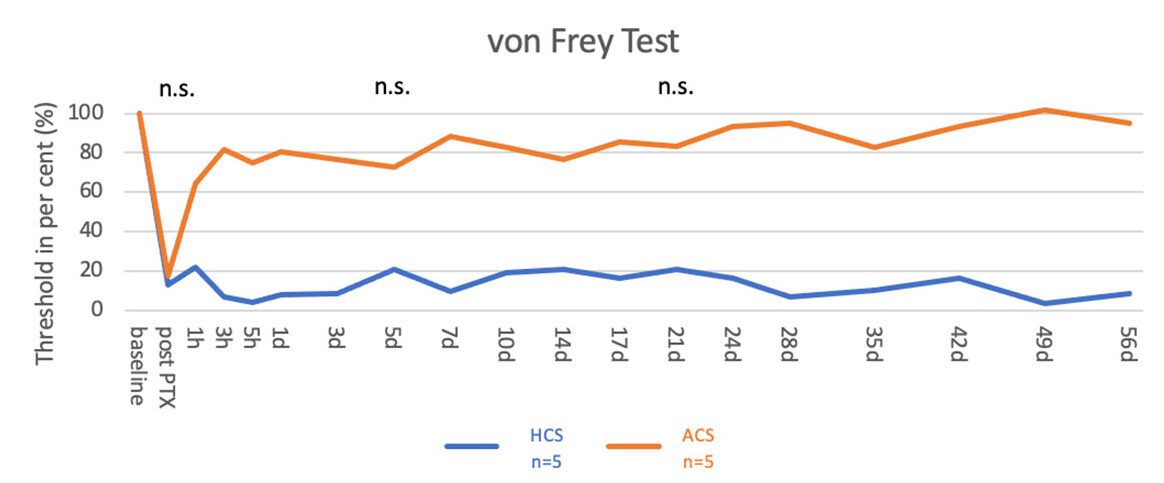
In dieser Studie wurden ACS von drei Spezies (Menschen, Ratten und Mäusen) getestet, um ihre Auswirkungen auf Tiere mit PTX-induzierter Neuropathie zu ermitteln. Durch 1 intrathekale Injektion von ACS wurden die Nervenschmerzen der Tiere schnell gelindert, die Wirkung hielt bis zum Ende der Nachbeobachtung an – weit länger als die Stunden oder Tage, die normale Schmerzmittel wirken (Abbildung 1). Die Wirkung war unabhängig von der Herkunft des ACS. Neben der schmerzlindernden Wirkung wurde bei den Tieren auch eine Verbesserung der Nervenleitgeschwindigkeit festgestellt, was auf eine Wiederherstellung der Nervenfunktion zurückzuführen ist.
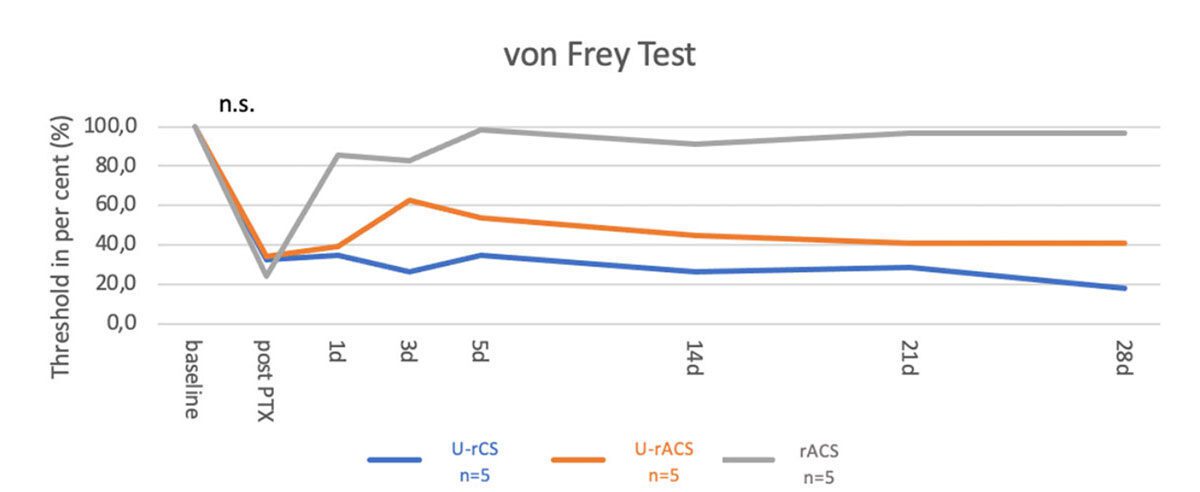
Seit Jahren ist bekannt, dass bei der Herstellung von ACS die Menge an Exosomen, extrazelluläre Vesikel mit einer Größe von 50-160 nm, erheblich zunimmt. Diese „ACS-Exosomen“ sind mit einer Vielzahl von Substanzen beladen, darunter auch microRNA, deren Rolle(n) bislang nicht klar war. Um die Rolle der Exosomen innerhalb des ACS besser zu definieren, wurden Proben ultrazentrifugiert, ein Verfahren, bei dem die Exosomen entfernt werden, aber Zytokine und Wachstumsfaktoren zurückbleiben. Das von Exosomen befreite ACS wies eine deutlich geringere Wirksamkeit auf (Abbildung 2). Somit spielen Exosomen, die mit den einzigartigen Verarbeitungsmethoden von ACS erzeugt werden, eine wichtige Rolle bei der längerfristigen Schmerzlinderung und Gewebeverbesserung. Die Definition des Profils dieser Exosomen ist nun ein Ziel, um die potenziellen zusätzlichen Vorteile dieser biologischen Therapie zu verstehen.
Bislang werden therapeutische Exosomen meist aus Stammzellen gewonnen. Man geht nämlich davon aus, dass pharmazeutisch produzierte Exosomen oder ein Stammzellen-Sekretom die medizinische Verwendung von Stammzellen selbst ersetzen könnten (4-7). Orthokine-ACS ist ein Voll-Blut-Sekretom und wird bereits seit 20 Jahren schnell und sicher hergestellt und klinisch eingesetzt. In unserem Labor ist ACS eine einfache und effiziente Quelle für therapeutische Exosomen und ist anderen Blutderivaten überlegen. ACS macht möglicherweise die Entnahme von Knochenmark/Fettgewebe oder die potenziellen Risiken allogener Zelltransplantationen überflüssig.
Die neuen mechanistischen Entdeckungen bzgl. der Wirkung von ACS/BCS ebnen den Weg für Anwendungen bei Patienten mit degenerativen, neurologischen und entzündlichen Erkrankungen und haben das Potenzial, die Zellfunktionen zu verbessern.
Da Exosomen die Fähigkeit haben, die Blut-Hirn-Schranke zu überwinden, ist dies ein neuer Erklärungsansatz für die Erfolge in den bislang 6 vorliegenden klinischen Studien zu Radikulopathien und Trigeminusneuralgie.
Diese Ergebnisse werden in der Zeitschrift Brain Behavior and Immunity veröffentlicht:
Buchheit T, Huh Y, Breglio A, Bang S, Xu J, Matsuoka Y, Guo R, Bortsov A, Reinecke J, Wehling P, Jun Huang T, Ji RR. Intrathecal administration of conditioned serum from different species resolves Chemotherapy-Induced neuropathic pain in mice via secretory exosomes. Brain Behav Immun. 2023 Jul;111:298-311. doi: 10.1016/j.bbi.2023.04.013. Epub 2023 May 5. PMID: 37150265
Thomas Buchheit ist außerordentlicher Professor in der Abteilung für Anästhesiologie in Duke und Direktor des Duke Regenerative Pain Therapies Program.
Ru-Rong Ji ist Professor in den Abteilungen für Anästhesiologie, Neurobiologie und Zellbiologie an der Duke University und Direktor des Zentrums für Translationale Schmerzmedizin.
Tony Jun Huang ist Professor für Maschinenbau und Materialwissenschaften an der Duke University und Experte für Akustofluidik, Optofluidik und Mikro-/Nanosysteme für biomedizinische Diagnostik und Therapie.
References
- Klein I, Lehmann H. Pathomechanisms of paclitaxel-induced peripheral neuropathy. Toxics. 2021;9(10):229. doi:10.3390/toxics9100229
- Cirrincione AM, Pellegrini AD, Dominy JR et al. Paclitaxel-induced peripheral neuropathy is caused by epidermal ROS and mitochondrial damage through conserved MMP-13 activation. Sci Rep. 2020;10(1):1-12. doi:10.1038/s41598-020-60990-8.
- Deuis JR, Dvorakova LS, Vetter I. Methods Used to Evaluate Pain Behaviors in Rodents. Front Mol Neurosci. 2017 Sep 6;10:284. doi: 10.3389/fnmol.2017.00284. PMID: 28932184
- Jakl V, Ehmele M, Winkelmann M et al. A novel approach for large-scale manufacturing of small extracellular vesicles from bone marrow-derived mesenchymal stromal cells using a hollow fiber bioreactor. Front Bioeng Biotechnol. 2023 Jan 24;11:1107055. doi: 10.3389/fbioe.2023.1107055. PMID: 36761296.
- Arjmand B, Alavi-Moghadam S, Rezaei-Tavirani M et al. GMP-Compliant Mesenchymal Stem Cell-Derived Exosomes for Cell-Free Therapy in Cancer. Methods Mol Biol. 2022 Dec 15. doi: 10.1007/7651_2022_467. Epub ahead of print. PMID: 36515892.
- Duan L, Li X, Xu X et al. Large-scale preparation of synovial fluid mesenchymal stem cell-derived exosomes by 3D bioreactor culture. J Vis Exp. 2022 Jul 26;(185). doi: 10.3791/62221. PMID: 35969064.
- Wright A, Snyder OL, Christenson LK et al. Effect of Pre-Processing Storage Condition of Cell Culture-Conditioned Medium on Extracellular Vesicles Derived from Human Umbilical Cord-Derived Mesenchymal Stromal Cells. Int J Mol Sci. 2022 Jul 13;23(14):7716. doi: 10.3390/ijms23147716. PMID: 35887064
Autoren
,PhD, ist außerordentlicher Professor in der Abteilung für Anästhesiologie in Duke, North Carolina, USA und Direktor des Duke Regenerative Pain Therapies Program.



