Verletzungen und Schäden des Gelenkknorpels sind oftmals mit Veränderungen des subchondralen Knochens assoziiert. Beide Gewebe sind innerhalb der osteochondralen Einheit untrennbar miteinander verbunden und unterliegen engen Wechselwirkungen [1].
Aus diesem Grund sind bei der Behandlung von Knorpelläsionen pathologische Veränderungen des subchondralen Knochens mit zu berücksichtigen. Diese treten entweder unmittelbar als Begleitschaden bei Knorpeldefekten auf oder entwickeln sich im Verlauf als Sekundärveränderungen, meist in der Folge einer chirurgischen Therapie. Solche knöchernen Pathologien umfassen einerseits Strukturstörungen des subchondralen Knochens und andererseits subchondrale Knochenmarködeme. Zu den Strukturstörungen zählen die veränderte Mikroarchitektur der kortikalen subchondralen Knochenlamelle bzw. der subartikulären Spongiosa, die Reduktion von Knochensubstanz bei der Ausbildung subchondraler Knochenzysten oder deren pathologischer Zuwachs bei der Entstehung intraläsionaler Osteophyten oder der Expansion von Knochengewebe in den Reparaturknorpel hinein. Knochenmarködeme zeigen weniger Variabilität in der radiologischen Diagnostik, weisen aber unterschiedlichste Ätiologien auf und finden sich u. a. posttraumatisch oder postoperativ, aber auch im Rahmen von Arthrose, Osteonekrose oder Insuffizienzfrakturen.
Störungen der subchondralen Knochenstruktur
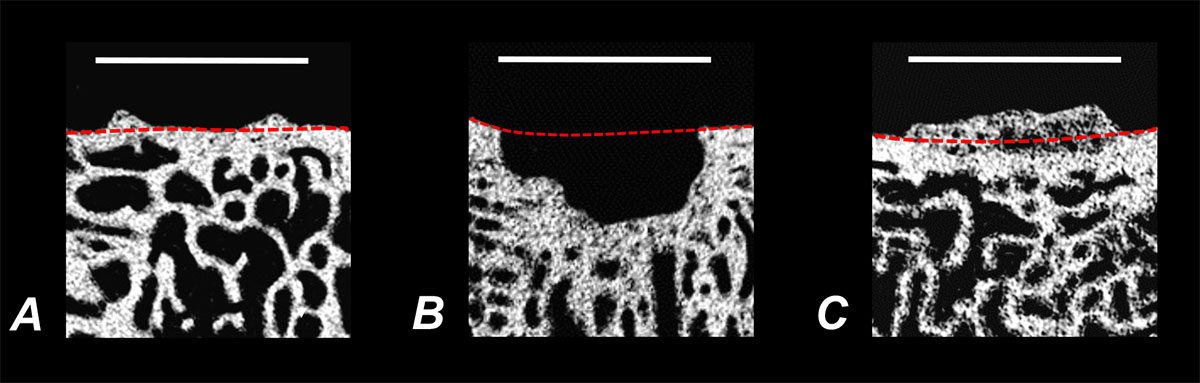
Strukturstörungen des subchondralen Knochens sind häufige Folgen knorpelchirurgischer Maßnahmen. Insbesondere die markraumeröffnenden Verfahren wie Mikrofrakturierung oder subchondrale Anbohrung (aber auch die autologe Chondrozytentransplantation) prädisponieren zu Störungen der subchondralen Knochenstruktur, Ausbildung von intraläsionalen Osteophyten oder Knochenzysten innerhalb der behandelten osteochondralen Einheit oder einer flächigen Verlagerung von Knochengewebe in die Zone des Reparaturknorpels hinein (Abb. 1). Derartige Veränderungen finden sich sowohl im Tiermodell als auch in der klinischen Situation in bis zu 75 % der behandelten Knorpeldefekte [2]. Dabei zeigen aktuelle Daten, dass bei der technischen Durchführung markraumeröffnender Verfahren die Verwendung von Instrumenten mit schmaler Spitze die Rate subchondraler Knochenpathologien signifikant reduziert und somit die Rekonstitution des subchondralen Knochens als auch die Reparatur des Gelenkknorpels verbessert [3, 4]. Interessanterweise ergeben sich bis dato aus der translationalen Forschung keine Hinweise darauf, dass die Anzahl von subchondralen Perforationen im Rahmen markraumeröffnender Verfahren die Inzidenz subchondralen Knochenzysten oder Osteophyten maßgeblich beeinflusst [5]. Präklinische Daten im Großtiermodel haben außerdem gezeigt, dass die subchondrale Anbohrung noch sechs Monate postoperativ zu umfassenden Störungen der Mikroarchitektur der subchondralen Knochenlamelle sowie der subartikulären Spongiosa führt [6]. Beispielsweise waren nach entsprechender operativer Behandlung der Mineralsalzgehalt des Knochens, dessen Relativvolumen oder die Trabekelbreite signifikant reduziert. Derartige Veränderungen führen prinzipiell zu einer reduzierten mechanischen Belastbarkeit des gelenknahen Knochens und sind bei der postoperativen Rehabilitation zu berücksichtigen; insbesondere, um die Ausbildung eines stabilen Knorpelreparaturgewebes nicht zu gefährden. In diesem Kontext wurde -ebenfalls im Tiermodell- untersucht, ob eine medikamentöse, osteoanabole Behandlung die Reparatur osteochondraler Defekte unterstützen kann. Es ließ sich zwar nachweisen, dass die hochdosierte systemische Applikation des aktiven Fragments des Parathormons (PTH [1 – 34]) Mineralsalzgehalt und Volumen des verletzen subchondralen Knochens signifikant steigert und zu einer Verbesserung der Knorpelreparatur beiträgt [7]. Gleichzeitig resultiert diese Behandlung aber in einer Früharthrose in jenen Gelenken, die zuvor keinerlei osteochondrale Veränderungen aufwiesen [8]. Eine Abhängigkeit zwischen den genannten Strukturstörungen des subchondralen Knochens und dem klinischen Behandlungsergebnis nach markraumeröffnenden Verfahren ist noch nicht abschließend gesichert. Dennoch drängt sich der Verdacht einer Kausalität insofern auf, als dass die hohen Inzidenzen der beschriebenen subchondralen Strukturstörungen Hand in Hand gehen mit den relevanten Versagensraten markraumeröffnender Verfahren, beispielsweise am Kniegelenk von bis zu 32 % 10 Jahre nach Mikrofrakturierung [9].
Ödeme des subchondralen Knochens
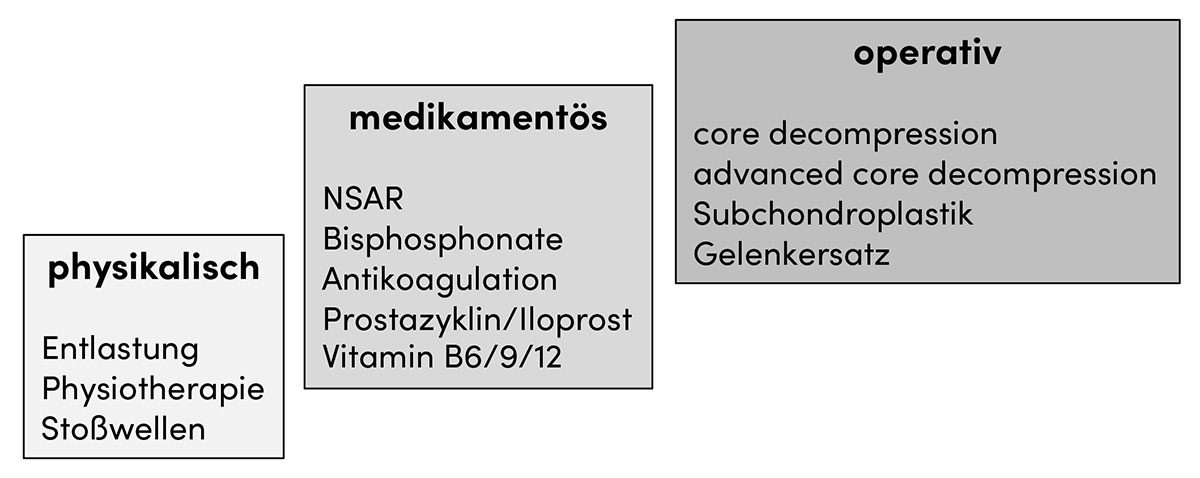
Ödeme des subchondralen Knochens stellen eine weitere Gruppe klinisch relevanter subchondraler Pathologien dar. Diese gehen initial nicht mit strukturellen Veränderungen der Knochenarchitektur einher und sind demzufolge meist nur mittels Magnetresonanztomographie (MRT) nachweisbar. Verschiedenste Ätiologien sind in der Entstehung dieser Ödeme beschrieben, darunter postoperative Veränderungen nach knorpelchirurgischen Maßnahmen, primäre Läsionen des Gelenkknorpels wie Arthrose oder chondrale und osteochondrale Defekte, aber auch Pathologien des Knochens wie Osteonekrosen (z. B. Morbus Ahlbäck), Osteochondrosis dissecans, Insuffizienzfrakturen und Inaktivitätsosteoporose [10]. In Hinblick auf die ursächlich knöchern bedingten Ödeme ist prognostisch relevant, ob eine irreversible Osteonekrose mit Kollaps der ostechondralen Einheit eingetreten ist oder ein potenziell selbstlimitiertes Knochenmarködemsyndrom (transiente Osteoporose) vorliegt (Abb. 2). Die Stufentherapie umfasst zunächst physikalische Maßnahmen wie Entlastung, Physiotherapie oder Stoßwellenbehandlung, gefolgt von medikamentösen Behandlungsansätzen mittels nicht-steroidaler Antirheumatika (NSAR), Bisphosphonaten, Antikoagulantien oder dem Prostazyklin-Analogon Iloprost. Die Option einer antikoagulativen Behandlung begründet sich in der Feststellung, dass mittlerweile über 50 verschiedene thrombophile und hypofibrinolytische Parameter als gesicherte Risikofaktoren für eine Osteonekrose oder ein Knochenmarködem identifiziert wurden [11]. Iloprost hingegen bewirkt eine gesteigerte Vasodilatation bei reduzierter Kapillarpermeabilität und Thrombozytenaggregation und wird bei der Behandlung von Knochenmarködemen off label eingesetzt. Interessanterweise kann der klinische Verlauf eines Knochenmarködems unter Iloprost-Behandlung recht verlässlich durch Bestimmung der Serumkonzentration ausgewählter Lipoproteine, vor allem des Lipoprotein A, prognostiziert werden [12]. Hierbei handelt es sich um ein Lipoprotein mit hoher molekularer Homologie zu Plasminogen, wodurch sich die Thrombogenität von Lipoprotein A erklärt. Auch dieser Zusammenhang bestätigt die klinisch relevante und therapeutisch nutzbare Wechselbeziehung zwischen Knochenmarködemen und den Mechanismen der Blutgerinnung. Lediglich bei Versagen der genannten konservativen Maßnahmen kommen in der Behandlung der Knochenmarködeme gelenkerhaltende operative Verfahren wie die Herdanbohrung (core decompression) in Betracht. Insbesondere bei bereits eingetretener Osteonekrose kann dieses Verfahren mit einer Ausräumung der Nekrosezone und Spongiosaauffüllung kombiniert werden (advanced core decompression). Die Subchondroplastik stellt ein neuartiges Behandlungskonzept mit minimalinvasiver Injektion von Kalziumphosphat in die Ödemzone des subchondralen Knochens dar, bedarf zum jetzigen Zeitpunkt jedoch noch weiterführender wissenschaftlicher Überprüfung aufgrund fehlender hochqualitativer wissenschaftlicher Evidenz [13]. Gelenkersetzende orthopädisch-chirurgische Verfahren stehen letztlich am Ende der Behandlungskette (Abb. 3).

Literatur
[1] Henning Madry, Niek van Dijk, Magdalena Mueller-Gerbl. The basic science of the subchondral bone. Knee Surg Sports Traumatol Arthrosc 2010, 18(4):419-33.
[2] Patrick Orth, Magali Cucchiarini, Dieter Kohn, Henning Madry. Alterations of the subchondral bone in osteochondral repair–translational data and clinical evidence. Eur Cell Mater 2013, 25:299-316.
[3] Mona Eldracher, Patrick Orth, Magali Cucchiarini, Dietrich Pape, Henning Madry. Small subchondral drill holes improve marrow stimulation of articular cartilage defects. Am J Sports Med 2014, 42(11):2741-50.
[4] Patrick Orth Julia Duffner, David Zurakowski, Magali Cucchiarini, Henning Madry. Small-Diameter Awls Improve Articular Cartilage Repair After Microfracture Treatment in a Translational Animal Model. Am J Sports Med 2016, 44(1):209-19.
[5] Niklas Stachel, Patrick Orth, David Zurakowski, Michael D. Menger, Matthias W. Laschke, Magali Cucchiarini, Henning Madry. Subchondral Drilling Independent of Drill Hole Number Improves Articular Cartilage Repair and Reduces Subchondral Bone Alterations in Adult Sheep Compared to Debridement. Am J Sports Med 2022 [accepted for publication].
[6] Patrick Orth, Lars Goebel, Uwe Wolfram, Mei Fang Ong, Stefan Gräber, Dieter Kohn, Magali Cucchiarini, Anita Ignatius, Dietrich Pape, Henning Madry. Effect of subchondral drilling on the microarchitecture of subchondral bone: analysis in a large animal model at 6 months. Am J Sports Med 2012, 40(4):828-36.
[7] Patrick Orth, Magali Cucchiarini, David Zurakowski, Michael D. Menger, Dieter Kohn, Henning Madry. Parathyroid hormone [1-34] improves articular cartilage surface architecture and integration and subchondral bone reconstitution in osteochondral defects in vivo. Osteoarthritis Cartilage 2013, 21(4):614-24.
[8] Patrick Orth, Magali Cucchiarini, Stefan Wagenpfeil, Micheal D. Menger, Henning Madry. PTH [1-34]-induced alterations of the subchondral bone provoke early osteoarthritis. Osteoarthritis Cartilage 2014, 22(6):813-21.
[9] Patrick Orth, Liang Gao, Henning Madry. Microfracture for cartilage repair in the knee: a systematic review of the contemporary literature. Knee Surg Sports Traumatol Arthrosc 2020, 28(3):670-706.
[10] Elizaveta Kon, Mario Ronga, Giuseppe Filardo, Jack Farr, Henning Madry, Giuseppe Milano, Luca Andriolo, Nogah Shabshin. Bone marrow lesions and subchondral bone pathology of the knee. Knee Surg Sports Traumatol Arthrosc 2016, 24(6):1797-814.
[11] Patrick Orth, Konstantinos Anagnostakos. Coagulation abnormalities in osteonecrosis and bone marrow edema syndrome. Orthopedics 2013, 36(4):290-300.
[12] Konstantinos Anagnostakos, Patrick Orth. Role of serum lipoprotein at the site of iloprost therapy in the treatment of painful bone marrow edema. Orthopedics 2013, 36(10):e1283-9.
[13] Darshan S Angadi, Dennis Edwards, Joel T. K. Melton. Calcium phosphate injection of symptomatic bone marrow lesions of the knee: what is the current clinical evidence? Knee Surg Relat Res 2020, 32(1):4.
Autoren
ist Leitender Oberarzt der Klinik für Orthopädie und Orthopädische Chirurgie des Universitätsklinikums des Saarlandes sowie Mitarbeiter am Zentrum für Experimentelle Orthopädie der Universität des Saarlandes. Sein wiss. Interesse gilt osteochondralen Reparaturprozessen mit Fokus auf den subchondralen Knochen während er seine klinische Tätigkeit vor allem der Tumororthopädie und Endoprothetik widmet.
ist Inhaber des Lehrstuhls für Experimentelle Orthopädie und Arthroseforschung der Universität des Saarlandes. Sein klinisches und wiss. Interesse gilt der Reparatur von Gelenkknorpel und subchondralem Knochen. Er ist u.a. Herausgeber der Zeitschrift „Osteoarthritis and Cartilage open“, Vorstandsmitglied der OARSI und Präsident der Sektion Grundlagenforschung der DGOU.



