Die Anwendungshäufigkeit von Plättchenreichem Plasma, PRP, zur Unterstützung von heilungs- und/oder wachstumsfördernden Prozessen erfährt seit zwei Dekaden einen rasanten Anstieg. Diese Entwicklung geht einher mit der fachgebietsübergreifend zunehmenden Aufmerksamkeit bezüglich der Aspekte der Regenerativen Medizin. Ziel dieses Artikels ist, einen kurzgefassten Überblick über grundlegende Aspekte in der „PRP-Welt“ zu geben.
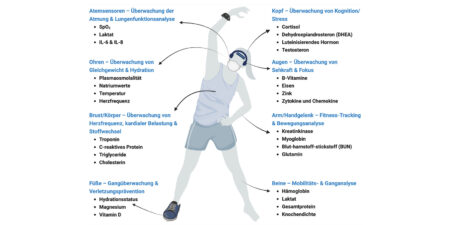
In nahezu sämtlichen medizinischen Fachgebieten (Abb. 1) wird mittlerweile PRP zur autologen Re-Infusion – ein herstellungserlaubnisfreies Arzneimittel (Bei PRP handelt es sich grundsätzlich um ein herstellungserlaubnisfreies Arzneimittel i.S.d. § 2 Abs. 1 AMG. PRP ist darüber hinaus eine Blutzubereitung i.S.v. § 4 Abs. 2 AMG bzw. ein Blutprodukt i.S.v. § 2 TFG.) – aufgrund der nachgewiesenen bioregenerativen Wirkung erfolgreich zur Behandlung verletzter Gewebe insbesondere mit niedrigem intrinsischem Heilungspotential eingesetzt.

Abb. 1: Das Einsatzspektrum von PRP, die Kombination aus den im Plasma in hoher Konzentration vorkommenden zahlreichen bioaktiven Molekülen (u.a. Fibrinogen und andere Gerinnungsmoleküle sowie essenzielle Zellnährstoffe) mit den von den Thrombozyten freigesetzten Wachstumsfaktoren sowie Zyto- und Chemokinen, wird immer breiter. Die klinischen Evidenzen, welche aufzeigen, dass der Einsatz von PRP die Regenerationsprozesse von „Kopf bis Fuß“ sinnvoll unterstützen kann, werden umfangreicher und untermauern das Konzept einer Regenerativen Medizin auf Basis autologer anabol wirkender Substanzen.
Speziell in der Sportmedizin und Orthopädie mit ihren typischen Krankheitsbildern z.B. der Tendinopathien, Pseudarthrosen und Muskelverletzungen sowie der entzündlich-degenerativen Erkrankungen des Bewegungsapparats besteht für alle Altersgruppen ein breites Spektrum von Anwendungsmöglichkeiten [1-8].
Mit seinen in erhöhten Konzentrationen aufgereinigt vorliegenden biologisch aktiven Bestandteilen (Abb. 1) kann das PRP – am Verletzungsort – gestörte, nicht oder nur verzögert einsetzende oder zu langsame Heilungsprozesse normalisieren, einleiten, oder beschleunigen. Der damit verbundene „Reset“ und/oder „Boost“ der physiologischen Prozesse soll z.B. nach Sportverletzungen eine zügige Wiederaufnahme des Trainings ermöglichen und die Sportler:innen in die Lage versetzen, schnell ein erfolgreiches „Return-to-performance“ zu erreichen.
Viele Wege führen zu einem PRP – was ein gutes PRP ausmacht
Der zelluläre Blutanteil ist aus verschieden spezialisierten Zelltypen zusammengesetzt; es koexistieren u.a. Zelltypen zur Vermittlung kataboler und anaboler Prozesse. Erst diese Vielfalt an Zellarten ermöglicht dem Blut, die unterschiedlichen biologischen Aufgaben zu erfüllen.
Durch eine Separierung des Plasmas und der anabol wirkenden Thrombozyten aus dem Blut eines Patienten wird eine Flüssigkeit mit hohem bioaktiven Potential erhalten – das PRP. Wird dieses autolog an den gewünschten Wirkort reinjiziert, kann diese dort gezielt, lokal begrenzt, reparatur- und regenerationsfördernde Prozesse mit geringem Nebenwirkungspotential aktivieren.
Es ist naheliegend, dass, um das Potential der von den Thrombozyten freigesetzten Wirkstoffe voll ausschöpfen zu können, das aufbereitete PRP möglichst arm an katabol und damit antagonistisch wirkenden zellulären Blutbestandteilen sein muss. Streng genommen besteht ein PRP ausschließlich aus dem Blutplasma und den Thrombozyten.
Für ein bestmögliches PRP ist es sinnvoll, die Thrombozyten zusammen mit dem Plasma möglichst quantitativ und sortenrein von den übrigen Blutbestandteilen, insbesondere den proinflammatorisch wirkenden Neutrophilen Granulozyten, abzutrennen und leicht aufzukonzentrieren – ohne dabei die Thrombozytenvitalität und -viabilität zu beeinträchtigen. Dies ist jedoch schwierig, da sich die im Buffy-Coat, dem nach der Zentrifugation auf den Erythrozyten locker aufliegende schmale (» 1 mm) und in sich stratifizierte Saum, befindlichen Zelltypen (sämtliche Arten von Leukozyten und die Thrombozyten – jeweils in allen Entwicklungsstadien und ggf. Untergruppen) u.a. aufgrund der nahezu identischen Dichtewerte nur aufwändig voneinander trennen lassen.
Verschiedene Herstellungsverfahren werden am Markt angeboten, um dieses Problem im Praxisalltag zu lösen; diese führen methodenbedingt zu jeweils auf Zellebene unterschiedlich zusammengesetzten PRPs mit zwangsläufig ungleicher therapeutischer Wirksamkeit – eine Tatsache, die mangels verbindlicher PRP-Nomenklatur [9] „verschleiert“ wird und dazu beiträgt, dass bei manchen Diskussionen in der PRP-Welt „Äpfel mit Birnen“ verglichen werden.
Dieser Umstand führt sicherlich auch dazu, dass es um das Thema PRP zahlreiche Kontroversen und berechtigte Kritiken gibt, die durch die unterschiedliche, ja manchmal sogar widersprüchliche, Studienlage mit uneinheitlichen Signifikanz- und Evidenzniveaus bezüglich der klinischen Effizienz von PRP [10-12] immer wieder angeheizt werden. Zu Recht wird von Ärzten und Wissenschaftlern zunehmend gefordert [13], ein noch größeres Augenmerk auf die Standardisierung der Herstellungsabläufe, die Reduktion möglicher Fehlerquellen und die richtige Auswahl des jeweiligen – zuvor z.B. durch das PAW-Klassifikationssystem (Platelets-Activation-White Blood Cells) nach DeLong [14] charakterisierte – PRP-Präparats für den klinischen Einsatz zu legen und u.a. dieses Problemfeld durch eine Konsensfindung verbindlich zu klären [3, 15-17].
Ein gutes PRP-Herstellungsverfahren sollte standardisiert ablaufen und auf intra-individueller Ebene die Herstellung eines reproduzierbaren PRP’s gewährleisten; und gleichzeitig sowohl ein reines als auch physiologisch konzentriertes Zellprofil festgelegter Zusammensetzung mit geringer Variabilität sicherstellen, um damit für die Therapie immer ein definiertes PRP-Wirkpotential bereitzustellen – „Es muss bekannt sein, was injiziert wird“.
Letzteres wird durch Herstellungsmethoden begünstigt, die auf Grund ihres physikalischen Prinzips vom Anwender unabhängig die gewünschten Zelltypen aus dem Buffy-Coat irreversibel in das Plasma abtrennen. Ein geschlossenes System ist dabei obligatorisch – es stellt sicher, dass der Laborprozess der PRP-Herstellung die regulatorischen Vorgaben, u.a. die Regeln der „Good Manufacturing Practice“, GMP, erfüllt.
Um die von einem PRP-Herstellungssystem technisch ermöglichte PRP-Qualität ausschöpfen zu können [18], müssen die jeweiligen Herstellungsanweisungen zwingend befolgt werden. „PRP“ erhält in diesem Zusammenhang die Bedeutung: „Please Respect the Protocol“.
Bei der Entscheidung für oder gegen eine PRP-Herstellungsmethode sollten daher bei der Bilanzierung auch versteckt kostenverursachende Aspekte wie z.B. „Zeitaufwand“, „Herstellungsprotokoll“, „Lernkurve“, „Standardisierungsgrad“, „Reproduzierbarkeit“, „Zellprofil“, „Fehleranfälligkeit“ und „Fehlertoleranz“, aber auch die Risikoklasse des jeweiligen Medizinprodukts, in Betracht gezogen werden (Abb. 2).

Abb. 2: Wichtige Merkmale eines PRP-Herstellungssystems. Ein zweckoptimiertes PRP ist das Ergebnis des Zusammenspiels verschiedener präzise ineinandergreifender Bausteine, deren jeweiligen Funktionalitäten und Notwendigkeiten mit höchsten Qualitätsanforderungen aufeinander abgestimmt und stabil verzahnt zu einem Prozess verbunden sind. Zu einer ganzheitlichen, umfassend standardisierten, Therapie gehören u.a. auch die hier nicht gezeigten Prozesse „Patientenvorbereitung“ (Prehabilitation), „Blutabnahme“, „Applikationstechnik“ und „adjuvante Maßnahmen“, welche ebenso aus standardisierten und miteinander verknüpften Bausteinen organisiert sein müssen, um eine letztendlich erfolgreiche Therapie zu ermöglichen.
PRP + Hyaluronsäure = Kombinationstherapie mit synergistischen Effekten
Die Applikation von autologem plättchenreichem Plasma in Verbindung mit Hyaluronsäure, HA, bietet sich überall dort an, wo gleichzeitig schmerz- und entzündungslindernde sowie regenerative Prozesse eingeleitet werden sollen. Die physiologisch gestörte und im schlimmsten Fall nicht mehr stattfindende Wundheilung wird eingeleitet, der Bereich zwischen den Zellen wird stabilisiert und die regenerativen Prozesse unterstützt [19].
Die 3D-Netzstruktur der HA-Moleküle „fixiert“ die im PRP enthaltenen Zellen und stellt als hochviskoses Gel eine „Diffusionsbremse“ für die im PRP enthaltenden Wachstumsfaktoren dar. Diese werden also erst an der Stelle freigesetzt, an der sie ihre Wirkung entfalten sollen, d.h. direkt am bzw. im Zielgebiet, wo es zusätzlich zu einer Erhöhung der Retentionszeit und damit zeitlichen Verfügbarkeit der Wachstumsfaktoren kommt. Durch die kontrolliert verlangsamte Interaktion der Wachstumsfaktoren mit ihrer Umgebung werden negative Überkonzentrationen dieser vermieden und die regenerativen Prozesse physiologisch günstig beeinflusst. Internationale Studien bestätigen die Wirksamkeit von PRP und HA (z.B.) bei der Behandlung der Knie- [20-22] und Hüftarthrose [23].
Die Hyaluronsäure sollte jedoch nicht vom Anwender dem PRP in einem zweiten Herstellungsschritt als „Extra“ zugegeben werden („offenes System“); auch wird von einer getrennten Applikation von HA und PRP („nacheinander“) abgeraten, da das für eine synergistische Wirkung benötigte Mischungsverhältnis aber auch die ebenso notwendige homogene Vermischung beider Komponenten nicht garantiert werden kann. Vielmehr sollte die Aufbereitung der Mischung – die regulatorischen Vorgaben erfüllend und die GMP-Regeln einhaltend – in einem geschlossenen System mit kontrolliert vorgelegter Hyaluronsäure als Teil des Medizinprodukts erfolgen, um idealerweise ein standardisiertes PRP ebenso standardisiert kontrolliert miteinander zu kombinieren.
Fallbeispiele „von Kopf bis Fuß“
Die folgenden Fallbeispiele (Abb. 3) vermitteln einen Eindruck über das therapeutische Potential von PRP + HA (Cellular Matrix®, Regen Lab SA, CH) ; sie belegen, dass diese Kombination als valide Option zur Behandlung verschiedener Erkrankungen bzw. Verletzungen des aktiven und passiven Bewegungsapparats gelten kann.
Das PRP gehört zur Gruppe der „P2-Bb”-PRPs [14]; die Konzentration der nicht-quervernetzten Hyaluronsäure (MW = 1.550 kDa) in der applikationsfertigen Mischung beträgt ca. 8 mg/ml.
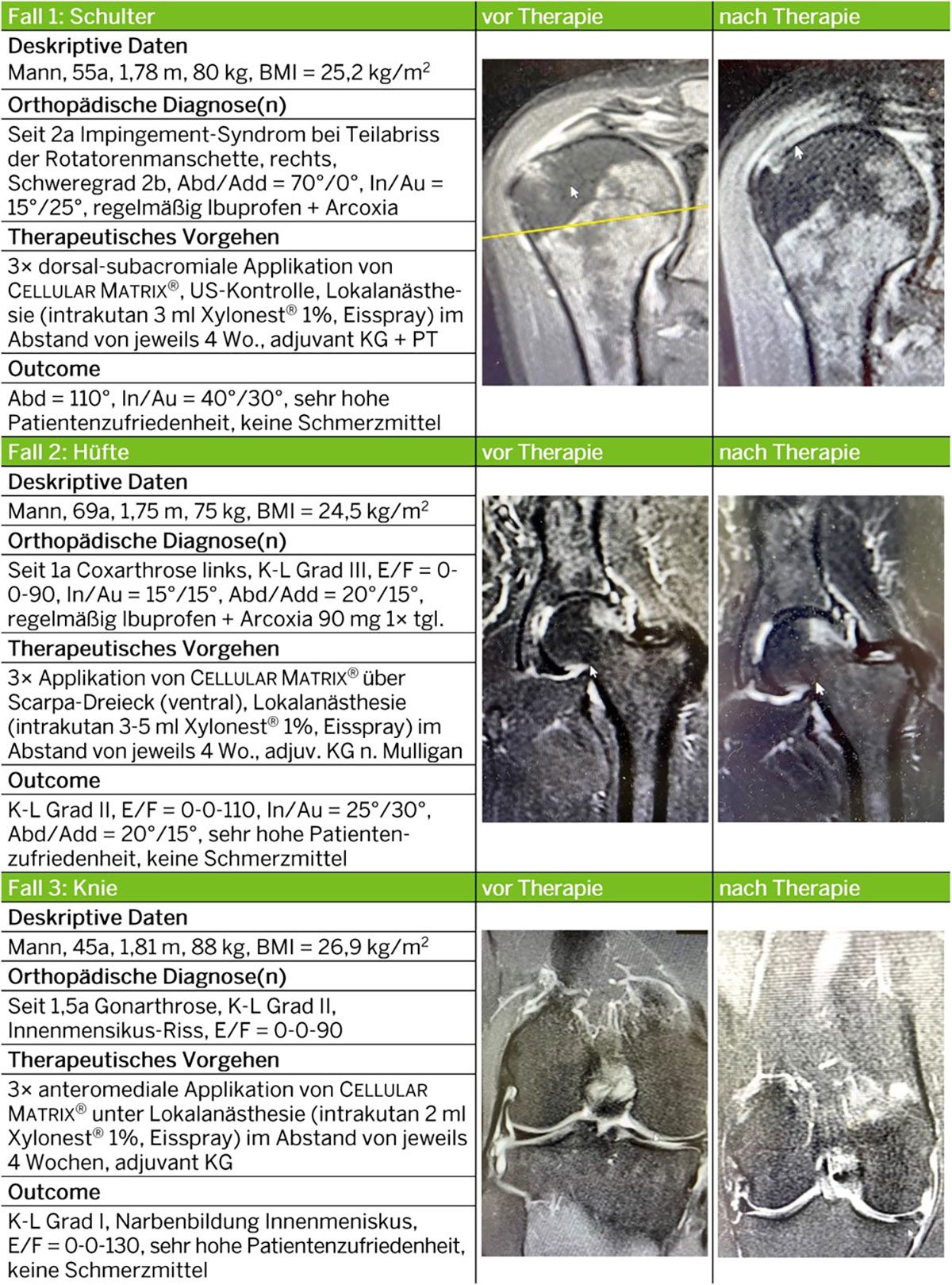
Abb. 3: Beispiele von Patienten, welche nach frustraner SOC-Behandlung durch eine Behandlung mit PRP + HA (Cellular Matrix®, Regen Lab SA, CH) signifikant profitiert haben. Der Behandlungsfortschritt ist hier jeweils durch einen Vorher-Nachher-Vergleich dokumentiert.
Fazit
Das Potential und das Indikationsspektrum von PRP ist bei weitem noch nicht ausgeschöpft; zur konsequenten Klärung der Fragen „wo“, „wann“ und „welches“ PRP „wie“ am effektivsten eingesetzt werden kann, bedarf es jedoch einer klaren und verbindlichen – idealerweise fachdisziplin-übergreifend anerkannten – Nomenklatur und Anwendungssystematik. Erst mit diesen Bewertungsgrundlagen können die Ergebnisse klinischer Studien systematisch verglichen und valide Rückschlüsse gezogen werden, welche sich letztendlich auch in den Leitlinien widerspiegeln können.
Sicher ist, dass ein frühzeitiger Einsatz eines PRP mit geeignetem Zellprofil in vielen Fällen effektiv den Heilungsprozess sportorthopädisch-sporttraumatologischer Hart- und Weichgewebeverletzungen stimulieren kann. Reha-Maßnahmen können früher eingeleitet werden, was insbesondere im Leistungssportbereich eine schnelle Wiederherstellung der Wettkampffähigkeit begünstigt.
Für bestimmte Anwendungen können mit ausgewogenen Mischungen von hochwertigem körpereigenen PRP mit seinen regenerationsfördernden Wirkstoffen und geeignet konzentrierter volumen- sowie gerüstgebender Hyaluronsäure synergistische Wirkungen erzielt werden.
Literatur
1 Belk JW, Kraeutler MJ, Houck DA, et al. Platelet-rich plasma versus hyaluronic acid for knee osteoarthritis: A systematic review and meta-analysis of randomized controlled trials. Am J Sports Med 2021; 49(1): 249-60.
2 Cook CS, Smith PA. Clinical update: Why PRP should be your first choice for injection therapy in treating osteoarthritis of the knee. Curr Rev Musculoskelet Med 2018; 11(4): 583-592.
3 Dohan Ehrenfest DM, Andia I, Zumstein MA, et al. Classification of platelet concentrates (Platelet-Rich Plasma-PRP, Platelet-Rich Fibrin-PRF) for topical and infiltrative use in orthopedic and sports medicine: current consensus, clinical implications and perspectives. Muscles Ligaments Tendons J 2014; 4(1): 3-9.
4 Grambart ST. Sports medicine and platelet-rich plasma: nonsurgical therapy. Clin Podiatr Med Surg 2015; 32(1): 99-107.
5 Leitner L, Gruber G, Lohberger B, et al. Klinische Anwendung von Platelet-rich plasma und Wachstumsfaktoren am Bewegungsapparat. Der Orthopäde 2019, 48(1):105-116.
6 Lin KY, Yang CC, Hsu CJ, et al. Intra-articular injection of platelet-rich plasma is superior to hyaluronic acid or saline solution in the treatment of mild to moderate knee osteoarthritis: A randomized, double-blind, triple-parallel, placebo-controlled clinical trial. Arthroscopy 2019; 35(1): 106-117.
7 Sampson S, Gerhardt M, Mandelbaum B. Platelet-rich plasma injection grafts for musculoskeletal injuries: a review. Curr Rev Musculoskeletal Med 2008; 1(3-4): 165-174.
8 Tischer T, Bode G, Buhs M, et al. Platelet-rich plasma (PRP) as therapy for cartilage, tendon and muscle damage – German working group position statement. J Exper Orthop 2020; 7: 64.
9 Dohan Ehrenfest DM, Bielecki T, Mishra A, et al. In search of a consensus terminology in the field of platelet concentrates for surgical use: platelet-rich plasma (PRP), platelet-rich fibrin (PRF), fibrin gel polymerization and leukocytes. Curr Pharm Biotechnol 2012; 13(7): 1131-7.
10 Arora G, Arora S. Platelet-rich plasma-Where do we stand today? A critical narrative review and analysis. Dermatol Ther 2021; 34(1): e14343.
11 Dhillon RS, Schwarz EM, Maloney MD. Platelet-rich plasma therapy – future or trend? Arthritis Res Ther 2012; 14(4): 219.
12 Mishra A, Pavelko T. Treatment of chronic elbow tendinosis with buffered platelet-rich plasma. Am J Sports Med 2006; 34(11): 1774-8.
13 Chahla J, Cinque ME, Piuzzi NS, et al. A call for standardization in platelet-rich plasma preparation protocols and composition reporting: A systematic review of the clinical orthopaedic literature. J Bone Joint Surg Am 2017; 99(20): 1769-1779.
14 DeLong JM, Russell RP, Mazzocca AD. Platelet-rich plasma: the PAW classification system. Arthroscopy 2012; 28(7): 998-1009.
15 Dohan Ehrenfest DM, Rasmusson L, Albrektsson T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol 2009; 27(3): 158-67.
16 Dohan Ehrenfest DM, Sammartino G, Shibli J, et al. Guidelines for the publication of articles related to platelet concentrates (Platelet-Rich Plasma – PRP, or Platelet-Rich Fibrin – PRF): The international classification of the POSEIDO. POSEIDO 2013; 1(1): 17-27.
17 Marx RE: Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant Dent 2001, 10: 225-228.
18 Dohan Ehrenfest DM, Pinto NR, Pereda A, et al. The impact of the centrifuge characteristics and centrifugation protocols on the cells, growth factors, and fibrin architecture of a leukocyte- and platelet-rich fibrin (L-PRF) clot and membrane. Platelets, 2018; 29(2): 171-184.
19 Berndt S, Carpentier G, Turzi A, et al. Angiogenesis is differentially modulated by platelet-derived products. Biomedicines 2021, 9(3): 251.
20 Aw AAL, Leeu JJ, Tao X, et al. Comparing the efficacy of dual platelet-rich plasma (PRP) and hyaluronic acid (HA) therapy with PRP-alone therapy in the treatment of knee osteoarthritis: a systematic review and meta-analysis. J Exp Orthop 2021; 8(1): 101.
21 Chen P, Huang L, Ma Y, et al. Intra-articular platelet-rich plasma injection for knee osteoarthritis: a summary of meta-analyses. J Orthop Surg Res 2019; 14(1): 385.
22 Vilchez-Cavazos F, Blázquez-Saldaña J, Gamboa-Alonso AA, et al. The use of platelet-rich plasma in studies with early knee osteoarthritis versus advanced stages of the disease: a systematic review and meta-analysis of 31 randomized clinical trials. Arch Orthop Trauma Surg 2022 Jan 19. doi: 10.1007/s00402-021-04304-1. Epub ahead of print.
23 Palco M, Rizzo P, Basile GC, et al. Short- and midterm comparison of platelet-rich plasma with Hyaluronic acid versus leucocyte and platelet-rich plasma on pain and function to treat hip osteoarthritis. A retrospective study. Gels 2021; 7(4): 222.
Autoren
ist seit über 25 Jahren Facharzt für Orthopädie und hat neben der konservativen Orthopädie schwerpunktmäßig die Traumatologie und operative Orthopädie in verschiedenen großen Kliniken erlernt und betrieben. Der Fokus seiner Privatpraxis liegt in den Bereichen Orthopädie, Sportmedizin, Chirotherapie, Physikalische Therapie und Orthopädische Operationen. Darüber hinaus betreut er regelmäßig u.a. in der Bukarester Klinik Clinica MedSport zahlreiche rumänische Spitzensportler, darunter Spielerinnen der aktuellen WTA-Tour.
ist Diplom-Mineraloge mit Schwerpunkt Geochemie, hat im Fachgebiet Geophysik promoviert und ist Privatdozent für das Fachgebiet „Klinische Biomineralisation“. Nach Jahren der Tätigkeit im F&E-Bereich ist er seit 2021 „Medical & Science Coordinator Germany“ bei der Regen Lab SA.
, M.Sc. Nach seiner Ausbildung zum Biologisch-Technischen Assistenten, einem Studium der Bio-, Medizin-, und Pharmawissenschaften mit einem Abschluss zum M.Sc. im Bereich der Mikrobiologie, sowie einem Forschungsjahr im Bereich Molekulare Medizin und Pathologie an der Universität Auckland, unterstützt er seit 5 Jahren als „Business & Product Associate“ in Europa die Regen Lab SA mit seinem breitgefächerten biologischen Fachwissen.