Regenerative Medizin (lat. (re)-generare: „wieder-erschaffen“) zielt darauf ab, krankes oder verletztes Körpergewebe neu zu bilden, mit dem Ziel, ein Gewebe zu schaffen, welches vergleichbare biologische Eigenschaften mit gesundem Gewebe aufweist. Dies steht einem traditionellen Ansatz der „Reparatur“ (lat. (re)-parare: „wieder – bereiten“) entgegen, bei dem versucht wird, krankes oder verletztes Gewebe wieder funktionsfähig zu bekommen, ohne das Gewebe in Qualität und Quantität im Sinne einer restitutio ad integrum wiederherzustellen, was oft zum langfristigen Fehlschlag und beispielsweise zum künstlichen Gelenkersatz führt. Die regenerative Medizin versucht hier durch biotechnologische Verfahren, biologische Methoden sowie Stimulation und Modulation der natürlichen Heilung, verbesserte Ergebnisse zu erzielen und die Gewebehomöostase, sowie Mechanismen der Adaptationsfähigkeit und Selbstheilung wiederherzustellen.
Orthopädie und Regenerative Medizin
Die Translation präklinischer Ergebnisse aus regenerativer Forschung in anwendbare Produkte ist langsam. Gründe dafür reichen von Zulassungsproblemen, ethischen Diskussionen über Lücken im wissenschaftlichen Verständnis bis hin zu psychosozialen Problemen. Dennoch kann die Orthopädie als Pionier in der klinischen Anwendung regenerativer Medizin-Produkte betrachtet werden.
Die Orthopädie und Traumatologie stellt ein weites Feld der Regenerativen Medizin mit der Wiederherstellung von Strukturen des Bewegungsapparates – wie zB: Meniskus, Knorpel, Knochen, Bandscheibe – dar.
In der Sportorthopädie gewinnt die Regenerative Medizin angesichts der Verletzungshäufigkeiten von Sportlern zunehmend an Bedeutung. Sie inkludiert einerseits das Tissue Engineering, wobei kultivierte Zellen verschiedener Ressourcen auf Trägersubstanzen und Beigabe von Wachstums-faktoren die die Geweberegeneration unterstützen sollen. Andererseits auch die Verwendung von komplexen Blutderivaten, wie Plättchenkonzentrate oder Zellkonzentrate mit hohem Anteil an mesenchymalen Stammzellen aus Knochenmark oder Fettgewebe, sowie auch Anwendung von Einzelfaktoren, wie Vesikel oder small molecules die in die Heilungs- und Regenerationskaskaden eingreifen. Die Methoden zeigen ein niedriges Nebenwirkungsprofil und sind oft besser verträglich als traditionelle Schmerz- und Entzündungshemmer, die noch dazu rein symptomatisch wirken und kein regeneratives Potential unterstützen. Gerade in der Sportmedizin ist das natürliche Regenrationspotential der meist jüngeren Patienten hoch und sollte intensiver beforscht werden.
Allgemeine Strategien der Regenerativen Medizin
Regenerative Strategien im Allgemeinen benötigen 4 Eckpfeiler:
- Zellen
- eine unterstützende Matrix (Biomaterial)
- Signale zur Gewebe- und Zelldifferenzierung
- sowie Umgebungsfaktoren, wie biomechanische Stimuli.
Zellen und deren Quellen
Der erste Eckpfeiler für Anwendungen der Regenerativen Medizin sind Zellen. Autologe Zelltransplantate sind – wie bei der autologen Knorpelzelltransplantation – bereits im Einsatz. Die Evidenzlage der ACT hat sich deutlich verbessert und es liegen randomisierte Studien vor, die die klinische Effizienz der Methode beim isolierten Knorpeldefekt bioptisch als auch im MRT durch die Wiederherstellung der knorpeligen Gelenkoberfläche bestätigen. Langfristige Untersuchungen mit einem Nachuntersuchungszeitraum von bis zu 20 Jahren haben auch die Nachhaltigkeit der ACT bestätigt.
In ungefähr 75 % der Fälle gelingt es die Morphologie des Gelenkknorpels annährend zu regenerieren, was auch die langfristige Haltbarkeit unterstützt und im Vergleich zur Mikrofrakturierung vor allem über die Fünfjahresgrenze hinaus bessere Ergebnisse liefert. Die alleinige Blutungsinduktion durch Mikrofrakturierung führt einerseits zu Reparaturgewebe aus fibrösem Mischgewebe und zeigt in neueren Studien oft zunehmende Knochenbildung im Defekt, die das darüber liegende Knorpelgewebe ausdünnt und letztendlich zum Fehlschlag führt.
Dieser Umstand zeigt eindrucksvoll, dass Reparaturmethoden, wie die Mikrofrakturierung kurzfristige, klinische Erfolge bringen, aber nicht in der Lage sind den Knorpeldefekt nachhaltig zu heilen. Daher sind vor allem größere Defekte unbedingt einer Zelltransplantation zuzuführen, nicht zuletzt, weil die Mikrofrakturierung auch langfristig das Ergebnis jeder nachfolgenden Knorpeloperation verschlechtert. Trotz dieser Erfolge der ACT ist der logistische und administrative, sowie der technologische Aufwand so hoch, dass die Kosteneffizienz schwierig zu argumentieren ist. Diese kritischen Anmerkungen müssen aber immer vor dem Hintergrund des lebenslangen Gelenkerhalts und der damit verbundenen, gewonnenen Lebensqualität sowie der sozialen Gesundheitsökonomie gesehen werden.
Moderne Ansätze konzentrieren sich vermehrt auf Stammzellen oder Progenitorzellen. Bei den Stammzellen sind schon länger Knochenmarkzellen, Fettzellen und Nabelschnurblut im klinischen Einsatz; embryonale Stammzellen wären vielversprechend sind aber aus ethischen Aspekten kritisch.
Eine moderne Alternative zu embryonalen Stammzellen könnten „induced pluripotent stemcells„ (iPS) sein. Dabei handelt es sich um primär somatische Zellen, die durch Re-Programmierung zu pluripotenten Stammzellen gewandelt wurden.
Matrices
Matrices sind der zweite Eckpfeiler der Regenerativen Medizin; sie zielen in erster Linie darauf ab, ein unterstützendes Umfeld zu schaffen und eingebrachte Zellen am Defektort zu fixieren. Sie sind somit ein Gerüst, auf dem sich neues Gewebe formen kann.
Moderne Matrices geben aktiv Signale ab, um den Regenerationsprozess zu fördern –sie schaffen somit Impulse für die Regeneration, diese können biologisch, chemisch oder physikalisch sein. Wie sie diese Signale abgeben, hängt von ihrem Design ab. Moderne „smart matrices“ reagieren dabei auf Umgebungsstimuli, traditionellere Matrices, die typischerweise resorbierbar sind, geben ihre Faktoren gleich der Resorptionsrate ab. Matrices bestehen aus unterschiedlichsten natürlichen und synthetischen Materialien und sind oft Ko-Polymere aus verschiedenen Komponenten. Einerseits werden natürliche Kollagene, Hyaluronate oder Fibrin verwendet, die teilweise auch rekombinant hergestellt werden. Synthetische Biomaterialien sind Polylactide oder Polycaprolacton, aber auch Mischformen kommen zur Anwendung. Die Auswahl des Materialtyps hängt von verschiedensten Faktoren wie der Porosität, der Biokompatibilität oder der Resorptionsrate ab. Moderne Matrices können darüber hinaus eine Mikro, bzw. Nano-Struktur aufweisen oder auch individuell anatomisch angepasst gefertigt werden. Hier haben Bioprinting- Verfahren die Möglichkeit, Zellen und Wachstumsfaktoren in das individuell hergestellte Konstrukt einzuarbeiten. Um den minimalinvasiven Charakter moderner, regenerativer Ansätze insgesamt zu unterstützen sind auch vermehrt Matrices aus injizierbaren, selbsthärtenden Gels oder Pasten in Verwendung.
Signale zur Differenzierung
Den dritten Eckpfeiler für Anwendungen der Regenerativen Medizin stellen Signale bzw. morphogenetische Stimuli dar, die Zelldifferenzierungen in eine bestimmte Form provozieren. Prominentestes Beispiel dafür sind Wachstumsfaktoren wie beispielsweise transforming growth factor beta (TGF -β), der wesentlich in die Chondrogenese involviert ist. Neben anderen Stimuli wie Transkriptionsfaktoren, trophischen Faktoren oder „small active molecules“ kann auch das Umgebungsmilieu wie Hypoxie Differenzierungsprozesse einleiten.
Problem dabei bleibt oft, dass diese Faktoren kaum je systematisch, sondern meist lokal an der zu regenerierenden Stelle für Tage bis Wochen angewandt werden müssen. Die lokale Anwendung über eine längere Zeit ist das Ziel von „smart scaffolds“, die solche Faktoren „programmiert“ freisetzen. Jedoch ist bisher oft unklar, welcher Faktor genau zu welcher Zeit benötigt wird, in welcher Konzentration er appliziert werden muss und wie seine Kinetik exakt aussieht.
Ein pragmatischer Ansatz dieses Problem erst gar nicht entstehen zu lassen ergibt sich erneut bei MSCs und anderen aus dem Blut gewonnen Substanzen wie dem platelet-rich-plasma (PRP). Denn die Fülle an individuell unterschiedlichen trophischen Faktoren, die mit diesen Produkten automatisch einhergeht, erspart es dem Anwender die exakte Konzentration bzw. Isolation von Einzelfaktoren durchzuführen. Dies führt aber auch zur kritischen Betrachtung von Blutprodukten wie ACP und PRP. Die klinische Wirksamkeit konnte sowohl bei Gewebezerstörung als auch bei degenerativen Vorgängen- wie bei der Arthrose – gezeigt werden. Die Mischung aus antiinflammatorischen, immunmodulatorischen und regenerativen Faktoren kann auf die Heilungskaskade einwirken und die Gewebeheilung unterstützen. Besonders bei chronischen Pathologien ergibt das Einbringen von Blutbestandteilen die erneute Aktivierung von Heilungsvorgängen durch Freisetzung der Faktoren aus Thrombozyten (Plättchen) und durch Mikrovesikel von mesenchymalen Stammzellen und kann einen fehlgeschlagenen, chronifizierten Heilungsversuch erfolgreich wiederholen.
Mechanische Stimuli
Mechanische Stimuli stellen den vierten Eckpfeiler für den Erfolg regenerativer Methoden dar. Sie sind entscheidend für die Funktion und Entwicklung von skelettalen Strukturen. Vor allem in der initialen Differenzierungsphase aber auch in der späten Remodellingphase der Heilung spielt der mechanische Einfluss eine wesentliche Rolle. In der Rehabilitation von Knorpeldefekten spielt die Anwendung der Motorschiene zur passiven Bewegung des Gelenkes (CPM) eine wichtige Rolle. Viel Bewegen wenig Belasten ist hier die Devise und sichert eine optimale Knorpelbildung nach Zelltransplantationen. Eine interessante Anwendung zur Förderung der Knochenregeneration mittels mechanischer Stimuli stellen extra-korporale Stoßwellen (EKSTW)dar, was im Wesentlichen auch eine regenerative Maßnahme ist, um zum Erliegen gekommene Heilungsvorgänge mechanisch durch Stoßwellen neuerlich zu aktivieren.
Das Feld mechanischer Stimuli scheint ein guter Nährboden für innovative Reha-Protokolle zu sein und könnte aufgrund der oben erwähnten Mechanismen mehr in den Fokus der Regenerativen Medizin rücken.
——————————————————————————
SPEZIAL: Blut abstammende Produkte in der Regenerativen Orthopädischen Sportmedizin
Die physiologische Unterstützung Blut abstammender Produkte für die Gewebereparatur und -regeneration gewinnt bei vielen Anwendungen im Bereich der regenerativen Medizin an Aufmerksamkeit. Thrombozytenreiches Plasma (PRP) ist eines der bekanntesten Blutprodukte, das häufig als Supplement in der In-vitro-Zellkultur und für therapeutische Anwendungen verwendet wird. Die Menge an Wachstumsfaktoren und Zytokinen, die im Thrombozyten-Alphagranulat von PRP vorhanden ist, liefert alle notwendigen anabolen Faktoren, um die Vermehrung, Differenzierung und den Phänotyp von Zellen in vitro aufrechtzuerhalten. Abweichungen, die aufgrund verschiedener Herstellungssprotokolle von PRP entstehen, resultieren in einer großen Anzahl verschiedener Plättchen angereicherten Plasmaprodukte in Laboratorien weltweit.

Wissenschaftlicher Stellenwert von PRP & Co bei Sehnenverletzungen
Sehnenbeschwerden jeglicher Art stellen hohe Anforderungen an die elementaren Ebenen der Diagnostik, Therapie, Rehabilitation und Prävention und setzen häufig eine interdisziplinäre Zusammenarbeit voraus. Die Anwendung von Orthobiologica (z.B. plättchenreichem Plasma oder autologem konditionierten Plasma; PRP, ACP) hat innerhalb der letzten Dekade eine stetig wachsende Aufmerksamkeit und Anwendungshäufigkeit erfahren.
Inzwischen werden Orthobiologika und dessen Anwendungsverfahren im Kontext von Sehnenverletzungen häufig genannt. Die Ergebnisse einer aktuellen Umfrage innerhalb der AOSSM (American Orthopaedic Society for Sports Medicine) bestätigen die große Anwendungshäufigkeit im Praxisalltag. So stellen Sehnenverletzungen neben der Osteoarthrose die zweithäufigste Indikation für die Verwendung von thrombozytenangereichertem Plasma dar. In diesem Zusammenhang wird jedoch auch kritisch gesehen, dass die Verwendung weiter an Popularität gewinnt und die Indikationen für die Verwendung nicht immer auf wissenschaftlicher Evidenz und therapeutischer Wirksamkeit beruht.
Akute und überlastungsbedingte Sehnenverletzungen, mitsamt ihren funktionellen Anhangsgebilden (knöcherne Insertionsgebiete, umliegendes synoviales Gewebe, myofasciale Verbindungsstellen) gehören sportart- und altersübergreifend zu den häufigsten Verletzungen und Beschwerdebildern des Sportlers bzw. der Sportlerin.
Insbesondere die (lasttragenden) Sehnen der unteren Extremitäten (z.B. Achillessehne, Patellarsehne) sind epidemiologisch häufig betroffen. Eine große Anzahl der Verletzungen im Sport können einer überlastungsbedingten Kausalität mit oder ohne begleitende Risikofaktoren zugeordnet werden. Fundamentale Kenntnisse über die Pathogenese sind essenziell, um Schädigungsmechanismen zu verstehen und in adäquater Weise stadiengerecht und erfolgreich behandeln zu können. Auf der Grundlage nicht endgültig geklärter Hypothesen zur Ätiopathogenese ist von einer Interaktion veränderter Stoffwechselaktivität (u.a. Tenozytenaktivität), einer veränderten struktureller Integrität der Sehne und dem Vorhandensein von mehr oder weniger entzündlichen Stoffwechselstörungen auszugehen.
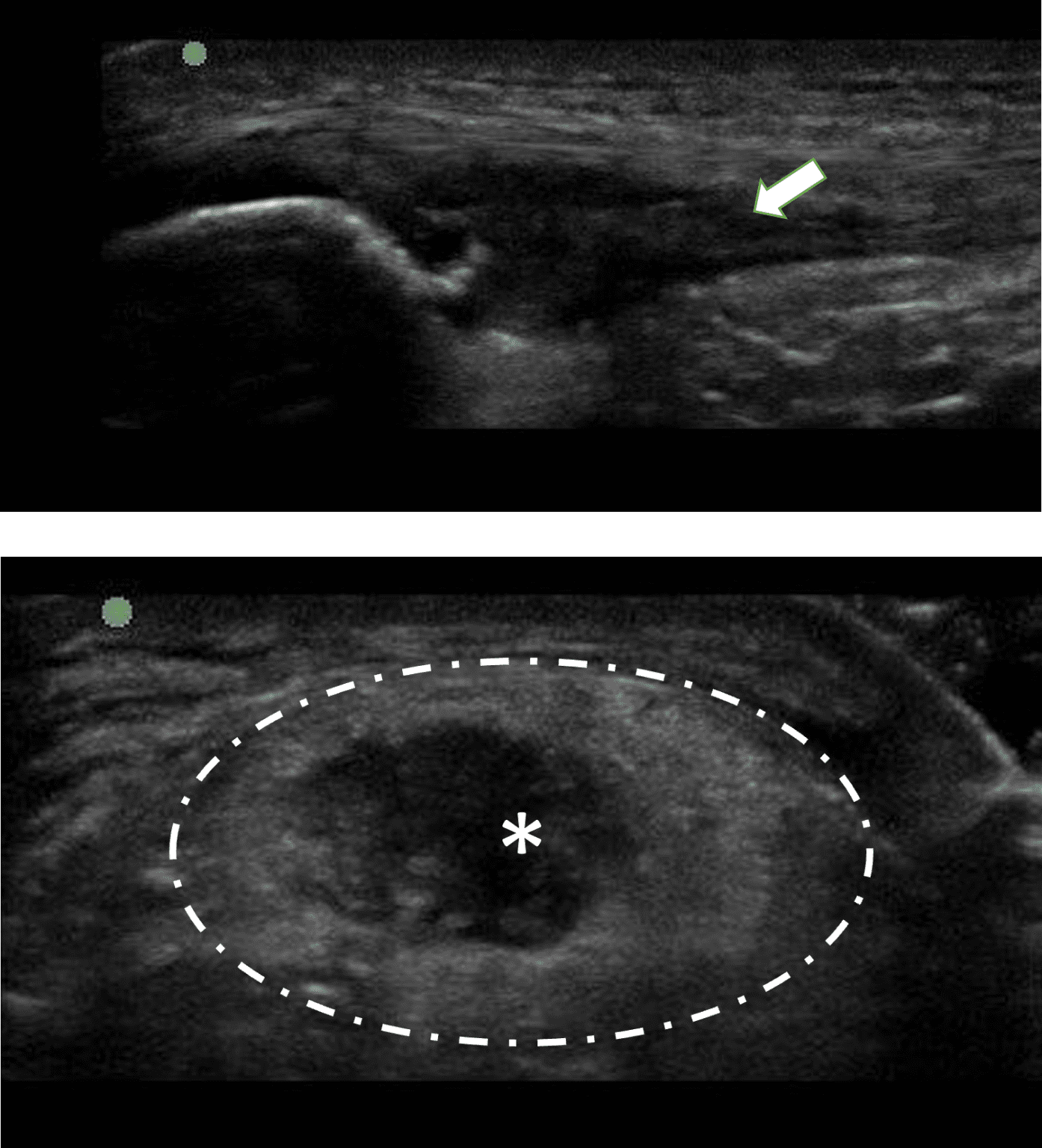
Die individuell ausgewählten Therapieverfahren haben das gemeinsame Ziel, die gestörte Sehnenfunktion klinisch zu erfassen und im Rahmen eines kontinuierlichen und progressiven Therapieprozesses zu verbessern. Eine sorgfältige Auswahl und Strukturierung der Therapieverfahren sind hierbei obligat.
Peri- oder intratendinöse Applikation bzw. Infiltration als allgegenwärtiges Verfahren in der Praxis
In der Anfangszeit von PRP & Co war die Studienlage unzureichend und konnte auf der unzureichenden methodischen Qualität der vorliegenden Studien begründet werden. Die zum Teil methodenbedingten Limitationen der vorliegenden Studien und die unterschiedlichen Gewinnungsmethoden von PRP führten zu abweichenden Zusammensetzungen und Dosierungen. Darüber hinaus sind die Anwendungs- und Nachbehandlungsprotokolle uneinheitlich und erschweren die wissenschaftliche Betrachtungsweise und damit letztlich die Beurteilung dieser Therapiemethode bis heute.
Grundsätzlich kann PRP, durch die enthaltenen Zytokine und Wachstumsfaktoren, zu einem verstärkten Entzündungs- und Heilungsprozess führen. PRP könnte daher zum richtigen Zeitpunkt und in der richtigen Aufbereitung die Geweberegeneration positiv beeinflussen; wenn Zeitpunkt und Aufbereitung jedoch nicht adäquat sind, können auch gegenteilige Effekte ausgelöst werden.
Grundsätzlich hat sich mittlerweile herausgestellt, dass die klinische Wirksamkeit von PRP sowohl vom biologischen Milieu (Anwendung additiv perioperativ vs. rein konservativ) und der Anwendungslokalisation abhängt. Es stellt sich also nicht mehr die Frage, ob PRP prinzipiell (z.B. lokalisations- und schweregradübergreifend) sinnvoll ist, sondern ob es im individuellen Behandlungsfall angewendet werden sollte.
Positive Effekte für Patellarsehne, Rotatorenmanschette, Epicondylopathia humeri radialis
Zum heutigen Zeitpunkt zeigt die wissenschaftliche Datenlage positive therapeutische Effekte, insbesondere für die Patellarsehne, Rotatorenmanschette, Epicondylopathia humeri radialis, und die perioperative Anwendung bei der Achillessehnenrekonstruktion. Für die Achillessehnentendinopathie scheint die Anwendung von PRP anderen Therapieverfahren nicht überlegen zu sein und kann nach derzeitigem Kenntnisstand nicht hinreichend empfohlen werden.
Zusammenfassung Einsatz von Orthobiologika bei Tendinopathien
- Heterogene Datenlage zur klinischen Wirksamkeit – entscheidend sind biologisches Milieu und Lokalisation
- Indikation muss lokalisationsspezifisch vorgenommen und an die zugrundeliegende Pathologie angepasst werden
- Gute Datenlage: Patellarsehne, Rotatorenmanschette, Epicondylopathia humeri radialis, AS-Rekonstruktion
- Keine Monotherapie, keine Alleinstellungsmerkmal!
Merke: Die Indikation zur Infiltrationstherapie bei Tendinopathien sollte unabhängig vom applizierten Wirkstoff stets streng geprüft werden. Der Anwender ist im Einzelfall für die Infiltration verantwortlich und muss sich stets vergewissern, welches konkrete Behandlungsziel mit einer Infiltration verfolgt wird. Bei Tendinopathien dienen Infiltrationen (jeglicher Art) nicht dazu, eine sportliche Aktivität oder Belastungsfähigkeit auf symptomatischer Ebene aufrecht zu erhalten. Das Ziel aller beteiligten Behandler sollte es stets sein, eine dem Schweregrad der Schädigung angepasste und sichere Wiedererlangung der Trainings- und Wettkampffähigkeit des Sportlers im Rahmen eines kontinuierlichen Rehabilitationsprozesses zu ermöglichen!
Erstveröffentlichung: Newsletter GOTS
SAVE THE DATE: 19.-20. Mai 2022 37.Jahreskongress der GOTS in Berlin
Autoren
ist Verbandsarzt der Deutschen Triathlon Union (DTU). Neben der klinischen Tätigkeit im Zentrum für Muskuloskelettale Chirurgie (OZMC) des Klinikums Osnabrück beschäftigt er sich wissenschaftlich schwerpunktmäßig mit Muskel- und Sehnenverletzungen und kann auf diesem Gebiet eine Vielzahl internationaler Publikationen vorweisen. Er ist Vorstandsmitglied der GOTS, Mitglied des GOTS-Komitees Muskel, Mitglied im „Muscle Research Center Erlangen“ (MURCE) und wiss. Beirat der sportärztezeitung.
ist Facharzt für Orthopädie und orthopädische Chirurgie. Er leitet das Zentrum für Regenerative Medizin und das Department für Gesundheitswissenschaften, Medizin, Forschung an der Donau Universität Krems, samt Professur für Tissue Engineering. Daneben ist er am Uni-Klinikum Krems an der orthopädischen Abteilung, mit Schwerpunkt Sportorthopädie und Knorpelchirurgie tätig. Seit 1992 in der GOTS, war er u.a. bereits deren Präsident und Vizepräsident Österreichs und war 2025 Kongresspräsident des GOTS-Kongresses in Krems sowie Präsident der ÖGSMP (2022). Außerdem ist er wiss. Beirat der sportärztezeitung.
© UWK/Daniel Novotny
Die trinationale (Deutschland, Österreich, Schweiz) Gesellschaft für Orthopädisch-Traumatologische Sportmedizin (GOTS) ist der größte europäische Zusammenschluss von Sportorthopäden und Sporttraumatologen. Sie ist erster Ansprechpartner in der Versorgung von Sportverletzungen und Garant für Qualität in der sporttraumatologischen Versorgung. Ihr Ziel ist es, das Verständnis von sportlicher Belastung und Verletzungen zu verbessern, um die muskuloskelettale Funktion und Lebensqualität zu erhalten. Dafür fördert die GOTS die Aus-und Weiterbildung, die Forschung sowie den internationalen Austausch unter sportorthopädisch und sporttraumatologisch tätigen Medizinern und Berufsgruppen angrenzender Fachgebiete.