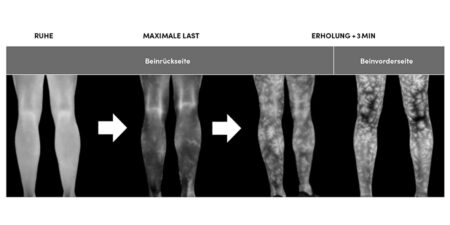
Die Frauen-Fußball WM 2019 in Frankreich bekam so viel Aufmerksamkeit und Zuschauer wie noch nie. Dennoch wird Lücke zwischen Männern und Frauen z. B. im finanziellen Bereich im Leistungsfußball sogar größer statt kleiner. Ist das mit den Leistungen und der Sportmedizin auch so?
Auch wenn die Frauen mittlerweile in allen sportlichen Disziplinen vertreten sind, so übertreffen die sportlichen Höchstleistungen der Männer sie immer noch um 10 – 15 %. Bei Kraft- und Sprungsportarten erreichen sie sogar bis zu 30 %, bei bestimmten Lauf- und Schwimmdisziplinen bleiben sie dagegen weit unter 10 %. Bisherige Forschungen zu den biologischen Grundlagen der geschlechtsspezifischen Unterschiede befinden sich noch in den Kinderschuhen, da sich bisher noch die meisten Empfehlungen auf Untersuchungen von männlichen Probanden beziehen.
Fakten
Frauen sind im Durchschnitt 13 cm kleiner und ca. 10 kg leichter. Sie besitzen einen 10 % größeren Bodyfettanteil mit deutlich höheren Fettspeichern in Muskeln und Haut als der Mann. Die Muskelmasse ist dagegen bis zu 20 kg geringer. Frauen besitzen 30 – 40 % weniger totale Muskelfasern und haben die gleiche Anzahl von Typ1 Fasern wie Typ 2 Fasern, wohingegen der Mann einen größeren Anteil der schnellen Typ 2 Fasern vor allem an der unteren Extremität besitzt [1]. Auch der Muskelfaserdurchmesser ist bei der Frau deutlich kleiner und es finden sich weniger Mitochondrien, also Kraftwerke pro Myofibrille [2]. Zusätzlich ist das Mitochondrienvolumen um 22 % kleiner [3]. Frauen besitzen ein 30 % kleineres Herz, geringeres Blutvolumen, 10 – 15 % weniger Hämoglobin und somit einen deutlich geringeren Sauerstofftransport. Daraus resultiert eine höhere Herzfrequenz bis zu 10 Schläge mehr/min und schließlich eine um 10 – 12 % geringere aerobe Leistungsfähigkeit mit aktuellen Maximalwerten um 77 – 94 ml/kg/min Vo2 max. Die Testosteronkonzentration der Frau ist 10 – 20mal niedriger als beim Mann. Hingegen ist das Äquivalent das Östrogen mit seiner zyklusabhängigen Konzentration 5 – 15mal höher.
Östrogen wirkt anabol wie das Testosteron des Mannes und fördert die Proteinsynthese. Dadurch ist auch erklärbar, dass in der Menopause Frauen eine geringere Proteinsynthese besitzen und stärker unter Muskelabbau leiden. Östrogen fördert die Glycogenspeicherung und Muskellipidsynthese und –abbau, wodurch sich der Effekt des Glycogenschutzes und dafür ein größerer Konsum von freien Fettsäuren vor allem aus dem Muskel bei Frauen nachgewiesen werden kann. Dieses werden wir später noch hinsichtlich der hormonabhängigen Trainingseffekte diskutieren. Östrogen fördert aber allgemein die Fettspeicherung im Körper und die NaCl Retention, was einerseits zu Gewichtszunahme und Wassereinlagerungen führt. Östrogen wirkt positiv auf die Stimmungsverbesserung der Frau und somit entgegen Depressionen. Progesteron hat den antagonistischen Effekt und wirkt katabol, fördert somit den Proteinabbau. Es unterstützt die Erhöhung der Körperkerntemperatur, erhöhte Ventilation und den Glycogenverbrauch.
Gender Food, FAT, RED-S
Frauen besitzen durch die geringere Muskelmasse einen geringerer Grundumsatz und damit einen geringerer Energiebedarf/Tag. Die Ernährung sollte dagegen eine höhere Nährstoffdichte mit weniger Energiegehalt als beim Mann enthalten, dagegen aber ausreichend Calcium, Eisen, Vitamin B6 und B12, Folsäure, Vitamin D3 enthalten, da Frauen durch ihre Regelblutung, Sport, Schwangerschaft, Stress und im Alter etc. eher einen größeren Mehrverbrauch diesbezüglich besitzen [4, 5]. Wichtig ist jedoch, den erhöhten Energiebedarf bei sporttreibenden Frauen anzupassen, um nicht in ein Syndrom des Female Athlete Triad oder RED-S Relative energy deficiency in sport (RED-S) zu geraten. FAT oder RED-S wird als ein Syndrom des relativen Energiemangels angesehen, die eine Essstörung, Amenorrhoe und Osteoporose beinhaltet. Der relative Energiemangel wird als < 30 kcal/kg FFM/Tag definiert, woraus Störungen im Stoffwechsel von Insulin, Cortisol, Wachstumsfaktoren (IGF-I), 3,3,5- Triiodthyronin, Leptin, Glucose, Fettsäuren und Ketone resultieren. Wir beobachten einen gestörten Metabolismus mit verminderter Proteinsynthese und Hormonproduktion. Es resultieren Menstruationszyklusstörungen bis hin zur Amenorrhoe. Folgen können Osteoporose und Stressfrakturen sein. Ein geschwächtes Immunsystem mit vermehrten Infektionen sowie chronische Müdigkeit.
Dehydratation und Elektrolytdysbalancen führen u. a. zu Magendarmproblemen. Auch eine resultierende Lipidstoffwechselstörung mit Folgen der Endotheldysfunktionen führt zu einem erhöhten kardiovaskuläres Risiko. Ebenso werden hämatologische Probleme mit z. B. Anämien nachgewiesen [6].
Diese Folgen sind zu erwarten:
- Reduktion der Muskelkraft
- verkleinerte Glucogenspeicher
- reduzierte Ausdauerleistung
- reduzierte Trainingsanpassung
- erhöhtes Verletzungsrisiko
- geringeres Einschätzungsvermögen
- verminderte Koordination
- fehlende Konzentration
- erhöhte Reizbarkeit
- Depressionen
- verminderte Leistungsfähigkeit
Wichtig ist, daran zu denken und die Diagnostik einzuleiten mit Kontrolle der:
- Menstruationsstörungen, Menarche, Regelmäßigkeit
- Familienanamnese
- Anthropometrie, DEXA
- Medikamenteneinnahme
- Pubertätsstadium, evtl biologisches Alter
- Zeichen von Essstörungen
- Gynäkologie: sekundäre Ursachen für Amenorrhoe
- Labor: Hb, LH, FSH, Prolactin, Östrogen, TSH, T3, T4, evtl. Androgenprofil
- Stressfrakturen?
Die Therapie sollte folgendes beinhalten:
- Zyklusregulierung ggf. hormonell
- Reduktion Trainingsumfang und Intensität ohne high impact! (ggf. Trainingspause)
- Körpergewichterhöhung um 1 – 2 kg
- Vitamin D3 und Calcium
- Psychologische Betreuung
- Kontrolle ein bis drei Monate
- Energie Aufnahme – Energie Verbrauch = kcal/kg FFM/Tag
- mit oder ohne Essstörung
- min. 45 kcal/kg FFM/Tag
-

Kraft & functional training, Beinachsentraining -

Training Schnelligkeit & Agility
Stressfrakturen & erhöhtes Verletzungsrisiko VKB-Rupturen
Im Zusammenhang mit Essstörungen oder auch durch erhöhte Belastungen und muskuläre Dysbalancen, sehen wir bei Frauen ein 10-fach höheres Risiko für Stressfrakturen als beim Mann. Sportlerinnen besitzen eine 15 – 60 % Prävalenz im Gegensatz zu der Gesamtbevölkerung von 3 – 5 %. Bei Frauen mit Störungen des Menstruationszyklus und verminderter Blutungshäufigkeit (Oligo-/Amenorrhoe) von < 5x/Jahr Menstruation im Jahr finden wir sogar bis zu 49 %, 39 % bei 6 – 9/Jahr und nur 29 % 13x/Jahr. Oligo-/Amenorrhoe und Ausdauersport erhöht das Risiko erneut mit Anzahl der gelaufenden Kilometer pro Woche: bei > 50 km/Woche 51 %; bei 8 – 50 km/Woche 33 %; bei keinem systematischen Training 6 %. Wir finden eine Prävalenz bei Frauen von Osteopenie von 22 – 50 % und Osteoporose bei 10 – 13 %. Der Knochenmassenverlust beträgt 2 – 6 % pro ein amenorrhoisches Jahr und ein irreversibler Knochenmassenverlust besteht sogar innerhalb schon von drei amenorrhoischen Jahren. Auch ein Gewichtsverlust von 10% des Körpergewichts in sechs Monaten stellt eine weitere Prävalenz dar [7 – 9]. Frauen besitzen ein allgemein erhöhtes Verletzungsrisiko, vor allem für die Non-contact VKB-Rupturen. Wir wissen schon länger, dass Frauen ein 4 – 6fach erhöhtes Risiko als Männer für VKB-Rupturen, typischerweise noncontact injuries bis 85 %, besitzen. Die Inzidenz liegt bei 0,097 auf 100 Spielerinnen/Jahr wobei bei Männern 0,082 auf 100 Spieler/Jahr.
Frau und Mann – die kleinen Unterschiede
Frauen besitzen gegenüber Männern kürzere Extremitäten im Vergleich zur Rumpflänge, so dass der Körperschwerpunkt tiefer liegt als bei Männern. Zu dem geringeren Rumpf-Flexionswinkel kommt ein breiteres Becken mit einem erhöhten ventralen Pelvic tilt und vermehrte femorale Anteversion. Vergrößerte Hüft-Adduktion und deutlicherer Genu valgus führen auch zu vergrößertem Q-Winkel und bei geschwächter Fußmuskulatur resultiert daraus eine vermehrte Pronation des Fußes. Neuromuskulär sehen wir als Folge unter Belastung einen vergrößerten Flexionswinkel im Knie (22°) und Hüfte (31°) beim Landemanöver, bei Einbeinlandungen, beim Cutting Manöver (Bremsphase) und schon beim Rennen. Man kann eine stärkere Valgusstellung im Knie, vermehrte Pronation des Fußes bei einer deutlichen Quadricepsdominanz, also stärkere Vastus lateralis-Aktivierung gegenüber geringer Hamstringaktivität (Semitendinosus), messen. Dadurch resultiert ein verstärkter Load aufs VKB. Neben dem allen sehen wir unkontrollierte laterale Rumpfbewegung und vergrößerte Hüftmobilität bei aber verminderter Kraft der Hüft- (Gluteus max./med.) und Rumpfmuskulatur, welche zu vermehrter Hüftadduktion und -innenrotation im Gehen, Laufen und Landen führen [10-17]. Diese Erkenntnisse erklären auch die deutlich erhöhten Zahlen bei Frauen mit chronischen Überlastungssyndromen durch Sport mit Iliotibialsyndrom, Patellofemoralen Schmerzen und Plantarfasciitis etc. [18]. Risikofaktor neben dem Geschlecht mit der gegebenen Anatomie sowie neuromuskulären Defizite ist auch ein zusätzlich hoher BMI. Hinzu kommen direkt am Kniegelenk eine erhöhte Anterior-posteriore Gelenkslaxität, ein vergrößerter Q-Winkel > 10°, ein vergrößerter Slope und zusätzlich ein Navicular drop > 8 mm am Fuß, wodurch sich eine vermehrte Fußpronation unter Belastung zeigt [19 – 26]. Auch besitzen Frauenknie eine kleinere intercondyläre Notch <17 mm, eine sogenannte Notchstenose, wodurch sich das Risiko auch für die Gegenseite auf 6-fach erhöht. Es wurde ein größerer, innerer lateraler Condylenwinkel um 75°, welches zu eine Notchimpingement führt, beobachtet. Dadurch wird das VKB förmlich bei Distorsion aufgedreht und „erhängt“. Allgemein lässt sich aber bei Frauenknie auch ein kleineres VKB-Volumen nachweisen [27]. Wir finden eine Abhängigkeit zu erhöhter Rupturrate im Zusammenhang mit dem Östrogengehalt bzw. dem Menstruationszyklus. Östrogen reduziert die Fibroblastenprolifertation in der Prokollagensynthese. In der Follikelphase, also präovulatorisch, erhöhen Östrogen und Relaxin zusammen die Laxität der Ligamente. Da man Östrogenrezeptor auf den Fibroblasten im VKB nachweisen konnte, erhöht sich somit die ap-Gelenkslaxität bei erhöhter Östrogenkonzentration [28 – 34]. Non-contact-injury VKB-Rupturen konnten mit den Phasen des Menstruationszyklus assoziiert werden: Die meisten VKB-Rupturen waren in der präovulatorische Phase Tag 1 – 10 gefunden, als das Östrogen hoch war. Einige Studien weisen dagegen aber auch Rupturen noch während der Menstruation nach, wenn die beiden Hormone bereits erniedrigt sind. Dagegen wurde eine erhöhte Laxität auch in der Ovulations- und postovulations-Phase aufgezeigt, in folgender Häufigkeit mit 10. – 14. Tag > 15. – 28. Tag und > 1. – 9. Tag [35 – 37]. Hinzu kommt noch, dass in der Follikelphase ein geringerer Hamstring-Quadriceps-Quotient der Kraft speziell im Nicht-dominanten Bein nachzuweisen ist, welches zusätzlich zu einem erhöhten Risiko führt. Einige Studien konnten bisher zeigen, dass die allgemeine Inzidenz durch orale Kontrazeptiva signifikant (um 20 %) reduziert werden konnte [38 – 46].
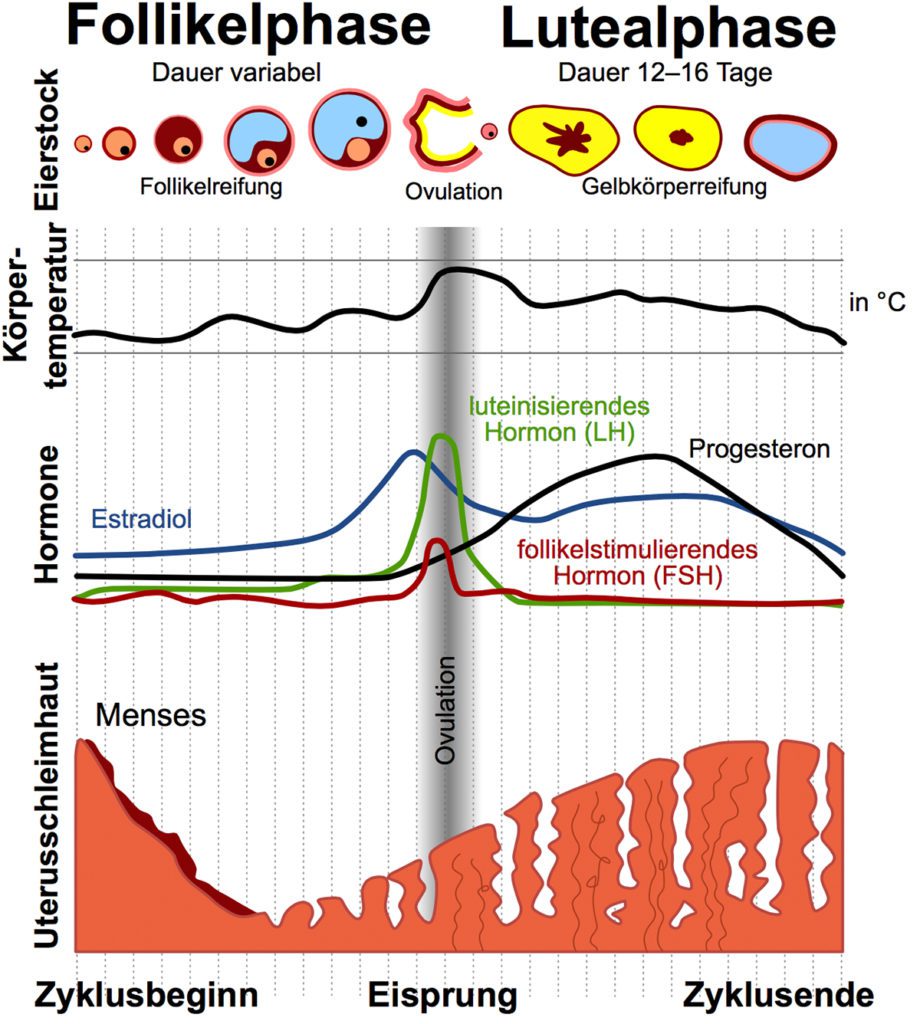
Menstruationszyklus, Training, Ausdauer und Kraft
Der Menstruationszyklus ist wie erwähnt in zwei Phasen, der Follikelphases und Lutealphase aufgeteilt und wird von der Ovulation getrennt. Viele Einflüsse der weiblichen Hormone auf das physiologische System, Respiration, Thermoregulation, Kardiovaskuläres System, Lactatentwicklung sowie Muskelzell- und Stoffwechselaktivierung sind bereits bekannt, aber die VO2max-Werte zeigen sich von den Menstruationsphasen fast völlig unbeeinflusst [47]. Wir sehen einen direkten Einfluss der maximalen aeroben und anaeroben Leistung. Östrogen verbessert die Ausdauerleistung in der mid-lutealen und frühen und späten Follikelphase (prä-ovulatorisch). Vor allem bei submaximalen Ausdauerbelastungen zeigen Sportlerinnen eine höhere Fettverbrennung, einen geringeren Eiweißabbau und einen niedrigere Kohlenhydratumsatz als ihre männlichen Kollegen auf. Sie sparen also ihre Glucogenspeicher auf. Wohingegen das Progesteron vorwiegend in der zweiten Zyklusphase eher antagonistisch zu wirken scheint, so dass die Glycogenspeicher weniger „aufgespart“ werden und die Glucoseverfügbarkeit zu den Typ I Muskelfasern in der Lutealphase hoch, dagegen in der frühe follikuläre Phase niedrig ist. Der geringere Abbau von Glukose führt auch zu geringeren Lactatkonzentrationen in vergleichbaren Sportarten mit dem Mann [48 – 50]. Wenn wir wissen wollen, ob wir die Leistungsfähigkeit mit Carboloading in den unterschiedlichen Phasen beeinflussen können, ist die Antwort auf die Verbesserung der Leistungssteigerung noch schwierig mit bisherigen Leistungsmessungen des VO2max zu beantworten: Bisher konnte eine verbesserte Glucogenspeicherung durch kohlenhydratreiche Ernährung erreicht werden, aber weder die Leistungsfähigkeit in Longdistance- noch in Short high intensity-Disziplinen konnten dadurch beeinflusst werden [51]. Zu diskutieren ist die Ergänzung der Energieaufnahme während des Trainings mit Protein, speziell in den Menstruationsphasen, wie Lutealphase, in denen Progesteron eher den Katabolismus fördert [52]. Bisherige Studien zeigen dazu noch keine schlüssigen Ergebnisse. Eine fettarme Ernährung dagegen behindert bei Frauen die Wiederauffüllung der Triglyceridspeicher, hauptsächlich in den Muskeln, und vermindert dadurch ihre Langzeitausdauer [53]. Läuferinnen besitzen bei Langzeitbelastungen eine höhere Fettverbrennungsrate und eine geringeren Eiweißabbau als Männer [54]. Hinsichtlich der besseren Fettsäureoxidation ließe sich diskutieren, ob Frauen zum einen nicht prädisponierter wären für Longdistance-Sportarten und ob das ausdauerbetonte Training nicht eher in die erwähnte mid-luteale Phase und späte Follikelphase gelegt werden sollte. Bei längeren Trainingseinheiten unter heißen Bedingungen sehen wir einen potenziell negativen Effekt aufgrund einer schnelleren Erschöpfung der Frauen, die sich in der Lutealphase ihres Menstruationszyklus befinden, in der die Körperkerntemperatur erhöht ist. Vorzugsweise wäre eine Trainingsanpassung hinsichtlich Dauer und Intensität in heißen und feuchten Klima zu diskutieren, bedarf aber noch zusätzliche Forschungen [55].
Bisherige Ergebnisse legen also nahe, dass wir eine gewisse Abhängigkeit des Menstruationszyklus für Ausdauerleistungen besitzen. Für High intensity-Sportarten sehen wir aktuell noch unbeeinflusste Ergebnisse. Für Kraftausdauerleistungen wissen wir zum einen, dass Männer sich länger im aeroben Bereich durch verbesserte Glukoseutilisation mit Lactatwerten unter 2 mmol/l belasten können, zum anderen den größeren Kraftzuwachs in der Muskulatur im Krafttraining durch den Vorteil des höheren Testosteronspiegels besitzen. Das weibliche Pendant, das Östrogen, konnte einen größeren Effekt des Maximal- und Explosivkrafttrainings mit Zuwachs des Muskeldurchmessers in den ersten zwei Menstruationswochen (Follikelphase) beeinflussen, anstatt dasselbe Training in der zweiten Zyklushälfte. Dabei werden bei Frauen stets immer beide Muskelfasertypen gleichmäßig angesprochen. Durch orale Kontrazeptiva konnte der Trainingseinfluss nicht verändert werden [56 – 58]. Frauen zeigen weniger schnelle Ermüdung der Skelettmuskulatur als Männer bei isometrischen Kontraktionen der einzelnen Gliedmaßen. Die Muskelermüdung zeigte bei wiederholten dynamischen Kontraktionen geschlechtsspezifische Unterschiede. Dementsprechend wäre auch eine geschlechtsspezifische Anpassung der Trainingspläne, die eine Ausbelastung beinhalten, zu berücksichtigen [59]. Auch sehen wir eine Abhängigkeit der allgemeinen Recovery vom Menstruationszyklus. Eine schnellere Erholung in der mid-follikulären Phase konnte im Vergleich zu der Midlutealphase gezeigt werden [60].
Fazit
Abschließend lässt sich sagen, dass es noch viele Forschungen und Diskussionen zu diesem spannenden Thema „Frauen und Sport“ in allen Bereichen bedarf. Auch wenn Frauen lange hinsichtlich Sport zurückgehalten wurden, auch wenn sie rein genetisch, anatomisch und neuromuskulär benachteiligt scheinen, so sieht man mittlerweile anhand von rückläufigen Verletzungsdaten, dass sich diese Faktoren z. B. positiv durch Präventionsprogramme beeinflussen lassen. Auch wenn Frauen gegenüber Männern geringere Leistungen erbringen, so zeigen sie doch gewisse stoffwechselbedingte und hormonelle Vorteile in Bezug auf Ausdauersportarten. Frauen sollten nicht mit identischen Trainingsplänen wie Männer im Krafttrainingsbereich trainieren müssen. Maximal- und Explosivkrafttrainingseinheiten sollten eher in die erste Zyklushälfte gelegt werden, wohin Ausdauertrainingseinheiten oder auch Wettkämpfe eher am Anfang oder Mitte der zweiten Zyklushälfte geplant werden sollten. Ob high intensity- und Intervallsportarten wirklich zyklusunbeeinflusst sind, wird die Zukunft noch zeigen müssen. Und mit welcher Anpassung der Ernährung speziell für Sportlerinnen wir arbeiten werden, werden wir auch noch genauer klären müssen. Sicher sollten individuell und sportartspezifisch genügend kcal vitaminreich und mit hohen Anteilen von Spurenelementen pro Tag zur Verfügung stehen. Kohlenhydratarme und fettarme Diäten sollten im Zusammenhang mit Ausdauerleistungen eher gemieden. Inwieweit menstruationsabhängige Trainingspläne vor allem in Teamsportarten jemals umsetzbar sind, sei dahingestellt. Sicher hätte es jede Einzelsportlerin einfacher dieses für sich selbst zu koordinieren, ausgenommen davon sind natürlich die Wettkampfdaten.
Literatur
1.Steffensen et al.: Myocellular triacylglycerol breakdown in females but not in males during exercise. Am.J.Physiol. Endocrinol. Metab. 2002
Venables et al.: Determinants off at oxidation during exercise in healthy men an d women: a cross-sectional study. J.Appl. Physiol. 2004
2.Neumann et al.: Biologische Leistungsvorausssetzungen undn trainingsphysiologische Aspekte bei trainierenden Frauen. Med. Sport. Berlin 1981
3. Hoppeler et al.: The ultrastructure oft he normal human skeletal muscle. A morphometric analysis on untrained men, women an well-trained orientiers. Pfügers Archiv 1973
4. Elmadfa et al.: European Nutrion and Health Report 2009
5. Meinrad Linschinger 2014: Gender Food, der kleine Unterschied bei der Ernährung von Mann und Frau. www.lindschinger.at
6. Mountjoy et al.: THE IOC relative enregy deficiency in sport clinical assessment tool (RED-SCAT). Br J Sport Med 2015
7. Constantini et al.: Clinical consequences of athletic amenorrhoea. Sports Med. 1994
8. Dale et al.: Menstrual dysfunction in distance runners. Obstet Gynecol. 1979
9. Barrow et al.: Menstrual irregularity and stress fractures in collegiate female distance runners. Am J Sports Med. 1988
10. Ford et. al.: Valgus knee motion during landing in high school female and male basketball players. Med Sci Sports Exerc. 2003
11. Malinzak et al.: A comparison of knee joint motion patterns between men and women inselectes athletic tasks. Clin Biomech 2001
12. McLean et al.: Effect of gender and defensive opponent on the biomechanics of sidesteps cutting. Med Sci Sports Exerc 2004
13. Pollard et al.: Influence of gender on hip and knee mechanics during a randomly cued cutting maneuver. Clin Biomech 2004
14. Salci et al.: Comparison of landing maneuvers between male and female college volleyball players. Clin Biomech 2004
15. Lephardt et al.: Gender differences in strengh and lower extremity kinematics during landing. Clin Orthop. Relat Res. 2002
16. Leetun et al.: Core stability measures as risk factors for lower extremity injury in athletes. Med Sci Sports Exerc. 2004
17. Schmitz et al.: Sex differences in lower extremity biomechanics during single leg landings.
Clin Biochmech 2007
18. Sinclair et al.: The effects of orthotic intervention on multisegment foot kinematic and plantar fascia strain in recreational runners. J Appl Biomech 2014
19. McAlindon: The knee. Baillieres Clin Rheumatol. 1999
20. Shambaugh et al.: Structural measures as predictors of injury basketball players. Med Sci Sports Exerc. 1991
21. Souryal and Freeman: Intercondylar notch size and anterior cruiate ligament injuries in athletes. A prospective study. Texas Sports Medicine Group, Dallas 1993
22. Shelbourne et al.: The relationship between intercondylar notch width of femur and the incidence of anterior ligament tears. A prospective study. Am J Sports Med 1998
23. Chaudhary:Bioanalysis going global. Bioanalysis 2009
24. Smith et al.: Role of hyperpronation as a possible riskfactor for cruiate ligament injuries. J Athl Train. 1997
25. Lund-Hansen et al.:Intercondylar notch width and the risk for anterior cruciate ligament rupture. A case-control study in 46 female handball players. Acta Orthop Scand 1994
26. Zazulax et al.: Th effect of menstrual cycle on anterior knee laxity: a systematic review. Sports Med. 2006
27. Milijko et al.: Intercondylar noch width an dinner angle of lateral femoral condyle as the risk factors for cruciate ligamnet injury in female handball players in Herzegovina. Coll Antropol. 2012
28. Yu et al.: Effect of oestrogen on cellular metabolism oft he human abterior cruciat ligament. Clin Orthop Relat Res. 1999
29. Arendt et al.: Anterior cruciate ligament injury patterns among collegiate men and women. J Athl Train 1999
Periodicity of noncontact anterior cruiate ligament injuries during the menstrual cycle. J Gend Spedif Med. 2002
30. Myklebust et al.: Prevention of anterior cruciate ligament injuries in femle team handball players: a prospective intervention study over three seasons. Clin J Sport Med 2003
31. Liu et al.: Estrogen affects the cellular metabolism oft he anterior cruciate ligament. A potential explanation for female athletic injury. Am J Sports Med 1997
32. Shultz et al.: Sex differences in knee joint laxity change across the female mentsrual cycle. J Sports Med Phys Fitness 2005
33. Stijak et al.: The influence of sex hormones on anterior cruiate ligament rupture: female study. Knee Surgery Sports Ttraumatology ARthroscopy 2013/2014
34. Eiling et al.: Effects of menstrual-cycle hormone fluctuations on musculotendinous stiffness and knee joint laxity. Knee Surg Sports Traumatol Arthrosc. 2007
35. siehe 38
36. siehe 39
37. siehe 40
38. Zazulak et al.: The effects oft he mesntrual cycle on anterior knee laxity: a stystematic review. Sports Med 2006
39. Wojtys et al.: Th eeffect of menstrual cycle on anterior cruiate ligament injuries in women as determined by hormone levels. AM J Sports Med. 2002
40.Hewett et al.: Effects oft he menstrual cycle on anterior cruciate ligament injury risk: a stystematic review. Am J Sports Med 2007
41. Slauterbeck et al.: The Menstrual Cycle, Sex Hormones, and anterior cruiate Ligament Injury. J Athl Train. 2002
42. Arendt et al.: Periodicity of noncontact anterior cruiate ligamnet iinjuries during the menstrual cycle. J Gend Specif Med. 2002
43. Myklebust et al.: A prospective cohort study of anterior cruciate ligament injuries in elite Norwegian team handball. Scand J Med Sci Sports 1998
44. Gwinn et al.: The relative incidence of anterior cruciate ligament injury in men and women at the United States Naval Academy. Am J Sports Med. 2000
45. Lefevre et al.: Anterior cruciate ligament tear during the menstrual cycle in female recreational skiers. Orthop Traumatol Surg Res. 2013
46. –
47. Beidleman et al.: Exercise VE an dphysical performance at altitude are not affected by menstrual cycle phase. J Apple Physiol 1998
48. Hamadeh et al.: Estrogen supplemenation reduces whole body leucine an carbohydrate oxidation and increases lipid oxidation on men during endurance exercise. J Clin Endocrinol Metabol. 2005
49. Nielsen et al.: Enery expenditure, sex, and endogenoous fuel availability in humans. J Clin Invest 2003
50. Venables et al.: Determinants off at oxidation during exercise in healthy men an women: a cross-sectional study. J Appl Physiol 2004
51. McLay et al.: Carboyydrate loading and female endurance athletes: effect of menstrual-cycle phase. Int J Sport Nutr Exerc Metab 2007
52. Oosthuyse et al.: The effect oft he menstrual cycle on exercise performance in eumenorrhoeic women. Sports Med. 2010
53. Larson-Meyer et al.: Influence of endurance running and recovery diet on intramyocellular lipid content in women: a1H HMR study. Am J Physiol Endocrinol Metab. 2002
54. McKenzie et al.: Endurance exercise training attentuates leucine oxidation and BCOAD activation during exercise in humans. Am J Physiol Endocrinol Metab 2000
55. De Jonge: Effects oft he menstrual cycle on exercise performance. Sports Med. 2003
56. Dos Santos Andrade et al.: Is muscular strength balance influenced by menstrual cycle in female soccer players? Epub 2016/ J Sports Med Phys Fitness 2017
57. Wikström-Frisén et al.: Effects on power, strength and lean body mass of menstrual/oral contraceptive cycle based resistance training. Epub 2015/J Sports Med Phys Fitness 2017
58. Sung et al.: Effects of follicular versus luteal phase-based strength training in young women. Springerplus 2014
59. Hunter et al.: Sex differences in fatigability of dynamic contraction. Exp Physiol. 2016
60. Hackney et al.: Female sex hormones and the recovery from exercise: Menstrual cycle phase affect responses. Biomed Hum Kinet. 2019
Autoren
ist Belegärztin Orthopädie/Traumatologie/Sportmedizin Praxen, OZM Münsingen/ SwissSportClinic Bern Wankdorf, Schweiz. Seit 2013 ist sie Teamärztin A-Team der Schweizer Frauenfußballnationalmannschaft und betreut eine Vielzahl weiterer Sportlerinnen und Vereine, wie z. B. die Femina Kickers Worb (SSC), HC Bulls Regional League Icehockey (SSC).