Für viele gilt Arthrose bis heute als unheilbare Erkrankung. Diese Sichtweise ist tief verwurzelt, gestützt auf jahrzehntelange Erfahrung und das scheinbar unvermeidbare Fortschreiten der Gelenkdegeneration. Doch diese Annahme wird durch moderne wissenschaftliche Erkenntnisse grundlegend infrage gestellt. Neue Studien aus der Zellbiologie, Epigenetik und molekularen Medizin eröffnen eine völlig neue Perspektive: Arthrose ist nicht nur behandelbar, sondern auch heilbar.
Definition: Heilung aus biologischer Sicht:
Heilung im Kontext von Arthrose und Knorpelregeneration bedeutet die Wiederherstellung des Gelenkknorpels in den ursprünglichen Zustand. Dies bedeutet die Wiederherstellung der strukturellen und funktionellen Integrität des Gelenkknorpels sowie der umgebenden Gewebe. Dieser Prozess umfasst die Auflösung entzündlicher Prozesse, die Regeneration der extrazellulären Matrix, die Chondrozytenproliferation und die Wiederherstellung der homöostatischen Mechanismen des Knorpels. Die Heilung in dieser biologischen Betrachtung ist vollzogen, wenn der Knorpel seine biomechanischen Eigenschaften und die synoviale Umgebung ihr entzündungsfreies Gleichgewicht zurückerlangt hat.
Arthrose ist keine Abnutzungserkrankung, sondern das Ergebnis komplexer biologischer Prozesse: Chronische Entzündungen, der Abbau der extrazellulären Matrix (ECM) und eine gestörte Zellregeneration treiben die Krankheit voran. Lange Zeit standen diese Prozesse im Zentrum symptomatischer Therapien, die Schmerzen lindern und Beweglichkeit verbessern sollten – jedoch ohne die Ursachen zu beheben.
Die moderne Forschung zeigt, dass die Regeneration des Knorpelgewebes durch gezielte Aktivierung biologischer Mechanismen möglich ist. Dies umfasst die Reprogrammierung von Zellen, die Aktivierung regenerativer Signalwege und die epigenetische Steuerung zentraler Gene. Kombiniert mit entzündungssenkenden Ansätzen, Bewegungsreizen und gezielter Nährstoffversorgung wird der Körper in die Lage versetzt, geschädigtes Gewebe nachhaltig zu reparieren.
Das Wissen über diese Mechanismen stellt einen Paradigmenwechsel dar, der den bisherigen Umgang mit Arthrose revolutioniert. Statt Symptome zu verwalten, rückt die gezielte Heilung in den Fokus. Die Dr. Feil Strategie kombiniert die effektivsten wissenschaftlichen Erkenntnisse und macht sie für Patienten und Mediziner anwendbar.
Der Weg zur Arthroseheilung ist keine Theorie mehr – er ist wissenschaftlich begründet, medizinisch umsetzbar und bereits in der Praxis auch bei fortgeschrittener Arthrose im Stadium IV erfolgreich angewandt. Die folgenden Abschnitte erläutern die entscheidenden biologischen Prozesse, die die Grundlage für diesen Fortschritt bilden.
1. Entzündungshemmung und Immunmodulation
Entzündungsprozesse sind ein zentraler Faktor in der Entwicklung und Progression von Arthrose [1]. Sie schädigen die Knorpelzellen und fördern den Abbau der extrazellulären Matrix (ECM) durch die Aktivierung proinflammatorischer Signalwege und Zytokine wie TNF-α, IL-1β und IL-6 [2]. Diese entzündlichen Mediatoren treiben degenerative Prozesse voran und blockieren gleichzeitig regenerative Mechanismen.
Proinflammatorische Signalwege hemmen
Der NF-κB-Signalweg ist einer der Hauptakteure in der Entzündungskaskade [3]. Durch seine Aktivierung wird die Expression von Zytokinen gesteigert, die wiederum die Produktion von Matrix-Metalloproteinasen (MMPs) anregen. Insbesondere MMP-13 baut Kollagen Typ II in der Knorpelmatrix ab, was zu einer fortschreitenden Gelenkdegeneration führt [4]. Die Unterbrechung dieses Signalwegs ist daher entscheidend, um die Entzündungsreaktion zu stoppen.
Makrophagen polarisieren – von M1 zu M2
Makrophagen spielen eine duale Rolle im arthrotischen Gelenk. Der entzündliche M1-Phänotyp setzt schädliche Zytokine frei, während der regenerative M2-Phänotyp antiinflammatorische und heilungsfördernde Mediatoren wie TGF-ß und IL-10 produziert. Die gezielte Umprogrammierung von M1 zu M2 Makrophagen reduziert Entzündungen und fördert die Regeneration der Knorpelmatrix [5, 6].
Oxidativer Stress minimieren
Reaktive Sauerstoffspezies (ROS) verstärken die entzündlichen Prozesse und schädigen Chondrozyten direkt [7]. Der Nrf2/Keap1-Signalweg reguliert die Synthese antioxidativer Enzyme wie Glutathion-S-Transferase und Superoxiddismutase, die ROS neutralisieren und die Zellschäden minimieren [8].
Praktische Anwendung
Die Dr. Feil Strategie adressiert diese Mechanismen durch eine Kombination aus entzündungssenkender Ernährung, intermittierendem Fasten und Bewegung:
- Omega-3-Fettsäuren aus Fisch, Algen- und Leinöl hemmen den NF-κB-Signalweg [9, 10, 11].
- Polyphenole B. aus Kurkuma, Zwiebel, Ingwer, Hagebutten, und grünem Tee sowie die Mineralien und Spurenelemente Magnesium, Zink, Selen, Bor, ebenso die Vitamine C, D und E fördern die Umprogrammierung von Makrophagen von M1 zu M2 [12, 13, 14, 15].
- Intermittierendes Fasten reduziert oxidative Belastungen und verbessert die Zellregeneration [16, 17, 18].
Diese Ansätze schaffen ein entzündungsfreies Milieu, das die Grundlage für eine nachhaltige Heilung der Arthrose bildet.
2. Wiederherstellung der Knorpelmatrix
Die Regeneration der Knorpelmatrix ist der zentrale Schritt in der Heilung von Arthrose. Knorpelgewebe besteht hauptsächlich aus Kollagen Typ II und Proteoglykanen, die gemeinsam für die Elastizität und Stabilität der Gelenke sorgen. Degenerative Prozesse stören diese Balance, wodurch die Struktur des Knorpels geschädigt wird. Die gezielte Aktivierung regenerativer Mechanismen ermöglicht es, diese Schäden rückgängig zu machen.
Kollagensynthese fördern
Die Förderung der Kollagensynthese ist ein wesentlicher Faktor in der Regeneration der Knorpelmatrix. Die Synthese von Kollagen Typ II wird durch den TGF-β/SMAD-Signalweg gesteuert [19]. TGF-β1 und TGF-β3 aktivieren SMAD-Proteine, die die Expression von Kollagen-Genen wie COL2A1 fördern [20]. Diese Wachstumsfaktoren regen zusätzlich die Produktion von Proteoglykanen an, die Wasser binden und der Knorpelmatrix ihre belastbaren Eigenschaften verleihen.
Für die Förderung der Kollagensynthese spielt ebenso der Wnt/β-Catenin-Signalweg eine Schlüsselrolle: Wnt aktiviert β-Catenin, das in der frühen Chondrogenese die Transkription regenerativer Gene wie Sox9 induziert [21]. Sox9 ist ein zentraler Regulator, der die Synthese von Kollagen Typ II und anderen Matrixproteinen kontrolliert [22].
Chondrozytenproliferation anregen
Auch die Vermehrung von Chondrozyten ist für die Regeneration des Knorpels entscheidend. Ebenso wie bei der Förderung der Kollagensynthese spielt hier der Makrophagen M2-Botenstoff TGF-ß eine entscheidende Rolle, da unter dessen Einfluß sowohl die Aktivierung ruhender Stammzellen im geschädigten Knorpelgewebe erreicht wird, andererseits auch vermehrt Stammzellen aus dem Knochenmark rekrutiert werden. Die Stammzellen differenzieren dann zu Knorpelvorläuferzellen (Progenitorenzellen) und anschließend zu neuen Knorpelzellen [23]. Diese Differenzierung zu neuen Knorpelzellen läuft über die Hedgehog- und Notch-Signalwege.
Der Hedgehog-Signalweg (Sonic Hedgehog) unterstützt dabei die Differenzierung und stabilisiert die Knorpelmatrix, indem er die Synthese von ECM-Proteinen wie Aggrekan fördert [24]. Gleichzeitig reguliert der Notch-Signalweg das Gleichgewicht zwischen Proliferation und Differenzierung, indem er Zellschicksalsentscheidungen präzise steuert. Diese Mechanismen sorgen dafür, dass genügend Chondrozyten neu produziert werden, ohne die Funktion der Stammzellreserve zu beeinträchtigen.
Pluripotenzfaktoren wie Oct3/4, Sox2, Klf4, Nanog und Lin28 sichern dabei die Regenerationsfähigkeit der Stammzellen [25]. Diese Faktoren agieren in einem eng vernetzten System, das durch epigenetische Mechanismen wie DNA-Methylierung und Histonmodifikationen reguliert wird [26]. Eine gezielte Steuerung dieser Netzwerke in Verbindung mit den Hedgehog- und Notch-Signalwegen optimiert die Differenzierungsprozesse und erhält die Stammzellreservoirs.
Auch ausdifferenzierte Knorpelzellen, die sich normalerweise nicht mehr teilen würden, können wieder Stammzellenqualität bekommen, sich also umprogrammieren und sich wieder neu teilen, um den Knorpelaufbau zu unterstützen [23]. Diese Umprogrammierung wird auch vom M2 Botenstoff TGF-ß initiiert und erreicht durch Modifikatoren wie Tet1-3 Demethylasen, die für regenerative Prozesse notwendig sind [27]. Der PI3K/Akt/mTOR-Signalweg sorgt für eine effiziente Energieversorgung während dieser Zellumwandlung und unterstützt die Zellproliferation [28].
Abbauprozesse unterdrücken
Während regenerative Prozesse angestoßen werden, ist es ebenso wichtig, katabole Mechanismen zu blockieren. Matrix-Metalloproteinasen (MMPs), insbesondere MMP-13, bauen die Knorpelmatrix ab [29]. Ihre Aktivität wird durch TIMP-Proteine (Tissue Inhibitors of Metalloproteinases) gehemmt, wodurch die Balance zwischen Aufbau und Abbau der Matrix wiederhergestellt wird.
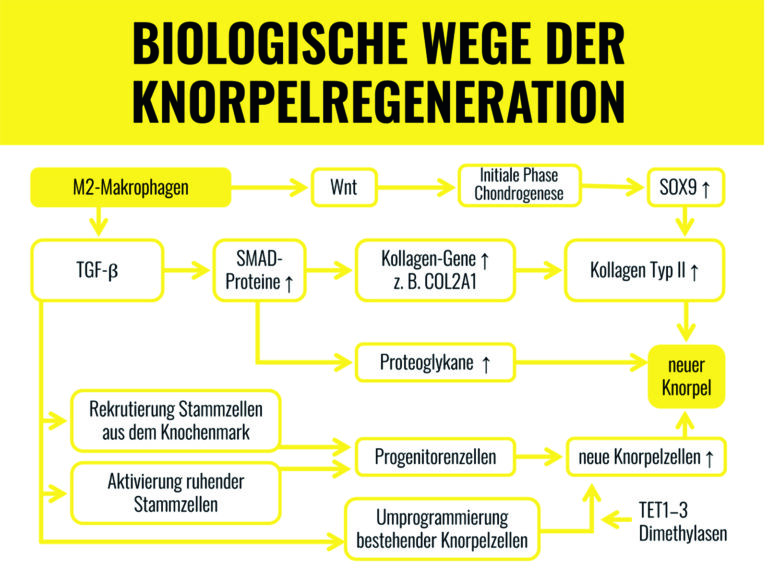
Die umfassenden biologischen Knorpelregenerationsprozesse sind in Abb. 1 dargestellt. Ausgangspunkt der Knorpelregeneration sind die Botenstoffe TGF-ß und Wnt, die von polarisierten Makrophagen im M2 Zustand gebildet werden. Der entstehende neue Knorpel ist biologisch voll funktionsfähig und unterscheidet sich nicht von einem juvenilen Knorpel.
Praktische Anwendung
Die Dr. Feil Strategie verstärkt die Knorpelregeneration durch die Polarisierung der Makrophagen in den M2 Zustand bei gleichzeitiger Unterstützung der Kollagensynthese und der Chondrozytenproliferation. Gleichzeitig werden Knorpelabbauprozesse gezielt unterdrückt:
- umfassende Nährstoffe für die M2 Polarisierung (Literatur siehe Artikel Feil “Arthrose ist heilbar” siehe August 2024, https://sportaerztezeitung.com/rubriken/therapie/16590/arthrose-ist-heilbar/)
- Kollagenhydrolysatgabe (10 g) liefert die Bausteine für die Kollagensynthese [30]
- Glucosamin- und Chondroitinsulfatgaben (1500 mg und 800 mg) fördern die Produktion von Proteoglykanen [31]
- Bewegung aktiviert den Wnt/β-Catenin-Signalweg [32] und steigert die Proliferation von Chondrozyten über Makrophagen M 2 Botenstoffe [33]
- Eine entzündungssenkende Ernährung reduziert die Aktivität von MMPs und schützt die neugebildete Matrix [34]
- Intermittierendes Fasten aktiviert die Tet-Demethylasen und verbessert die epigenetische Aktivierung regenerativer Gene [35].
Die Dr. Feil Strategie sichert deshalb die langfristige Stabilität und Funktionalität des regenerierten Knorpelgewebes, was MRT mäßig durch Einzelfallbeispiele auch schon nachgewiesen wurde – auch bei Arthrose-Stadium IV.
3. Energetische Leistung für den Knorpelaufbau
Die Regeneration von Knorpelgewebe erfordert eine hohe energetische Leistung der Chondrozyten [36]. Mitochondrien liefern diese Energie in Form von ATP und sind gleichzeitig an der Regulation des oxidativen Stresses beteiligt [37].
Eine beeinträchtigte mitochondriale Funktion führt zu einem Defizit an Energie und einer Zunahme schädlicher reaktiver Sauerstoffspezies (ROS), was die Knorpelregeneration hemmt. Die Bildung neuer Mitochondrien wird durch den AMPK-Signalweg und den Transkriptionsfaktor PGC-1α gesteuert [37]. Diese Mechanismen gewährleisten eine ausreichende Energieproduktion, die für die Kollagensynthese und andere anabole Prozesse benötigt wird. Sirtuine (SIRT1-7) verbessern die Effizienz der Mitochondrien, indem sie die Energieverwertung optimieren und schädliche Stoffwechselprodukte minimieren [38].
Autophagie ist ein essenzieller Prozess, bei dem beschädigte Zellbestandteile und degenerierte Mitochondrien (sogenannte Zombi-Mitochondrien) abgebaut und durch neue ersetzt werden [39]. Dies reduziert den zellulären Stress und schafft eine optimale Umgebung für regenerative Prozesse. AMPK fördert die Autophagie durch Hemmung des mTOR-Signalwegs, wodurch alte oder geschädigte Organellen gezielt entfernt werden [40]. Dadurch ist die zelluläre Belastung mit reaktiven Sauerstoffspezies (ROS) geringer, was die die Funktionalität der Chondrozyten während der Regeneration [41] sichert.
Praktische Anwendung
Die Dr. Feil Strategie stärkt die mitochondriale Gesundheit durch gezielte Maßnahmen:
- Intermittierendes Fasten aktiviert AMPK und fördert die Autophagie, wodurch geschädigte Zellbestandteile entfernt werden [42].
- Bewegung steigert die Aktivierung von PGC-1α, was die mitochondriale Biogenese verbessert [43].
- Antioxidantien aus Lebensmitteln wie Beeren und grünem Tee reduzieren oxidativen Stress und stabilisieren die Zellfunktion [44].
- Ergänzende Nährstoffe wie Coenzym Q10 unterstützen eine im Alter nachlassende mitochondriale Effizienz und fördern damit die ATP-Produktion [45].
Diese Dr. Feil Strategien schaffen die energetischen Voraussetzungen für eine effektive Knorpelregeneration und schützen die Chondrozyten vor degenerativen Prozessen.
4. Epigenetische Modulation
Die epigenetische Modulation ermöglicht die gezielte Steuerung von Genen, die für die Regeneration von Knorpelgewebe verantwortlich sind [46]. Durch Änderungen an der DNA-Methylierung, Histonmodifikationen und nicht-kodierende RNAs wird die Genexpression fein abgestimmt, ohne die DNA-Sequenz selbst zu verändern. Diese Mechanismen stellen sicher, dass regenerative Prozesse aktiviert und degenerative Signalwege dauerhaft unterdrückt werden.
DNA-Methylierung: Regenerative Gene einschalten
DNA-Methylierung reguliert die Aktivität von Genen, die für die Knorpelregeneration essenziell sind [47]. Enzyme wie DNMT3a und DNMT3b fügen Methylgruppen an spezifische DNA-Regionen, insbesondere Promotoren, hinzu. Dadurch wird die Expression kataboler Gene, die den Knorpelabbau fördern, unterdrückt. Gleichzeitig fördern Demethylasen der Tet-Familie (Tet1-3) die Demethylierung und Aktivierung regenerativer Gene wie COL2A1 (Kollagen Typ II) und Sox9.
Epigenetische Mechanismen garantieren die langfristige Aktivität regenerativer Prozesse, indem sie Mastergene wie Sox9 und den Botenstoff TGF-β1 dauerhaft aktivieren. Diese epigenetische Prägung sichert die Stabilität des regenerierten Knorpels und verhindert ein Wiederaufleben degenerativer Prozesse [48].
Histonmodifikationen: Zugang zur DNA regulieren
Histonmodifikationen steuern den Zugang zu DNA-Regionen und beeinflussen so die Transkription [49]. Histonacetyltransferasen (HATs) lockern die Chromatinstruktur, wodurch regenerative Gene leichter abgelesen werden können. Im Gegensatz dazu bewirken Histondeacetylasen (HDACs) eine Verdichtung der Chromatinstruktur und hemmen die Genexpression. Trimethylierungen wie H3K27me3 wirken differenziert, indem sie degenerative Gene stilllegen und regenerative Gene aktiv halten.
mRNA feinjustieren
Mikro-RNAs (miRNAs) wie miR-140 und miR-29b beeinflussen die Stabilität und Translation von mRNAs, die für die Synthese von Kollagen und Proteoglykanen benötigt werden [50]. Sie fördern die Produktion regenerativer Proteine und unterdrücken gleichzeitig den Abbau der extrazellulären Matrix. Diese präzise Feinsteuerung ergänzt die epigenetische Regulation auf DNA- und Histonebene.
Praktische Anwendung
Die Dr. Feil Strategie nutzt gezielt epigenetische Mechanismen zur Förderung der Knorpelregeneration:
- Polyphenole B. aus Kurkuma und grünem Tee hemmen HDACs und fördern die Histonacetylierung [51, 52].
- Methylspender wie Methionin, Folsäure und Betain unterstützen die DNA-Methylierung an geeigneten Stellen [53, 54].
- Bewegung stimuliert Signalwege wie TGF-β/SMAD und sichert die epigenetische Stabilität regenerativer Prozesse [55].
Diese Strategien aktivieren regenerative Gene und sorgen für eine dauerhafte Heilung der Arthrose auf molekularer Ebene.
5. Mikrozirkulation und Nährstoffversorgung
Knorpelgewebe ist aufgrund seiner fehlenden Gefäßversorgung auf die Diffusion von Sauerstoff und Nährstoffen aus der umliegenden Synovialflüssigkeit angewiesen [56]. Eine optimale Mikrozirkulation in den angrenzenden Geweben sichert diese Versorgung, fördert die Zellgesundheit und ermöglicht die effektive Regeneration der Knorpelmatrix.
Angiogenese und Sauerstoffversorgung verbessern
Die Bildung neuer Blutgefäße in der Gelenkumgebung wird durch den Transkriptionsfaktor HIF-1α (Hypoxie-induzierter Faktor 1-alpha) gesteuert [57]. HIF-1α reguliert die Expression von VEGF (vascular endothelial growth factor), der die Gefäßbildung anregt und die Sauerstoffversorgung des Gewebes verbessert [58]. Diese verbesserten Blutflüsse erhöhen die Diffusionsrate von Sauerstoff und Nährstoffen, was die metabolische Aktivität der Chondrozyten optimiert und den Abbau der extrazellulären Matrix reduziert.
Stoffwechselabfälle entfernen
Die Entfernung von Stoffwechselabfällen wie Laktat und Ammoniak ist essenziell, um die zelluläre Homöostase aufrechtzuerhalten. Eine funktionierende Mikrozirkulation verbessert den Abtransport dieser toxischen Substanzen und verhindert deren Ansammlung, die den Stoffwechsel der Chondrozyten beeinträchtigen.
Flüssigkeitsaustausch in der Synovialflüssigkeit fördern
Mechanische Belastungen während der Bewegung fördern den Flüssigkeitsaustausch in der Synovialflüssigkeit [59]. Dieser Prozess erhöht die Diffusionsrate von Nährstoffen und Sauerstoff in das Knorpelgewebe und verbessert gleichzeitig die Entfernung von Abfallprodukten. Gelenkschonende Aktivitäten wie Schwimmen oder Radfahren maximieren diese Effekte, ohne die Gelenke zusätzlich zu belasten.
Praktische Anwendung
Die Dr. Feil Strategie nutzt gezielte Maßnahmen, um die Mikrozirkulation und Nährstoffversorgung nachhaltig zu verbessern:
- Bewegung stimuliert die Durchblutung und erhöht den Flüssigkeitsaustausch in der Synovialflüssigkeit [60, 61].
- Stickstoffmonoxid-fördernde Substanzen wie L-Arginin verbessern die Gefäßdilatation und steigern die Sauerstoffzufuhr [62, 63].
- Antioxidantien aus Beeren und grünem Tee schützen die Gefäße vor oxidativem Stress und stabilisieren die Mikrozirkulation [64, 65].
- Intermittierendes Fasten reduziert entzündliche Prozesse in den Gefäßen und optimiert den Nährstofffluss [66].
- IHHT-training oder Wanderungen in der Höhe und Wanderungen mit eingestreuten Luftanhalteperioden (5-25 Sekunden) erhöhen HIF-1a und damit die Blutgefäßbildung über eine Erhöhung von VEGF [67, 68].
Durch diese Strategien werden die Chondrozyten effizient versorgt, Stoffwechselabfälle entfernt und die Grundlage für eine nachhaltige Knorpelregeneration geschaffen.
Fazit
Die moderne Wissenschaft zeigt eindrucksvoll, dass Arthrose keine unvermeidbare degenerative Erkrankung ist, sondern gezielt behandelt und sogar geheilt werden kann. Durch die gezielte Entzündungshemmung, sowie durch die Aktivierung von regenerativen Signalwegen, die Steuerung epigenetischer Prozesse und die Optimierung der Mikrozirkulation wird das Fundament für eine nachhaltige Knorpelregeneration gelegt.
Die wissenschaftliche Basis, kombiniert mit praktischen Strategien wie der Dr. Feil Strategie, hat das Potenzial, die Lebensqualität von Millionen Betroffenen nachhaltig zu verbessern. Entzündungssenkende Ernährung, regelmäßige Bewegung, die Förderung von Optimismus und psychoneuroimmunologischen Effekten sowie ergänzende Nährstoffe einerseits für die Aktivierung der M2 Polarisierung und andererseits für die Knorpelernährung wirken synergetisch auf die molekularen Mechanismen der Arthroseheilung.
Für eine vertiefte Auseinandersetzung mit diesen Strategien bietet das Buch „Arthrose endlich heilen“ von Dr. rer. nat. Wolfgang Feil und Tobias Homburg, erschienen im GU Verlag, eine umfassende Anleitung. Dieses Werk verbindet wissenschaftliche Grundlagen mit praktischen Tipps und zeigt, wie Betroffene aktiv an ihrer Heilung mitwirken können.
Arthrose ist kein Schicksal. Arthrose ist ein lösbares Problem – wissenschaftlich fundiert, systematisch angegangen und mit greifbaren Ergebnissen für ein schmerzfreies Leben. Tausende Feedbacks, teils per MRT und Medizingutachten bestätigt, belegen inzwischen die Wirksamkeit der Dr. Feil Strategie zur Ausheilung einer Arthrose.
Studien / Weiterführende Literatur
- Molnar, , Matišić, V., Kodvanj, I., Bjelica, R., Jeleč, Ž., Hudetz, D., Rod, E., Čukelj, F., Vrdoljak, T., Vidović, D., Starešinić, M., Sabalić, S., Dobričić, B., Petrović, T., Antičević, D., Borić, I., Košir, R., Zmrzljak, U. P., & Primorac, D. (2021). Cytokines and Chemokines Involved in Osteoarthritis Pathogenesis. International Journal of Molecular Sciences, 22(17), 9208. https://doi.org/10.3390/ijms22179208
- Zheng, , Han, Z., Luo, D., Li, J., Pang, N., Ding, M., Ye, H., Zhu, K., & Yao, Y. (2023). IL-6, IL-1β
and TNF-α regulation of the chondrocyte phenotype: a possible mechanism of haemophilic cartilage destruction. Hematology (Amsterdam, Netherlands), 28(1), 2179867. https://doi.org/10.1080/16078454.2023.2179867
- Tian, , Zhang, L., Zheng, J., & Kang, X. (2024). The role of NF-ΚB-Sox9 signalling pathway in osteoarthritis. Heliyon, 10(17). https://doi.org/10.1016/j.heliyon.2024.e37191
- Yao, Q., Wu, X., Tao, C. et al. Osteoarthritis: pathogenic signaling pathways and therapeutic targets. Sig Transduct Target Ther 8, 56 (2023). https://doi.org/10.1038/s41392-023-01330-w
- Chen, B., Hong, H., Sun, Y., Chen, C., Wu, C., Xu, G., Bao, G., & Cui, Z. (2022). Role of macrophage polarization in osteoarthritis (Review). Experimental and therapeutic medicine, 24(6), 757. https://doi.org/10.3892/etm.2022.11693
- Yin, , Wang, Q., Tang, Y. et al. Research progress on macrophage polarization during osteoarthritis disease progression: a review. J Orthop Surg Res 19, 584 (2024). https://doi.org/10.1186/s13018-024-05052-9
- Liu, , Luo, P., Yang, M., Wang, J., Hou, W., & Xu, P. (2022). The role of oxidative stress in the development of knee osteoarthritis: A comprehensive research review. Frontiers in Molecular Biosciences, 9. https://doi.org/10.3389/fmolb.2022.1001212
- Sheng W, Yue Y, Qi T, Qin H, Liu P, Wang D, Zeng H, Yu The Multifaceted Protective Role of Nuclear Factor Erythroid 2-Related Factor 2 in Osteoarthritis: Regulation of Oxidative Stress and Inflammation. J Inflamm Res. 2024;17:6619-6633 https://doi.org/10.2147/JIR.S479186
- Zhang T, Dai Y, Zhang L, Tian Y, Li Z, Wang Effects of Edible Oils with Different n-6/n-3 PUFA Ratios on Articular Cartilage Degeneration via Regulating the NF-κB Signaling Pathway. J Agric Food Chem. 2020 Nov 11;68(45):12641-12650. doi: 10.1021/acs.jafc.0c05240. Epub 2020 Nov 2.
- Li J, Chen J, Huang P, Cai Z, Zhang N, Wang Y, Li Y. The Anti-Inflammatory Mechanism of Flaxseed Linusorbs on Lipopolysaccharide-Induced RAW 264.7 Macrophages by Modulating TLR4/NF-κB/MAPK Foods. 2023 Jun 16;12(12):2398. doi: 10.3390/foods12122398.
- Yang, , Hu, F., Yan, Y., Yu, S., Chen, T., & Wang, Z. (2022). Anti-inflammatory effect of acetone extracts from microalgae chlorella sp.. WZ13 on Raw264.7 cells and TPA-induced ear edema in mice. Frontiers in Marine Science, 9. https://doi.org/10.3389/fmars.2022.920082
- Nasra, S., Shah, T., Bhatt, M., Chaudhari, R., Bhatia, D., & Kumar, A. (2023). Reprogramming M1-to-M2 Phenotype to Alleviate Inflammation: Using Liposomal Curcumin as a Tool to Redefine Macrophage Functionality. ACS applied bio materials, 6(7), 2886–2897. https://doi.org/10.1021/acsabm.3c00316
- Li, L., Jiang, W., Yu, B., Liang, H., Mao, S., Hu, X., Feng, Y., Xu, J., & Chu, L. (2023). Quercetin improves cerebral ischemia/reperfusion injury by promoting microglia/macrophages M2 polarization via regulating PI3K/Akt/NF-κB signaling Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 168, 115653. https://doi.org/10.1016/j.biopha.2023.115653
- Bessa-Gonçalves, , Ribeiro-Machado, C., Costa, M., Ribeiro, C. C., Barbosa, J. N., Barbosa,
- A., & Santos, S. G. (2023). Magnesium incorporation in fibrinogen scaffolds promotes macrophage polarization towards M2 phenotype. Acta biomaterialia, 155, 667–683. https://doi.org/10.1016/j.actbio.2022.10.046
- Zhang, L., Guo, Y. F., Song, Z. X., & Zhou, M. (2014). Vitamin D prevents podocyte injury via regulation of macrophage M1/M2 phenotype in diabetic nephropathy rats. Endocrinology, 155(12), 4939–4950. https://doi.org/10.1210/en.2014-1020
- Qian, X., Rao, S. S., Tan, Y. J., Wang, Z., Yin, H., Wan, T. F., He, Z. H., Wang, X., Hong, C. G.,
Zeng, H. J., Luo, Y., Duan, Y. X., Zhu, H., Hu, X. Y., Zou, L., Zhang, Y., Liu, B. B., Wang, Z. X., Du,
W., Chen, C. Y., … Xie, H. (2024). Intermittent Fasting Targets Osteocyte Neuropeptide Y to Relieve Osteoarthritis. Advanced science (Weinheim, Baden-Wurttemberg, Germany), 11(34), e2400196. https://doi.org/10.1002/advs.202400196
- Reeves, , Tournier, P., Becquart, P., Carton, R., Tang, Y., Vigilante, A., Fang, D., & Habib, S. J. (2024). Rejuvenating aged osteoprogenitors for bone repair. eLife, 13, RP104068. https://doi.org/10.7554/eLife.104068
- Koppold, A., Kandil, F. I., Güttler, O., Müller, A., Steckhan, N., Meiß, S., Breinlinger, C., Nelle, E., Hartmann, A. M., Jeitler, M., Hanslian, E., Fischer, J. M., Michalsen, A., & Kessler, C. S. (2023). Effects of Prolonged Fasting during Inpatient Multimodal Treatment on Pain and Functional Parameters in Knee and Hip Osteoarthritis: A Prospective Exploratory Observational Study. Nutrients, 15(12), 2695. https://doi.org/10.3390/nu15122695
- Lian, , Wang, X., Qiu, X. et al. Collagen type II suppresses articular chondrocyte hypertrophy and osteoarthritis progression by promoting integrin β1−SMAD1 interaction. Bone Res 7, 8 (2019). https://doi.org/10.1038/s41413-019-0046-y
- Deng, , Fan, T., Xiao, C. et al. TGF-β signaling in health, disease and therapeutics. Sig Transduct Target Ther 9, 61 (2024). https://doi.org/10.1038/s41392-024-01764-w
- Liu, , Xiao, Q., Xiao, J. et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities. Sig Transduct Target Ther 7, 3 (2022). https://doi.org/10.1038/s41392-021-00762-6
- Cucchiarini, , Thurn, T., Weimer, A., Kohn, D., Terwilliger, E. F., & Madry, H. (2007). Restoration of the extracellular matrix in human osteoarthritic articular cartilage by overexpression of the transcription factor SOX9. Arthritis and rheumatism, 56(1), 158–167. https://doi.org/10.1002/art.22299
- Jiang, u.a. (2016): Human Cartilage-Derived Progenitor Cells from comitted Chondrocytes for efficient Cartilage Repair and Regeneration. Stem Cells Translational Medicine 5(6):733-744.
- Wang, , Li, Z., Zhao, S., Liu, Y., Guo, W., Alarcòn Rodrìguez, R., Wu, Y., & Wei, R. (2024). Characterizing hedgehog pathway features in senescence associated osteoarthritis through Integrative multi-omics and machine learning analysis. Frontiers in genetics, 15, 1255455. https://doi.org/10.3389/fgene.2024.1255455
- Chang, H., Wu, K. C., & Ding, D. C. (2020). Induced Pluripotent Stem Cell-Differentiated Chondrocytes Repair Cartilage Defect in a Rabbit Osteoarthritis Model. Stem cells international, 2020, 8867349. https://doi.org/10.1155/2020/8867349
- den Hollander, , & Meulenbelt, I. (2015). DNA Methylation in Osteoarthritis. Current genomics, 16(6), 419–426. https://doi.org/10.2174/1389202916666150817212711
- Miranda-Duarte (2018). DNA Methylation in Osteoarthritis: Current Status and Therapeutic Implications. The open rheumatology journal, 12, 37–49. https://doi.org/10.2174/1874312901812010037
- Sun, , Luo, J., Guo, J., Yao, X., Jing, X., & Guo, F. (2020). The PI3K/AKT/mTOR signaling pathway in osteoarthritis: a narrative review. Osteoarthritis and cartilage, 28(4), 400–409. https://doi.org/10.1016/j.joca.2020.02.027
- Li, , Wang, D., Yuan, Y. et al. New insights on the MMP-13 regulatory network in the pathogenesis of early osteoarthritis. Arthritis Res Ther 19, 248 (2017). https://doi.org/10.1186/s13075-017-1454-2
- García-Coronado, J. M., Martínez-Olvera, L., Elizondo-Omaña, R. E., Acosta-Olivo, C. A., Vilchez-Cavazos, F., Simental-Mendía, L. E., & Simental-Mendía, M. (2019). Effect of collagen supplementation on osteoarthritis symptoms: a meta-analysis of randomized placebo-controlled trials. International orthopaedics, 43(3), 531–538. https://doi.org/10.1007/s00264-018-4211-5
- Zhu, X., Sang, L., Wu, D., Rong, J., & Jiang, L. (2018). Effectiveness and safety of glucosamine and chondroitin for the treatment of osteoarthritis: a meta-analysis of randomized controlled Journal of orthopaedic surgery and research, 13(1), 170.
https://doi.org/10.1186/s13018-018-0871-5
- Fujimaki S, Hidaka R, Asashima M, Takemasa T, Kuwabara Wnt protein-mediated satellite cell conversion in adult and aged mice following voluntary wheel running. J Biol Chem. 2014;289(11):7399–412. doi: 10.1074/jbc.M113.539247.
- Callegari, O. M., Rocha, G. Z., & Oliveira, A. G. (2023). Physical exercise, health, and disease treatment: The role of macrophages. Frontiers in physiology, 14, 1061353. https://doi.org/10.3389/fphys.2023.1061353
- Suzuki, , Ohishi, T., Tanabe, H., Miyoshi, N., & Nakamura, Y. (2023). Anti-Inflammatory Effects of Dietary Polyphenols through Inhibitory Activity against Metalloproteinases. Molecules (Basel, Switzerland), 28(14), 5426. https://doi.org/10.3390/molecules28145426
- Asif, , Morrow, N. M., Mulvihill, E. E., & Kim, K. H. (2020). Understanding Dietary
Intervention-Mediated Epigenetic Modifications in Metabolic Diseases. Frontiers in genetics, 11, 590369. https://doi.org/10.3389/fgene.2020.590369
- Zhao, , Niu, D., Chen, Y., & Fu, P. (2024). The role of mitochondrial quality control mechanisms in chondrocyte senescence. Experimental gerontology, 188, 112379. https://doi.org/10.1016/j.exger.2024.112379
- Arra, , & Abu-Amer, Y. (2023). Cross-talk of inflammation and chondrocyte intracellular metabolism in osteoarthritis. Osteoarthritis and cartilage, 31(8), 1012–1021. https://doi.org/10.1016/j.joca.2023.04.003
- Sun, , Wu, Y., Zeng, Y., Xu, J., Wu, L., Li, M., & Shen, B. (2022). The role of the sirtuin family in cartilage and osteoarthritis: molecular mechanisms and therapeutic targets. Arthritis research & therapy, 24(1), 286. https://doi.org/10.1186/s13075-022-02983-8
- Zheng, , Zhang, Z., Sheng, P., & Mobasheri, A. (2021). The role of metabolism in chondrocyte dysfunction and the progression of osteoarthritis. Ageing research reviews, 66, 101249. https://doi.org/10.1016/j.arr.2020.101249
- Mao, , Fu, P., Wang, L., & Xiang, C. (2020). Mitochondria: Potential Targets for Osteoarthritis. Frontiers in medicine, 7, 581402. https://doi.org/10.3389/fmed.2020.581402
- He, , Wu, H., He, B., Han, Z., Chen, J., & Huang, L. (2024). Antioxidant hydrogels for the treatment of osteoarthritis: mechanisms and recent advances. Frontiers in pharmacology, 15, 1488036. https://doi.org/10.3389/fphar.2024.1488036
- Wijngaarden, A., van der Zon, G. C., van Dijk, K. W., Pijl, H., & Guigas, B. (2013). Effects of prolonged fasting on AMPK signaling, gene expression, and mitochondrial respiratory chain content in skeletal muscle from lean and obese individuals. American journal of physiology. Endocrinology and metabolism, 304(9), E1012–E1021. https://doi.org/10.1152/ajpendo.00008.2013
- Lira, A., Benton, C. R., Yan, Z., & Bonen, A. (2010). PGC-1alpha regulation by exercise training and its influences on muscle function and insulin sensitivity. American journal of physiology. Endocrinology and metabolism, 299(2), E145–E161. https://doi.org/10.1152/ajpendo.00755.2009
- Ansari, M. Y., Ahmad, N., & Haqqi, T. M. (2020). Oxidative stress and inflammation in osteoarthritis pathogenesis: Role of Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 129, 110452. https://doi.org/10.1016/j.biopha.2020.110452
- Hernández-Camacho, D., Bernier, M., López-Lluch, G., & Navas, P. (2018). Coenzyme Q10 Supplementation in Aging and Disease. Frontiers in physiology, 9, 44. https://doi.org/10.3389/fphys.2018.00044
- Zhang, , Fukui, N., Yahata, M., Katsuragawa, Y., Tashiro, T., Ikegawa, S., & Lee, M. T. (2016). Genome-wide DNA methylation profile implicates potential cartilage regeneration at the late stage of knee osteoarthritis. Osteoarthritis and cartilage, 24(5), 835–843. https://doi.org/10.1016/j.joca.2015.12.013
- Rice, J., Beier, F., Young, D. A., & Loughlin, J. (2020). Interplay between genetics and epigenetics in osteoarthritis. Nature reviews. Rheumatology, 16(5), 268–281. https://doi.org/10.1038/s41584-020-0407-3
- Papaioannou, , Mirzamohammadi, F., & Kobayashi, T. (2014). MicroRNAs involved in bone formation. Cellular and molecular life sciences : CMLS, 71(24), 4747–4761. https://doi.org/10.1007/s00018-014-1700-6
- Zhang, , Ji, L., Yang, Y., Zhang, X., Gang, Y., & Bai, L. (2020). The Role of HDACs and HDACi in Cartilage and Osteoarthritis. Frontiers in cell and developmental biology, 8, 560117. https://doi.org/10.3389/fcell.2020.560117
- Duan, , Liang, Y., Xu, X., Xiao, Y., & Wang, D. (2020). Recent progress on the role of miR-140 in cartilage matrix remodelling and its implications for osteoarthritis treatment. Arthritis research & therapy, 22(1), 194. https://doi.org/10.1186/s13075-020-02290-0
- Saber, M., Mahmoud, M. M., Amin, H. M., & Essam, R. M. (2023). Therapeutic effects of combining curcumin and swimming in osteoarthritis using a rat model. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 166, 115309. https://doi.org/10.1016/j.biopha.2023.115309
- Wu, , Shi, X., Chen, X., & Yin, Z. (2023). Epigallocatechin gallate (EGCG) can epigenetically regulate the receptor of advanced glycation end products (RAGE) to ameliorate osteoarthritis. Journal of Functional Foods, 107, 105682. https://doi.org/10.1016/j.jff.2023.105682
- Hoang, L. D., Aoyama, E., Hiasa, M., Omote, H., Kubota, S., Kuboki, T., & Takigawa, M. (2023). Positive Regulation of S-Adenosylmethionine on Chondrocytic Differentiation via Stimulation of Polyamine Production and the Gene Expression of Chondrogenic Differentiation Factors. International journal of molecular sciences, 24(24), https://doi.org/10.3390/ijms242417294
- Yajun, W., Jin, C., Zhengrong, G., Chao, F., Yan, H., Weizong, W., Xiaoqun, L., Qirong, Z., Huiwen, C., Hao, Z., Jiawei, G., Xinchen, Z., Shihao, S., Sicheng, W., Xiao, C., & Jiacan, S. (2021). Betaine Attenuates Osteoarthritis by Inhibiting Osteoclastogenesis and Angiogenesis in Subchondral Bone. Frontiers in pharmacology, 12, 723988. https://doi.org/10.3389/fphar.2021.723988
- da Silva, A., Thirupathi, A., Colares, M. C., Haupenthal, D. P. D. S., Venturini, L. M., Corrêa, M.
- A. B., Silveira, G. B., Haupenthal, A., do Bomfim, F. R. C., de Andrade, T. A. M., Gu, Y., & Silveira, P. C. L. (2023). The effectiveness of treadmill and swimming exercise in an animal model of osteoarthritis. Frontiers in physiology, 14, 1101159. https://doi.org/10.3389/fphys.2023.1101159
- Wu, , Fan, X., Crawford, R., Xiao, Y., & Prasadam, I. (2022). The Metabolic Landscape in Osteoarthritis. Aging and disease, 13(4), 1166–1182. https://doi.org/10.14336/AD.2021.1228
- Arai, , Cha, R., Nakagawa, S., Inoue, A., Nakamura, K., & Takahashi, K. (2024). Cartilage Homeostasis under Physioxia. International Journal of Molecular Sciences, 25(17), 9398. https://doi.org/10.3390/ijms25179398
- Zhu, J., Chang, B. Y., Wang, X. F., Zang, Y. F., Zheng, Z. X., Zhao, H. J., & Cui, Q. D. (2020).
FBW7 regulates HIF-1α/VEGF pathway in the IL-1β induced chondrocytes degeneration. European review for medical and pharmacological sciences, 24(11), 5914–5924. https://doi.org/10.26355/eurrev_202006_21484
- Ravalli, , Szychlinska, M. A., Lauretta, G., & Musumeci, G. (2020). New Insights on Mechanical Stimulation of Mesenchymal Stem Cells for Cartilage Regeneration. Applied Sciences, 10(8), 2927. https://doi.org/10.3390/app10082927
- Hahn, A. K., Rawle, R. A., Bothner, B., Prado Lopes, E. B., Griffin, T. M., & June, R. K. (2021). In vivo mechanotransduction: Effect of acute exercise on the metabolomic profiles of mouse synovial fluid. Osteoarthritis and cartilage open, 4(1), https://doi.org/10.1016/j.ocarto.2021.100228
- Norimatsu, K., Nakanishi, K., Ijuin, T., Otsuka, S., Takada, S., Tani, A., Matsuzaki, R., Matsuoka, T., & Sakakima, H. (2023). Effects of low-intensity exercise on spontaneously developed knee osteoarthritis in male senescence-accelerated mouse prone Arthritis research & therapy, 25(1),
- https://doi.org/10.1186/s13075-023-03162-z
- Cao, S., Li, Y., Song, R., Meng, X., Fuchs, M., Liang, C., Kachler, K., Meng, X., Wen, J., Schlötzer-Schrehardt, U., Taudte, V., Gessner, A., Kunz, M., Schleicher, U., Zaiss, M. M., Kastbom, , Chen, X., Schett, G., & Bozec, A. (2024). L-arginine metabolism inhibits arthritis and inflammatory bone loss. Annals of the rheumatic diseases, 83(1), 72–87. https://doi.org/10.1136/ard-2022-223626
- Yu, Q., Huang, Y., Chen, X., Chen, Y., Zhu, X., Liu, Y., & Liu, J. (2022). A neutrophil cell membrane-biomimetic nanoplatform based on l-arginine nanoparticles for early osteoarthritis diagnosis and nitric oxide therapy. Nanoscale, 14(32), 11619–11634. https://doi.org/10.1039/d2nr02601e
- Arisi, O. P., Gorski, F., Eibel, B., Barbosa, E., Boll, L., Waclawovsky, G., & Lehnen, A. M. (2023). Dietary intake of anthocyanins improves arterial stiffness, but not endothelial function, in volunteers with excess weight: A randomized clinical trial. Phytotherapy research : PTR, 37(3), 798–808. https://doi.org/10.1002/ptr.7659
- Din, U. S. U., Sian, T. S., Deane, C. S., Smith, K., Gates, A., Lund, J. N., Williams, J. P., Rueda, R., Pereira, S. L., Atherton, P. J., & Phillips, B. E. (2021). Green Tea Extract Concurrent with an Oral Nutritional Supplement Acutely Enhances Muscle Microvascular Blood Flow without Altering Leg Glucose Uptake in Healthy Older Adults. Nutrients, 13(11), 3895. https://doi.org/10.3390/nu13113895
- Demirci, E., & Özkan, E. (2023). Improvement in endothelial function in hypertensive patients after Ramadan fasting: effects of Turkish journal of medical sciences, 53(2), 439–445. https://doi.org/10.55730/1300-0144.5603
- Cui, , Lee, S., Sun, Y., Zhang, C., Hill, M. A., Li, Y., & Zhang, H. (2022). Alternate Day Fasting Improves Endothelial Function in Type 2 Diabetic Mice: Role of Adipose-Derived Hormones. Frontiers in cardiovascular medicine, 9, 925080. https://doi.org/10.3389/fcvm.2022.925080
- Zhang, L., Yin, Y., Guo, J., Jin, L., & Hou, Z. (2023). Chronic intermittent hypobaric hypoxia ameliorates osteoporosis after spinal cord injury through balancing osteoblast and osteoclast activities in rats. Frontiers in endocrinology, 14, 1035186. https://doi.org/10.3389/fendo.2023.1035186
Autoren
ist Biologe und Sportwissenschaftler. 1994 gründete er in Tübingen die Forschungsgruppe Dr. Feil, die inzwischen international ausgerichtet und in den USA ansässig ist. In Ernährungsfragen beriet Dr. Feil die Bundesliagvereine TSG Hoffenheim, Werder Bremen, die Rhein-Neckar-Löwen und Frisch-Auf Göppingen, ebenso Leistungssportler wie den Triathleten Jan Frodeno und den mehrfachen Ringerweltmeister Frank Stäbler.