Ob embryonal, induziert-pluripotent, adult oder mesenchymal: die Möglichkeiten des Einsatzes von Stammzellen in der Medizin sind in aller Munde. Das Themengebiet ist allerdings so komplex, dass häufig erst nach intensiver Beschäftigung mit der Materie die Begrifflichkeiten und Zusammenhänge langsam ersichtlich werden. Unser Autor hat in der Einleitung zu seiner Promotion über die Sehnenregeneration mit einer sog. „Regenerativzellsuspension“, also einem speziellen stammzellhaltigen Zellprodukt, den aktuellen Stand der Wissenschaft in dieser Thematik näher beleuchtet und für Interessierte ohne wesentliche Vorkenntnisse über Stammzellen zusammengefasst.
Vor etwa 50 Jahren wurden erstmalig Zellen beschrieben, welche sich fundamental von den bis dahin aus dem menschlichen Körper isolierten Zellen unterschieden: fibroblastische Vorläuferzellen konnten aus dem Knochenmarkstroma gewonnen werden (1). Dies markiert den Beginn der Verwendung von Stammzellen in der Medizin. Seit diesem Zeitpunkt sind zahlreiche Konzepte, Studien und bereits auch Therapien entwickelt worden, welche auf dem Prinzip der Stammzellen beruhen. Stammzellen sind definiert als Zellen, welche undifferenziert sind, sich jedoch durch äußere Reize zu verschiedenen Zellformen entwickeln können. Damit stellen sie eine sehr frühe Vorläuferstufe der differenzierten Körperzellen dar, welche ubiquitär im Körper in überwiegender Mehrheit im Vergleich zu weiteren Zellarten vorhanden sind und die Funktionen des jeweiligen Organs oder der jeweiligen Körperstruktur übernehmen. Die Stammzellen an sich sind jedoch eine sehr heterogene Gruppe; es bestehen massive Unterschiede im Grad der Differenzierung, der Herkunft und dem Entwicklungspotential zwischen den Stammzellarten. Liu et al. (2020) (2) teilten die Stammzellen in fünf Gruppen ein: (i) embryonale Stammzellen (sogenannte embryonic stem cells; ESCs), welche aus der embryonalen Blastozyste gewonnen werden können; (ii) sehr kleine embryonalähnliche Stammzellen (sogenannte very small embryonic like stem cells; VSELs) (iii) Kerntransfer-Stammzellen (sogenannte nuclear transfer stem cells; NTSCs); (iv) reprogrammierte Stammzellen (reprogrammed stem cells; RSCs); und (v) adulte Stammzellen (adult stem cells; ASCs) (2). Eine tabellarische Übersicht zu den verschiedenen Arten von Stammzellen findet sich in Tabelle 1.1. Innerhalb dieser Gruppen wird zudem häufig zwischen weiteren Untergruppen unterschieden, auf die an späterer Stelle zum Teil genauer eingegangen wird.
Embryonale Stammzellen (embryonic stem cells, ESCs)
Embryonale Stammzellen können aus der inneren Zellmasse von Blastozysten gewonnen werden, aus denen sich im weiteren Verlauf der Embryo entwickeln würde. Daher entsprechen sie pluripotenten Stammzellen, welche sich in nahezu alle Gewebearten des menschlichen Körpers differenzieren können (3). Bei der Erstbeschreibung der Isolierung embryonaler Stammzellen aus der Blastozyste kurz vor der Jahrtausendwende gelang es jedoch noch nicht, die Embryonen nach der Stammzellgewinnung überlebensfähig zu halten (4). Dies führte zu einer kontroversen Debatte in der breiten Öffentlichkeit über die Grenzen medizinischer Forschung. Bei den Unterstützern der Forschung mit ESCs wurde die Hoffnung beflügelt, bislang unheilbare Erkrankungen therapieren zu können oder zumindest durch Studien mit den ESCs die (genetische) Pathophysiologie besser zu verstehen. Dem gegenüber stand jedoch eine Gruppe von Kritikern dieser neuen Forschungsmethode, welche in der Forschung mit humanen Embryos den Tatbestand des Mordes erfüllt sahen. Die ethischen Bedenken der ESC-Gegner, welche oftmals aus religiösen Überzeugungen agierten, beruhten hauptsächlich darauf, dass sie den Beginn des menschlichen Lebens im Moment der Befruchtung der Eizelle definieren. Somit entsprach in deren Rechtsauffassung bereits der Embryo im blastozytären Frühstadium einer eigenständigen Person mit jeweiligen Persönlichkeitsrechten, und folglich galt jegliche Forschung mit dem Resultat der lebensverhindernden Schädigung des Embryos als Tötung eines Menschen (5). Diese ethische Problematik überschattet die Forschung, welche seit Anfang der 2000er-Jahre mit embryonalen Stammzellen durchgeführt wurde: aus den ESCs wurden oftmals Zelllinien mit genetischen Eigenschaften hereditärer Erkrankungen entwickelt, um damit grundlagenwissenschaftlich experimentieren zu können (6).
Tabelle 1.1: Verschiedene Arten von Stammzellen (modifiziert nach Liu et al., 2020 (2))
| Embryonale Stammzellen (ESCs) | Sehr kleine embryonal-ähnliche Stammzellen (VSELs) | Kerntransfer-Stammzellen (NTSCs) | Reprogram-mierte Stammzellen
(RCs) |
Adulte Stammzellen
(ASCs) |
|
| Definition | Pluripotente Stammzellen, die aus der inneren Zellmasse einer Blastozyste (eines Embryos) gewonnen werden können | Pluripotente Stammzellen aus adulten Geweben | Eine neue Einzelzelle wird durch die Transplantation des Spenderkerns in eine entkernte Eizelle einer Spenderin erzeugt | Pluripotente Stammzellen, die durch Reprogram-mierung adulter Zellen erzeugt werden. Gewonnen durch Anwendung manueller Labor-methoden zur Reprogram-mierung adulter Zellen. Zu den RCs gehören induzierte pluri-potente Stamm-zellen und direkt reprogrammierte Zellen. | Ein Zelltyp, der sich in unmittel-barer Nähe zu einer nährstoff-reichen Mikro-umgebung wie Gefäßen, Kno-chenmark oder Organen (Herz und Gehirn usw.) im reifen oder erwachsenen Organismus be-findet; sie sind in der Lage, auf ge-webespezifische Stimulation zu reagieren und Stammzellen zu produzieren. |
| Entwick-lungssta-dium | Frühes Präimplantations-stadium des Embryos | Stammzellmasse in der frühen Entwicklungspha-se in erwachse-nem Gewebe | Frühes Embryo-nalstadium | Frühes Embryo-nalstadium ein-zelner / mehrerer Zellen oder Zellen mit einer bestim-mten Gewebe-struktur | Ausgereifte Stammzellen aus adulten Zellen (z. B. Nabel-schnurblutzellen) oder erwachsenen Organen wie Herz und Gehirn |
| Funktion | Totipotenz: in der Lage, sich zu jeder Art von Zelle zu entwickeln | Unklare Totipotenz, jedoch Fähigkeit zur Ausdifferenz-ierung in zahlreiche Zelllinien | Einzelne Zelle erzeugt einen ganzen Organismus | Totipotenz: in der Lage, sich zu jeder Art von Zelle zu entwickeln | Entwickelt sich zu Zellen desselben systemischen Typs |
| Wesent-liche Hürden für die klinische Anwendung | Zerstörung/
Abtreibung des Embryos; Immunabwehr und Erschöpfung der Zellressourcen |
Bestimmung der allgemeinen Eigenschaften und Funktionen | Kann beim Klonen von Menschen missbraucht werden; hohe Anforderungen an Technologie, Einrichtung und Finanzen | Genomische Instabilität; kann geringe Wirksamkeit haben; Teratombildung | Invasive Chirurgie, Immunabstoßung (wenn es sich nicht um einen autologen Spender handelt), Kontamination und Infektion sowie keine natürliche Überwindung der genetischen Barrieren zur Differenzierung in eine andere Abstammungslinie |
Etwa zehn Jahre nach Isolierung der ersten embryonalen Stammzellen wurde ein Verfahren entwickelt, bei dem die ESCs aus der Blastozyste ohne Schädigung des Embryos gewonnen werden konnten (7, 8). Obwohl dies das ethische Hauptproblem des Einsatzes embryonaler Stammzellen löste, sank dennoch das Interesse an embryonalen Stammzellen rapide, denn nahezu zeitgleich wurden von zwei Forschungsgruppen aus somatischen Zellen pluripotente Stammzellen „reprogrammiert“ und somit Zellen mit vergleichbaren Fähigkeiten gänzlich ohne Notwendigkeit von Embryonen entwickelt (9, 10) (genaueres im Abschnitt zu reprogrammierten Stammzellen). Es bleiben jedoch weiterhin Vorteile auf Seiten der Verwendung embryonaler Stammzellen, da diese aufgrund des fehlenden „reprogrammierenden“ Eingriffs weniger genetische Veränderungen aufweisen und daher homogener sind. Daher laufen noch weiterhin vereinzelte klinische Studien mit embryonalen Stammzellen bei Rückenmarksverletzung, Immuntherapien, Makuladegeneration, Diabetes mellitus Typ I und Herzinsuffizienz (3, 11). Bislang konnten jedoch keine größeren therapeutischen Erfolge mit ESCs erzielt werden. Die Haupteinschränkungen für die klinische Verwendung von ESCs sind die möglichen immunogenen Reaktionen, eine Vielzahl von nicht differenzierten Zelltypen und die mögliche teratogene Entartung (3). Da die reprogrammierten Stammzellen im Prinzip die gleichen Eigenschaften besitzen, sind jegliche Einschränkungen in der Nutzung von ESCs auch für sie anzunehmen. Embryonale Stammzellen exprimieren grundsätzlich die zellulären Oberflächenproteine MHC-I und im Verlauf bei weiterer Differenzierung zusätzlich MHC-II. Da über den MHC-II-Komplex das Immunsystem überprüft, ob eine Zelle körpereigen oder körperfremd ist, werden bei fehlender Übereinstimmung Immunreaktionen ausgelöst (12). Da jedoch von praktisch keinem Menschen vor der Geburt embryonale Stammzellen gewonnen wurden, würden nahezu alle Spender-Stammzellen eine sog. Host-vs.-Graft-Immunreaktion auslösen und die neu implantierten Stammzellen somit zerstören, sofern keine Immunsuppression erfolgt (vgl. (13)). In den entsprechenden Studien wurden die Stammzell-Empfänger dementsprechend stets immunsupprimiert, was jedoch gravierende systemische Nebenwirkungen mit sich bringt. Eine Lösung für dieses Problem könnten Spender-Datenbanken mit diversen MHC-Zelllinien darstellen, vergleichbar mit den aktuell bereits vorhandenen Datenbanken zur Stammzelltransplantation bei Leukämien. Dies wäre jedoch mit hohem Aufwand und Kosten verbunden. Problematisch für den Einsatz der embryonalen (und auch reprogrammierten) Stammzellen ist zudem die teilweise unvollständige oder fehlerhafte Ausdifferenzierung der Stammzellen: einerseits wurde das Risiko der Entstehung von Keimzelltumoren nach Transplantation von ESCs beschrieben (14); andererseits besteht bei unvollständiger Ausdifferenzierung die Gefahr, dass das ursprüngliche Stammzellgewebe die Funktionen des zu ersetzenden Gewebes nicht auf physiologische Weise übernimmt, wie z. B. in einer Studie bei Insertion von embryonalen Stammzellen in kardiales Gewebe, bei der nach Transplantation der Stammzellen eine irreguläre kardiale Erregungsweiterleitung festgestellt wurde (15). Zusammenfassend lässt sich konstatieren, dass für die erfolgreiche klinische Verwendung embryonaler Stammzellen weiterhin hohe Hürden bestehen. Die Tatsache, dass die reprogrammierten Stammzellen äquivalente Eigenschaften besitzen und keinerlei ethische Fragen aufwerfen, hat erheblich zum Bedeutungsverlust der embryonalen Stammzellen geführt und wird mutmaßlich auch in Zukunft die Verwendung von ESCs weiter limitieren.
Reprogrammierte Zellen (reprogrammed stem cells, RCs)
Die reprogrammierten (Stamm-) Zellen lassen sich in zwei Gruppen einteilen (Abbildung 1.1):
- Transformierte Zellen mit pluripotenten Eigenschaften aus ursprünglich somatischen, ausdifferenzierten Zellen, die vor etwa 15 Jahren entwickelt wurden (9, 10). Zellen, welche mittels dieses Verfahrens hergestellt wurden, sind meist unter dem Namen „induziert pluripotente Stammzellen“ (sogenannte induced pluripotent stem cells; iPSCs) bekannt.
- Wenige Jahre später wurde ein weiteres reprogrammierendes Verfahren entwickelt, mit dem sich fibroblastische Zellen direkt in Kardiomyozyten (16) oder Hepatozyten (17) umprogrammieren ließen. Zellen dieser zweiten Gruppe sind sogenannte direkt reprogrammierte Stammzellen.
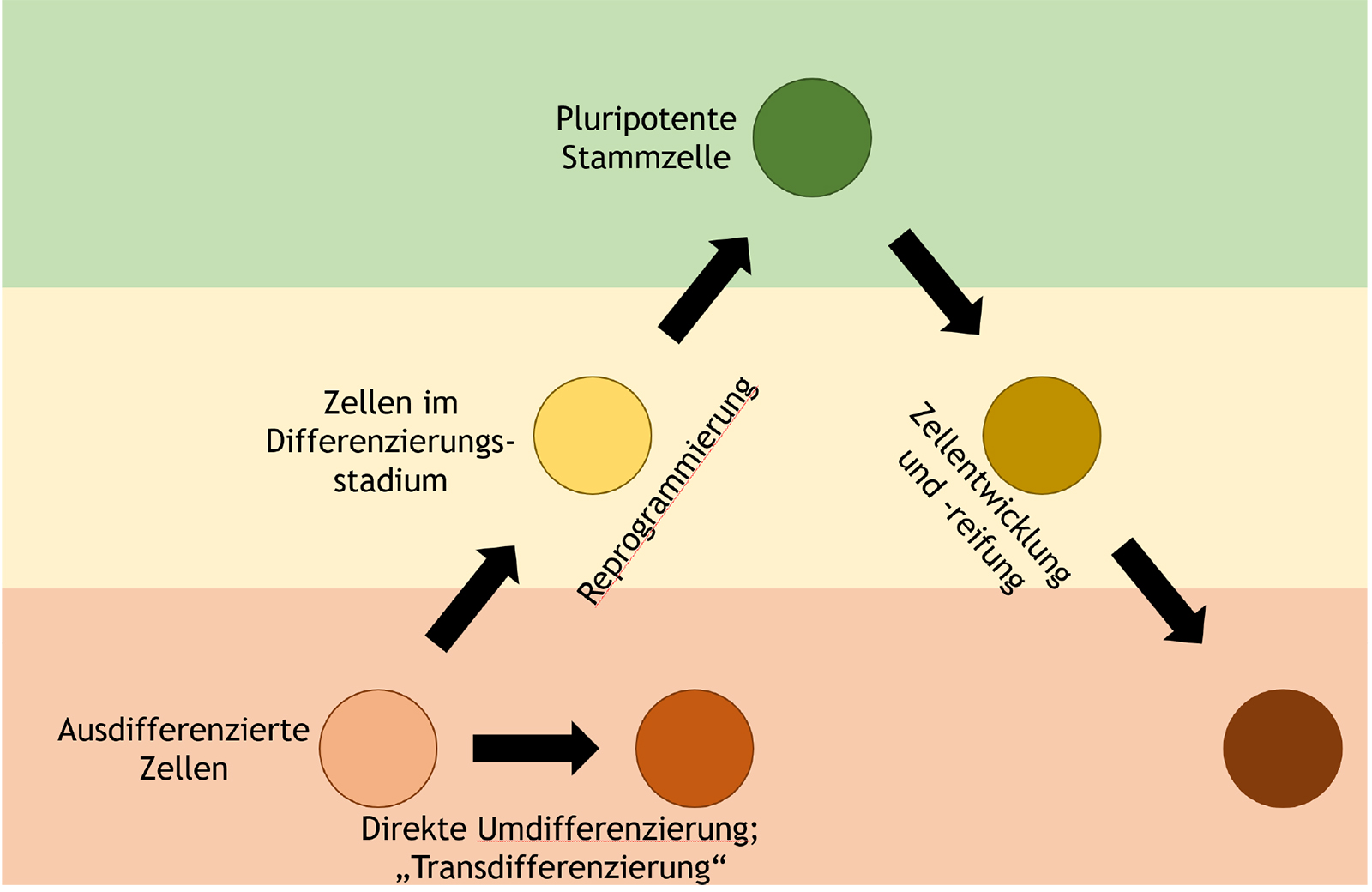
In der Forschung und Entwicklung liegt jedoch der Schwerpunkt eindeutig auf der ersteren Gruppe, sodass die Begriffe „induziert pluripotente Stammzellen“ und „reprogrammierte (Stamm-)zellen“ häufig synonym verwendet werden. Die Entwicklung dieser Verfahren brach mit dem lange Zeit vorherrschenden Paradigma, dass die Differenzierung von Zellen ausschließlich unidirektional sei (19). Zudem wurden die embryonalen Stammzellen schlagartig als Forschungsschwerpunkt im Bereich der Stammzellforschung abgelöst, da bei dieser Methode Zellen mit ähnlichen Eigenschaften gänzlich ohne ethische Bedenken generiert und verwendet werden. Mittlerweile gibt es vier Verfahren, mit denen die zur Reprogrammierung benötigten Faktoren in die ausdifferenzierte Ursprungszelle eingebracht werden können: entweder über virale Transfektion (jeweils in die DNA integrierend / nicht integrierend), über selbstschneidende Vektoren (also sich selbst in die DNA integrierend), oder direkte organische Materialien, welche in der Zelle entsprechende Signalwege aktivieren (2). Durch diesen Prozess wird jedoch maßgeblich in die Molekularbiologie der Ursprungszelle eingegriffen, was bei der Verwendung embryonaler Stammzellen nicht geschieht. Akkumulierte Mutationen in der DNA der adulten somatischen Vorläuferzelle führen zu einer genetischen Heterogenität der späteren iPSCs, welche die Funktion dieser Zellen erheblich beeinträchtigen können (20). Zudem ist die Vergleichbarkeit verschiedener Zelllinien bei gleichem Herstellungsverfahren eingeschränkt, da erworbene genetische Unterschiede zwischen den Spenderzellen Auswirkungen auf die spätere Funktionalität haben (21). Jedoch nicht nur die DNA an sich, sondern auch die Epigenetik kann den Zustand der reprogrammierten Zellen beeinflussen. Ein erhaltenes epigenetisches Gedächtnis in den reprogrammierten Zellen führt zu einer größeren Heterogenität der reprogrammierten Zellen (22). Zudem nehmen die Zellen oftmals im Reprogrammierungsvorgang sich stark von physiologischen Zellstadien unterscheidende Formen an, bei denen es zu einer veränderten epigenetischen Dynamik kommen kann (23). Diese ungleichmäßige Transformation der Epigenetik während des Reprogrammierungsverfahrens ist problematisch für die Qualitätssicherung (24).
Die Ursprungszellen für die Gewinnung von reprogrammierten Zellen können direkt aus differenzierten menschlichen Zellen gewonnen werden. Dafür werden häufig Fibroblasten der Haut, peripheres Blut oder Nabelschnurblut verwendet. Der einfachen Verfügbarkeit von Fibroblasten oder peripherem Blut steht jedoch der Nachteil von vermehrten erworbenen genetischen Mutationen entgegen, welche sich negativ auf die späteren reprogrammierten Zellen auswirken können. Das schwieriger zu gewinnende Nabelschnurblut hat zwar den Vorteil von weniger erworbenen Mutationen, jedoch ist zum Zeitpunkt der Gewinnung der spätere Gesundheitszustand des Spenders noch unbekannt (18). Auch wenn iPSCs nicht nur in regenerativer Hinsicht, sondern auch zur Untersuchung von Pathomechanismen und zum Screening nach wirksameren und sichereren Medikamenten verwendet werden (insbesondere, wenn die Spenderzellen von PatientInnen mit monogenen Erkrankungen stammen) (25, 26), bestehen für den klinischen Einsatz weitere Hürden. Dazu gehören die im Abschnitt zu den embryonalen Stammzellen bereits erläuterten, aber direkt auf reprogrammierte Zellen übertragbaren Einschränkungen wie die immunologischen Reaktionen, die unvollständige Differenzierung oder die Tumorentstehung. Hinsichtlich der Tumorentstehung bestehen im Vergleich zu den ESCs aufgrund des Reprogrammierungsvorgangs deutlich mehr Risiken. Zu den Risikofaktoren zählen z. B. das Verfahren der Reprogrammierung selbst, da die ins Erbgut integrierenden Methoden prinzipiell mit einem höheren Risiko einhergehen als die nicht-integrierenden Methoden, aber auch fehlerhafte Reprogrammierungsvorgänge, welche Schäden an Chromosomen auslösen können. Leider gibt es bislang keine Studien, welche die Tumorigenität von reprogrammierten Zellen mit der Tumorigenität von ESCs vergleicht (2, 27). Die Anzucht von Stammzellen unter zellkulturellen Bedingungen gestaltet sich außerdem als schwierig, wenn alle Bedenken hinsichtlich übertragbarer xenogener Krankheiten oder der Auslösung einer späteren Immunreaktion durch die eingesetzten Materialien ausgeräumt werden sollen (28). Eine spezifische Hürde lauert noch im Reprogrammierungsverfahren selber: die sehr kostspielige Erzeugung von induziert pluripotenten Stammzellen aus somatischen Zellen dauert mindestens drei Monate und hätte daher möglicherweise zur Folge, dass das optimale therapeutische Zeitfenster bereits geschlossen ist. Mittels größeren „Zellbanken“, welche über HLA-gematchte allogene iPSCs verfügen, könnte man dieses Problem umgehen, für den Preis von größerem Aufwand und immunologischen Restrisiken (18). Trotz der großen Hoffnungen zu Beginn der Forschung mit reprogrammierten Zellen konnten die Hürden für eine therapeutische Verwendung von reprogrammierten Zellen im großen Stil bislang nicht ausgeräumt werden. In Anbetracht der Tatsache, dass andere Stammzellformen einfacher in die klinische Anwendung integriert werden können, ist es nicht unwahrscheinlich, dass diese beeindruckende Technologie lediglich für die Grundlagenforschung relevant sein wird.
Kerntransfer-Stammzellen (nuclear transfer stem cells, NTSCs)
Die Stammzellen, welche mittels der sogenannten Kerntransfer-Technologie generiert werden, unterscheiden sich signifikant von den anderen Stammzellarten und werden daher in diesem Kontext nur der Vollständigkeit halber erwähnt. Während sich pluripotente und differenzierte Stammzellen nur zu Zelllinien oder mehr oder weniger großen Teilen eines Gesamtorganismus ausdifferenzieren, wird die Kerntransfertechnik zur Erzeugung eines lebendigen, eigenständigen Organismus verwendet. Die Übertragung des Zellkerns inklusive des Genoms in einen zellkernlosen Oozyten führt zu einer genetischen Reprogrammierung des transferierten Genoms in ein embryonales Entwicklungsstadium. Danach kann die neu zusammengesetzte Zelle eine reguläre embryonale Entwicklung bis hin zum ausdifferenzierten Organismus durchlaufen (2). Diese Technologie kann folglich zu einer Klonung von Lebewesen verwendet werden, was zum ersten Mal erfolgreich im Jahr 1996 durchgeführt wurde (29). Über die Klonung des Schafs „Dolly“ wurde weltweit debattiert, und ethische Bedenken dieser Technologie schränken die entsprechende Forschung und Entwicklung deutlich ein. Ungeachtet dieses ethischen Aspekts wurden in einem weiteren Projekt über 20 Jahre nach dem Schaf „Dolly“ mittels der Kerntransfer-Technologie Makaken-Affen geklont (30). Somit kann mittlerweile davon ausgegangen werden, dass diese Technologie ebenfalls in der Lage wäre, eine Klonung von Menschen erfolgreich durchzuführen.
Sehr kleine embryonalähnliche Stammzellen (very small embryonic- like stem cells, VSELs)
Im Jahr 2006 konnten erstmalig Zellen beschrieben werden, welche in sehr geringer Anzahl im Knochenmark vorkommen und sowohl immunhistochemische als auch elektronenmikroskopische Merkmale pluripotenter Stammzellen sowie die Fähigkeit zur Differenzierung in alle drei Keimbahnlinien besitzen (31). Aufgrund ihrer Eigenschaften und Größe erhielten diese Zellen den Namen very small embryonic-like stem cells, also übersetzt sehr kleine embryonalähnliche Stammzellen. Da in den darauffolgenden Jahren ebendiese Stammzellen von mehreren Forschungsgruppen in eigenen Versuchen nicht aufgefunden werden konnten, war die Existenz dieser Zellart zeitweilig stark umstritten (32, 33). Es konnte allerdings gezeigt werden, dass der Grund für die fehlende Auffindbarkeit der VSELs technischer Natur in der Durchführung der Durchflusszytometrie war (34). Spätestens als weitere Forschungsgruppen ebendiese Stammzellen nachweisen konnten (35), galt die Existenz der sehr kleinen embryonalähnlichen Stammzellen als wissenschaftlicher Konsens. In Zukunft sind diese Zellen vermutlich vergleichbar mit adulten, gewebsspezifischen Stammzellen hinsichtlich der klinischen Verwendbarkeit (36). Jedoch ist aktuell weitgehend unklar, ob die VSELs sich vollständig differenzieren und ihre Nachkommen sich in geschädigtes Gewebe integrieren können (37). Ein Vorteil dieser Zellen gegenüber den reprogrammierten Zellen ist jedoch eine mutmaßlich deutlich geringere Gefahr der Teratombildung sowie fehlende ethische Bedenken im Vergleich zu embryonalen Stammzellen (2). Insgesamt besteht noch zu wenig Evidenz über die genauen Eigenschaften der VSELs. Zudem gestaltet sich die Gewinnung von VSELs als schwierig, da nur ein sehr geringer Anteil der gesamten Zellen zu dieser Gruppe gehörig ist und die Isolierung kompliziert ist (38).
Adulte Stammzellen (adult stem cells, ASCs)
Adulte Stammzellen befinden sich zwar in geringer Anzahl, jedoch mutmaßlich nahezu ubiquitär im reifen Organismus und treiben Regenerationsprozesse an. Große Teile der Wissenschaft sind der Auffassung, dass ASCs sich in die Zellarten einer spezifischen Zelllinie differenzieren und abhängig vom Grad der Differenzierung als multipotent oder unipotent angesehen werden können: multipotente hämatopoetische Stammzellen haben ein größeres Potential zur Differenzierung in diverse Zelllinien des Blutes, und Zelllinien des Ektoderms als epidermale Stammzellen können sich ausschließlich zu Haut-spezifischen Zellen differenzieren (39). Allerdings sind multipotente Stammzellen an sich wiederum eine heterogene Gruppe. Die möglichen Differenzierungsmuster mesenchymaler Stammzellen (mesenchymal stem cells; MSCs) zum Beispiel, welche sich nach gängiger Definition in Zellen der mesenchymalen Linie differenzieren können, hängen im Wesentlichen von deren Gewebeherkunft ab. MSCs aus Nabelschnurblut sind zum Beispiel in der Lage, sich zu mehr Gewebearten zu differenzieren als etwa MSCs aus Synovialflüssigkeit (40). Folglich ist die Vergleichbarkeit von mehreren multipotenten Stammzelllinien eingeschränkt, da der Begriff „mesenchymale Stammzellen“ lediglich eine heterogene Gruppe von Stammzellen definiert, jedoch nicht eine explizite Zelllinie mit nahezu identischen Eigenschaften.
Die Nutzung adulter Stammzellen ist in der Medizin keine Neuheit: seit mehreren Jahrzehnten werden bereits hämatopoetische Stammzellen zur Behandlung von Leukämie-PatientInnen mittels Stammzelltransplantation genutzt (41). Erst im Jahr 2015 wurde von der European Medicines Agency (EMA) mit Holoclar® die erste nicht-hämatopoetische Stammzelltherapie zugelassen, welche auf dem Prinzip der Transplantation kornealer Stammzellen zur Behandlung degenerativer Erkrankungen der Hornhaut des Auges beruht (42). In den letzten Jahren wurden viele weitere Indikationen für den Einsatz adulter Stammzellen – insbesondere mesenchymaler Stammzellen – in grundlagenwissenschaftlichen und klinischen Studien überprüft, darunter Knochen-, Knorpel- und muskuloskelettale Regeneration sowie die Reparatur von Nervengewebe, Herzmuskulatur und Leberparenchym (43). Wie für die anderen Arten von Stammzellen gilt auch für die optimale Verwendung adulter Stammzellen die Notwendigkeit einer Immunkompabilität des Empfängers. Während die autologe Transplantation hierfür kein Problem darstellt, gestaltet sich eine allogene Transplantation schwieriger. Entscheidend für die Verträglichkeit der Stammzellen bei allogener Transplantation ist die Übereinstimmung der HLA-Merkmale. Die dadurch bei fehlendem HLA-Matching hervorgerufene Immunreaktion wird zwar schon seit längerer Zeit im Falle von Leukämien zur Eradikation maligner Zellen genutzt (41); bei der Anwendung von regenerativen Stammzellprodukten ist dieser Mechanismus jedoch kontraproduktiv. Für die umfassende Verwendung adulter Stammzellen spricht, dass die Rate an schwerwiegenden Nebenwirkungen beim Einsatz von mesenchymalen Stammzellen sehr gering ist (44). Mögliche Komplikationen in Form von Gewebefibrosierung und sogar Tumorentstehung (43) wurden zwar beschrieben, sind jedoch offenbar sehr selten und sollten aufgrund der mangelnden Vergleichbarkeit der heterogenen Stammzellapplikationen in den Kontext der jeweiligen Therapiesituation gestellt werden. Wie bei den anderen Stammzellformen auch ist die Isolierung und die Kultivierung im Labor für die Anwendung adulter Stammzellen hinderlich, da durch diese Maßnahmen eine Kontamination der Stammzellen erfolgen oder der optimale Therapiezeitpunkt verpasst werden könnte.
Das Konzept der gefäß-assoziierten pluripotenten Stammzellen (vascular-associated pluripotent stem cells, vaPS cells)
Die weit verbreitete Annahme, dass sich adulte Stammzellen ausschließlich in gewebespezifische Zelllinien differenzieren können, ist insbesondere seit der Entdeckung der VSELs umstritten, da die VSELs sich ebenfalls im reifen Organismus befinden. Unsere Arbeitsgruppe konnte aus Gefäßwänden von Menschen Zellen isolieren, welche die Fähigkeit zur Differenzierung in Zellen aller drei Keimschichtlinien besitzen (45). Bemerkenswert dabei ist, dass diese Zellen einerseits aus allen Blutgefäßen unabhängig von deren Gewebezugehörigkeit gewonnen werden können; andererseits konnte mittels verschiedener Experimente gezeigt werden, dass sich die Zellen unabhängig von der Gewebezugehörigkeit ihres ursprünglichen Blutgefäßes in Zellen der drei Keimschichten differenzieren können (45). Letztendlich ist es nicht geklärt, ob diese Zellen den VSELs entsprechen. Daher erhielten diese Stammzellen den Namen vascular-associated pluripotent stem cells (vaPS cells), also gefäß-assoziierte pluripotente Stammzellen. Denkbar ist auch, dass gefäß-assoziierte pluripotente Stammzellen längere Zeit fälschlicherweise für mesenchymale Stammzellen gehalten wurden und ihr vollständiges Differenzierungspotential nicht erkannt wurde. Interessant in diesem Zusammenhang ist zudem die wissenschaftliche Beschreibung der Fähigkeit zur pluripotenten Ausdifferenzierung von mikrovaskulären Perizyten (46), wobei hier viel eher die Fähigkeiten der vaPS fälschlicherweise aufgrund methodischer Mängel den Perizyten zugeschrieben wurden, die sich ebenfalls in unmittelbarer Nähe der Gefäßwände befinden. Experimente unserer Arbeitsgruppe konnten zeigen, dass die vaPS cells die Eigenschaft haben, mit anderen Zellen zu kommunizieren und sich in jegliches Zielgewebe zu integrieren. Im Falle einer Immundefizienz ist sogar eine xenogene Integration in vivo von humanen Stammzellen in Maus-Gewebe beschrieben worden (45).
Die Risiken der Verwendung von vaPS cells in der Klinik sind mutmaßlich vergleichbar mit den Risiken der Transplantation adulter Stammzellen bzw. der VSELs. Des Weiteren wurde beschrieben, dass die systemische Applikation von MSCs zu einem beschleunigten Tumorwachstum führen kann, da Malignome Zytokine und weitere Faktoren freisetzen, um zirkulierende Stammzellen an den Tumorort zu locken (47). Da jedoch bekannt ist, dass die vaPS explizit nicht isoliert werden müssen, entfallen die Risiken der Kultivierung der Stammzellen ((48); s. „ADRCs“), welche zumeist der weit verbreiteten Anwendung von Stammzellprodukten im Wege steht.
Aus Fettgewebe gewonnene regenerative Zellen (adipose-derived regenerative cells, ADRCs)
Das Prinzip der ADRCs ist ausführlich wissenschaftlich dokumentiert (48) und entspricht einer Liposuktion von Fettgewebe, welches in einem point-of-care-Verfahren aufbereitet wird. Die aufbereitete Zellsuspension enthält spezielle Stammzellen und weitere Zellarten, und wird unmittelbar nach Isolierung der Zellen aus dem Lipoaspirat direkt an den Ort des Gewebeschadens injiziert. In den zugehörigen Grundlagenarbeiten (zusammengefasst in (48)) wurden drei entscheidende Punkte bezogen auf die Gewinnung und Anwendung der ADRCs herausgearbeitet:
- Die für den Therapieeffekt entscheidenden Stammzellen (aller Wahrscheinlichkeit nach die vaPS bzw. adulte/mesenchymale Stammzellen) könnten auch aus jedem anderen Gewebe gewonnen werden; jedoch eignet sich Fettgewebe aufgrund der einfachen Zugänglichkeit, der Verzichtbarkeit dieses Gewebes für die meisten PatientInnen und die hohe Dichte an Gefäßen hierfür am besten.
- Zur Gewinnung von ADRCs wird das Liposuktionsmaterial von Adipozyten und Bindegewebsanteilen getrennt. Dies impliziert jedoch, dass neben Stammzellen auch andere Zelltypen in der resultierenden Zellsuspension vorhanden sind. Das spezifische Isolierungsverfahren hat einen signifikanten Einfluss auf die Anzahl und Lebensfähigkeit der gewonnenen Zellen und somit auf die Sicherheit und Wirksamkeit von ADRCs. Zu unterscheiden sind die aus Fettgewebe stammenden adipose-derived regenerative cells (ADRCs), bei denen nach der Liposuktion sowohl Adipozyten als auch Bindegewebe vollständig von den ADRCs abgetrennt werden, und sogenanntes „Nanofett“ und „Mikrofett“, bei denen der Gewebeverband des Fettgewebes nach Aufbereitung weitgehend erhalten bleibt bzw. das Bindegewebe von den Adipozyten separiert wird. „Nanofett“ und „Mikrofett“ zeichnen sich im Vergleich zu ADRCs durch eine geringe Dichte und Anzahl von Zellen bzw. lebender Stammzellen aus (vgl. Abb. 1.2). Zur speziellen Isolierung von ADRCs wird zudem zwischen enzymatischen und nicht-enzymatischen Verfahren unterschieden. Enzymatische Aufbereitungsmethoden von Lipoaspirat verfügen normalerweise über eine deutlich höhere Zellausbeute als nicht-enzymatische Methoden. In der Literatur bestehen außerdem große Unsicherheiten über die Anzahl von nicht-lebenden Zellen in den nicht-enzymatisch generierten ADRC-Suspensionen. Folglich sind die enzymatischen Aufbereitungsmethoden zur Gewinnung der ADRCs den nicht-enzymatischen Aufbereitungsmethoden überlegen (49).
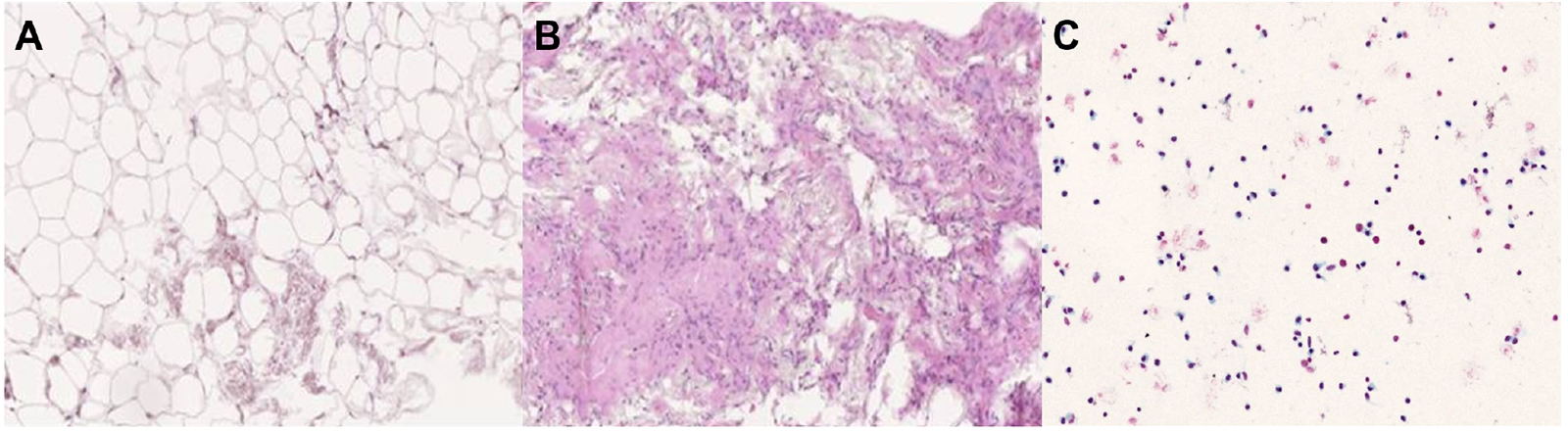
- Die Stammzellen an sich, die sog. adipose-derived stem cells (ADSCs) (die die vaPS cells einschließen), können aus der ADRC-Suspension mittels Aufbereitung und Kultur gewonnen werden. Hierfür besteht allerdings aus mehreren Gründen keine Notwendigkeit. Unter anderen gehen bestimmte Zellen, welche offenbar förderlich für den Regenerationsvorgang sind, durch die Aufbereitung verloren. Zahlreiche Studien haben gezeigt, dass die ADRCs den ADSCs nicht unterlegen, zum Teil sogar überlegen hinsichtlich ihrer Wirkung bei Herzmuskel-, Sehnen- oder Knochenregeneration sind (52-54). Der Vorteil einer fehlenden Kultivierung macht sich nicht nur in der zeitlichen Dimension aufgrund der Verfügbarkeit von ADRCs innerhalb von ca. 2 Stunden nach Liposuktion bemerkbar, sondern auch im fehlenden Risiko der Kontamination durch pathogene Erreger, Schadstoffe oder mechanischen und oxidativen Stress (55) während der Zeit der Kultur, während derer die Zellen besonders sensibel sind. In Kulturbedingungen zeigt sich ein verstärktes Wachstum der die Stammzellen begleitenden Zellen, wie z. B. Fibroblasten, während andere wichtige Vorläuferzellen verloren gehen.
An dieser Stelle sollte auch die Möglichkeit erwähnt werden, dass mesenchymale Stammzellen aus Zellmaterial des Knochenmarks gewonnen werden können: sogenannte bone marrow mesenchymal stem cells (BM-MSCs) bzw. bone marrow aspirate concentrate (BMAC). Abgesehen von geringeren, vermutlich individuellen Unterschieden sind sich mesenchymale Stammzellen aus dem Knochenmark und Fettgewebe hinsichtlich ihrer Morphologie, Oberflächeneigenschaften und ihrer Differenzierungskapazität weitgehend ähnlich (56). Da die mesenchymalen Stammzellen aus dem Knochenmark bereits seit vielen Jahren bekannt sind, werden in der regenerativen Medizin aktuell häufiger Methoden mit BM-MSCs erforscht und klinisch angewandt (57). Die Gewinnung von Stammzellen aus Fettgewebe hat jedoch mehrere Vorteile: Fettgewebe ist einfach und meistens in größerer Menge verfügbar, außerdem kann das Fettgewebe mit minimalinvasiven Verfahren unkompliziert gewonnen werden. Zellen des Knochenmarks müssen hingegen in einer meist schmerzhaften und invasiven Prozedur mittels Aspiration gewonnen werden (56). Obwohl die Knochenmarksaspiration ein sicheres und nebenwirkungsarmes Verfahren darstellt, bestehen doch Nachteile bezüglich des Schmerzes, Blutungsrisikos und der Morbidität der PatientInnen (56, 58). Der entscheidende Unterschied ist allerdings die Tatsache, dass der Anteil echter mesenchymaler Stammzellen am Knochenmarksaspirat sehr niedrig ist (<0.1 % aller aspirierten Zellen), während der Anteil von mesenchymalen Stammzellen in aspiriertem Fettgewebe um ein Vielfaches höher liegt (56, 59). Um im applizierbaren Stammzellprodukt also auf relevante Konzentrationen echter Stammzellen zu kommen, müssten die BM-MSCs zunächst isoliert und kultiviert werden. Dieser Prozess geht allerdings – wie weiter oben bereits ausführlich diskutiert – mit Zeitverlusten, Risiken der Kontamination sowie zellulärer Stressbelastung einher. Es wurden zwar Methoden etabliert, das Knochenmarksaspirat zum bone marrow aspirate concentrate (BMAC) zu konzentrieren, jedoch ist hierbei der Anteil mesenchymaler Stammzellen im Vergleich zu ADRCs mutmaßlich geringer und die bislang kommerziell erhältlichen Aufbereitungsmethoden sind schlecht verstanden und zu inhomogen: es bestehen starke Schwankungen in der Qualität des Aspirationskonzentrats sowie hinsichtlich des Stammzellen-Anteils (60).
In der klinischen Forschung zeigten erste Studien insbesondere bei der Therapie von partial-thickness rotator cuff tearseinen deutlichen Therapieerfolg bei Injektion von ADRCs im Vergleich zur Injektion von Kortikosteroid (der Standardtherapie von partial-thickness rotator cuff tears in den USA) (61, 62). In der Zukunft sind weitere Studien notwendig, um die genauen Therapiemechanismen und die klinischen Einsatzmöglichkeiten besser zu verstehen.
Literatur
1 Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luriá EA, Ruadkow IA. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol 1974;2(2):83-92.
2. Liu G, David BT, Trawczynski M, Fessler RG. Advances in pluripotent stem cells: History, mechanisms, technologies, and applications. Stem Cell Rev Rep 2020;16(1):3-32.
3. Golchin A, Chatziparasidou A, Ranjbarvan P, Niknam Z, Ardeshirylajimi A. Embryonic stem cells in clinical trials: current overview of developments and challenges. Adv Exp Med Biol 2021;1312:19-37.
4. Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM. Embryonic stem cell lines derived from human blastocysts. Science 1998;282(5391):1145-7.
5. Lo B, Parham L. Ethical issues in stem cell research. Endocr Rev 2009;30(3):204-13.
6. Ilic D, Ogilvie C. Concise review: human embryonic stem cells-What have we done? What are we doing? Where are we going? Stem Cells 2017;35(1):17-25.
7. Chung Y, Klimanskaya I, Becker S, Li T, Maserati M, Lu SJ, Zdravkovic T, Ilic D, Genbacev O, Fisher S, Krtolica A, Lanza R. Human embryonic stem cell lines generated without embryo destruction. Cell Stem Cell 2008;2(2):113-7.
8. Klimanskaya I, Chung Y, Becker S, Lu SJ, Lanza R. Derivation of human embryonic stem cells from single blastomeres. Nat Protoc 2007;2(8):1963-72.
9. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131(5):861-72.
10. Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J, Jonsdottir GA, Ruotti V, Stewart R, Slukvin II, Thomson JA. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007;318(5858):1917-20.
11. Ilic D, Devito L, Miere C, Codognotto S. Human embryonic and induced pluripotent stem cells in clinical trials. Br Med Bull 2015;116:19-27.
12. Bradley JA, Bolton EM, Pedersen RA. Stem cell medicine encounters the immune system. Nat Rev Immunol 2002;2(11):859-71.
13. Halloran PF, Broski AP, Batiuk TD, Madrenas J. The molecular immunology of acute rejection: an overview. Transpl Immunol 1993;1(1):3-27.
14. Roy NS, Cleren C, Singh SK, Yang L, Beal MF, Goldman SA. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat Med 2006;12(11):1259-68.
15. Gepstein L, Ding C, Rahmutula D, Wilson EE, Yankelson L, Caspi O, Gepstein A, Huber I, Olgin JE. In vivo assessment of the electrophysiological integration and arrhythmogenic risk of myocardial cell transplantation strategies. Stem Cells 2010;28(12):2151-61.
16. Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell 2010;142(3):375-86.
17. Sekiya S, Suzuki A. Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors. Nature 2011;475(7356):390-3.
18. Ohnuki M, Takahashi K. Present and future challenges of induced pluripotent stem cells. Philos Trans R Soc Lond B Biol Sci 2015;370(1680):20140367.
19. Waddington CH. The strategy of the genes. A discussion of some aspects of theoretical biology. London, UK: George Allen & Unwin; 1957.
20. Young MA, Larson DE, Sun CW, George DR, Ding L, Miller CA, Lin L, Pawlik KM, Chen K, Fan X, Schmidt H, Kalicki-Veizer J, Cook LL, Swift GW, Demeter RT, Wendl MC, Sands MS, Mardis ER, Wilson RK, Townes TM, Ley TJ. Background mutations in parental cells account for most of the genetic heterogeneity of induced pluripotent stem cells. Cell Stem Cell 2012;10(5):570-82.
21. Rouhani F, Kumasaka N, de Brito MC, Bradley A, Vallier L, Gaffney D. Genetic background drives transcriptional variation in human induced pluripotent stem cells. PLoS Genet 2014;10(6):e1004432.
22. Kim K, Doi A, Wen B, Ng K, Zhao R, Cahan P, Kim J, Aryee MJ, Ji H, Ehrlich LI, Yabuuchi A, Takeuchi A, Cunniff KC, Hongguang H, McKinney-Freeman S, Naveiras O, Yoon TJ, Irizarry RA, Jung N, Seita J, Hanna J, Murakami P, Jaenisch R, Weissleder R, Orkin SH, Weissman IL, Feinberg AP, Daley GQ. Epigenetic memory in induced pluripotent stem cells. Nature 2010;467(7313):285-90.
23. Takahashi K, Tanabe K, Ohnuki M, Narita M, Sasaki A, Yamamoto M, Nakamura M, Sutou K, Osafune K, Yamanaka S. Induction of pluripotency in human somatic cells via a transient state resembling primitive streaklike mesendoderm. Nat Commun 2014;5:3678.
24. Ohi Y, Qin H, Hong C, Blouin L, Polo JM, Guo T, Qi Z, Downey SL, Manos PD, Rossi DJ, Yu J, Hebrok M, Hochedlinger K, Costello JF, Song JS, Ramalho-Santos M. Incomplete DNA methylation underlies a transcriptional memory of somatic cells in human iPS cells. Nat Cell Biol 2011;13(5):541-9.
25. Yamanaka S. Patient-specific pluripotent stem cells become even more accessible. Cell Stem Cell 2010;7(1):1-2.
26. Yamashita A, Morioka M, Kishi H, Kimura T, Yahara Y, Okada M, Fujita K, Sawai H, Ikegawa S, Tsumaki N. Statin treatment rescues FGFR3 skeletal dysplasia phenotypes. Nature 2014;513(7519):507-11.
27. Lee AS, Tang C, Rao MS, Weissman IL, Wu JC. Tumorigenicity as a clinical hurdle for pluripotent stem cell therapies. Nat Med 2013;19(8):998-1004.
28. Jung Y, Bauer G, Nolta JA. Concise review: Induced pluripotent stem cell-derived mesenchymal stem cells: progress toward safe clinical products. Stem Cells 2012;30(1):42-7.
29. Campbell KH, McWhir J, Ritchie WA, Wilmut I. Sheep cloned by nuclear transfer from a cultured cell line. Nature 1996;380(6569):64-6.
30. Liu Z, Cai Y, Wang Y, Nie Y, Zhang C, Xu Y, et al. Cloning of macaque monkeys by somatic cell nuclear transfer. Cell 2018;172(4):881-7 e7.
31. Kucia M, Reca R, Campbell FR, Zuba-Surma E, Majka M, Ratajczak J, Ratajczak MZ. A population of very small embryonic-like (VSEL) CXCR4(+)SSEA-1(+)Oct-4+ stem cells identified in adult bone marrow. Leukemia 2006 May;20(5):857-69.
32. Miyanishi M, Mori Y, Seita J, Chen JY, Karten S, Chan CK, Nakauchi H, Weissman IL. Do pluripotent stem cells exist in adult mice as very small embryonic stem cells? Stem Cell Reports 2013;1(2):198-208.
33. Danova-Alt R, Heider A, Egger D, Cross M, Alt R. Very small embryonic-like stem cells purified from umbilical cord blood lack stem cell characteristics. PLoS One. 2012;7(4):e34899.
34. Suszynska M, Mierzejewska K, Liu R, Ratajczak J, Shin DM, Kucia M. Very small embryonic-like stem cells (VSELs) represent a real challenge in stem cell biology: recent pros and cons in the midst of a lively debate. Leukemia 2014;28(3):473-84.
35. Bhartiya D, Shaikh A, Anand S, Patel H, Kapoor S, Sriraman K, Parte S, Unni S. Endogenous, very small embryonic-like stem cells: critical review, therapeutic potential and a look ahead. Hum Reprod Update 2016;23(1):41-76.
36. Ratajczak MZ, Ratajczak J, Suszynska M, Miller DM, Kucia M, Shin DM. A novel view of the adult stem cell compartment from the perspective of a quiescent population of very small embryonic-like stem cells. Circ Res 2017;120(1):166-78.
37. Ratajczak MZ, Ratajczak J, Kucia M. Very Small Embryonic-Like Stem Cells (VSELs). Circ Res. 2019;124(2):208-10.
38. Bhartiya D. Adult tissue-resident stem cells-fact or fiction? Stem Cell Res Ther 2021;12(1):73.
39. Dulak J, Szade K, Szade A, Nowak W, Jozkowicz A. Adult stem cells: hopes and hypes of regenerative medicine. Acta Biochim Pol 2015;62(3):329-37.
40. Mushahary D, Spittler A, Kasper C, Weber V, Charwat V. Isolation, cultivation, and characterization of human mesenchymal stem cells. Cytometry A 2018;93(1):19-31.
41. Simpson E, Dazzi F. Bone Marrow Transplantation 1957-2019. Front Immunol 2019;10:1246.
42. Ruan Y, Jiang S, Musayeva A, Pfeiffer N, Gericke A. Corneal epithelial stem cells-physiology, pathophysiology and therapeutic options. Cells 2021;10(9).
43. Han Y, Li X, Zhang Y, Han Y, Chang F, Ding J. Mesenchymal stem cells for regenerative medicine. Cells 2019;8(8).
44. Lalu MM, McIntyre L, Pugliese C, Fergusson D, Winston BW, Marshall JC, et al. Safety of cell therapy with mesenchymal stromal cells (SafeCell): a systematic review and meta-analysis of clinical trials. PLoS One 2012;7(10):e47559.
45. Alt EU, Schmitz C, Bai X. Perspective: Why and how ubiquitously distributed, vascular-associated, pluripotent stem cells in the adult body (vaPS Cells) are the next generation of medicine. Cells 2021;10(9).
46. Davidoff MS. The pluripotent microvascular pericytes are the adult stem cells even in the testis. Adv Exp Med Biol 2019;1122:235-67.
47. Gehmert S, Gehmert S, Prantl L, Vykoukal J, Alt E, Song YH. Breast cancer cells attract the migration of adipose tissue-derived stem cells via the PDGF-BB/PDGFR-beta signaling pathway. Biochem Biophys Res Commun 2010;398(3):601-5.
48. Alt EU, Winnier G, Haenel A, Rothoerl R, Solakoglu O, Alt C, et al. Towards a comprehensive understanding of UA-ADRCs (uncultured, autologous, fresh, unmodified, adipose derived regenerative cells, isolated at point of care) in regenerative medicine. Cells 2020;9(5).
49. Winnier GE, Valenzuela N, Peters-Hall J, Kellner J, Alt C, Alt EU. Isolation of adipose tissue derived regenerative cells from human subcutaneous tissue with or without the use of an enzymatic reagent. PLoS One 2019;14(9):e0221457.
50. Schmitz C, Würfel T, Alt C, Alt EU. Behandlung von Sehnenrupturen mit Stammzellen: eine aktuelle Übersicht. Obere Extremität 2022;17(3):141-53.
51. Cicione C, Vadalà G, Di Giacomo G, Tilotta V, Ambrosio L, Russo F, Zampogna B, Cannata F, Papalia R, Denaro V. Micro-fragmented and nanofat adipose tissue derivatives: In vitro qualitative and quantitative analysis. Front Bioeng Biotechnol 2023;11:911600.
52. Sheu JJ, Lee MS, Wallace CG, Chen KH, Sung PH, Chua S, Lee FY, Chung SY, Chen YL, Li YC, Yip HK. Therapeutic effects of adipose derived fresh stromal vascular fractioncontaining stem cells versus cultured adipose derived mesenchymal stem cells on rescuing heart function in rat after acute myocardial infarction. Am J Transl Res 2019;11(1):67-86.
53. Nyberg E, Farris A, O’Sullivan A, Rodriguez R, Grayson W. Comparison of stromal vascular fraction and passaged adipose-derived stromal/stem cells as point-of-care agents for bone regeneration. Tissue Eng Part A 2019;25(21-22):1459-69.
54. Polly SS, Nichols AEC, Donnini E, Inman DJ, Scott TJ, Apple SM, Werre SR, Dahlgren LA. Adipose-Derived Stromal Vascular Fraction and Cultured Stromal Cells as Trophic Mediators for Tendon Healing. J Orthop Res 2019;37(6):1429-1439.
55. Cossu G, Birchall M, Brown T, De Coppi P, Culme-Seymour E, Gibbon S, Hitchcock J, Mason C, Montgomery J, Morris S, Muntoni F, Napier D, Owji N, Prasad A, Round J, Saprai P, Stilgoe J, Thrasher A, Wilson J. Lancet Commission: Stem cells and regenerative medicine. Lancet 2018;391(10123):883-910.
56. Mohamed-Ahmed S, Fristad I, Lie SA, Suliman S, Mustafa K, Vindenes H, Idris SB. Adipose-derived and bone marrow mesenchymal stem cells: a donor-matched comparison. Stem Cell Res Ther 2018;9(1):168.
57. Mavrogenis AF, Karampikas V, Zikopoulos A, Sioutis S, Mastrokalos D, Koulalis D, Scarlat MM, Hernigou P. Orthobiologics: a review. Int Orthop 2023;47(7):1645-1662.
58. Tomasian A, Jennings JW. Bone marrow aspiration and biopsy: techniques and practice implications. Skeletal Radiol. 2022 Jan;51(1):81-88.
59. Beane OS, Darling EM. Isolation, characterization, and differentiation of stem cells for cartilage regeneration. Ann Biomed Eng 2012;40(10):2079-97.
60. Lamplot JD, Rodeo SA, Brophy RH. A Practical Guide for the Current Use of Biologic Therapies in Sports Medicine. Am J Sports Med 2020;48(2):488-503.
61. Hurd JL, Facile TR, Weiss J, Hayes M, Hayes M, Furia JP, Maffulli N, Winnier GE, Alt C, Schmitz C, Alt EU, Lundeen M. Safety and efficacy of treating symptomatic, partial thickness rotator cuff tears with fresh, uncultured, unmodified, autologous adipose-derived regenerative cells (UA-ADRCs) isolated at the point of care: a prospective, randomized, controlled first-in-human pilot study. J Orthop Surg Res 2020;15(1):122.
62. Lundeen M, Hurd JL, Hayes M, Hayes M, Facile TR, Furia JP, Maffulli N, Alt C, Alt EU, Schmitz C, Pearce DA. Management of partial-thickness rotator cuff tears with autologous adipose-derived regenerative cells is safe and more effective than injection of corticosteroid. Sci Rep 2023;13(1):19348.
Autoren
ist Assistenzarzt Sektion Sportorthopädie, TUM Universitätsklinikum Rechts der Isar, München. Er hat am Lehrstuhl Anatomie II der LMU über die regenerative Stammzelltherapie bei Sehnendefekten promoviert. Seine Forschungsschwerpunkte sind die Extrakorporale Stoßwellentherapie (ESWT) und physikalische Verfahren in der Orthopädie. Zuvor war er in der sportmedizinischen Praxis MedWorks Augsburg tätig.