Arthrose entwickelt sich als degenerative Gelenkerkrankung zunehmend zu einer Volkskrankheit mit erheblicher sozioökonomischer Bedeutung. Allein in Deutschland liegt die Prävalenz bei über 5 Millionen, mit steigender Tendenz aufgrund der demografischen Entwicklung und der Zunahme von Risikofaktoren wie Adipositas und Bewegungsmangel [1]. Umso drängender stellt sich die Frage nach effektiven Präventions- und Behandlungsstrategien.
Pathogenese der Arthrose: Entzündung als Schlüsselfaktor
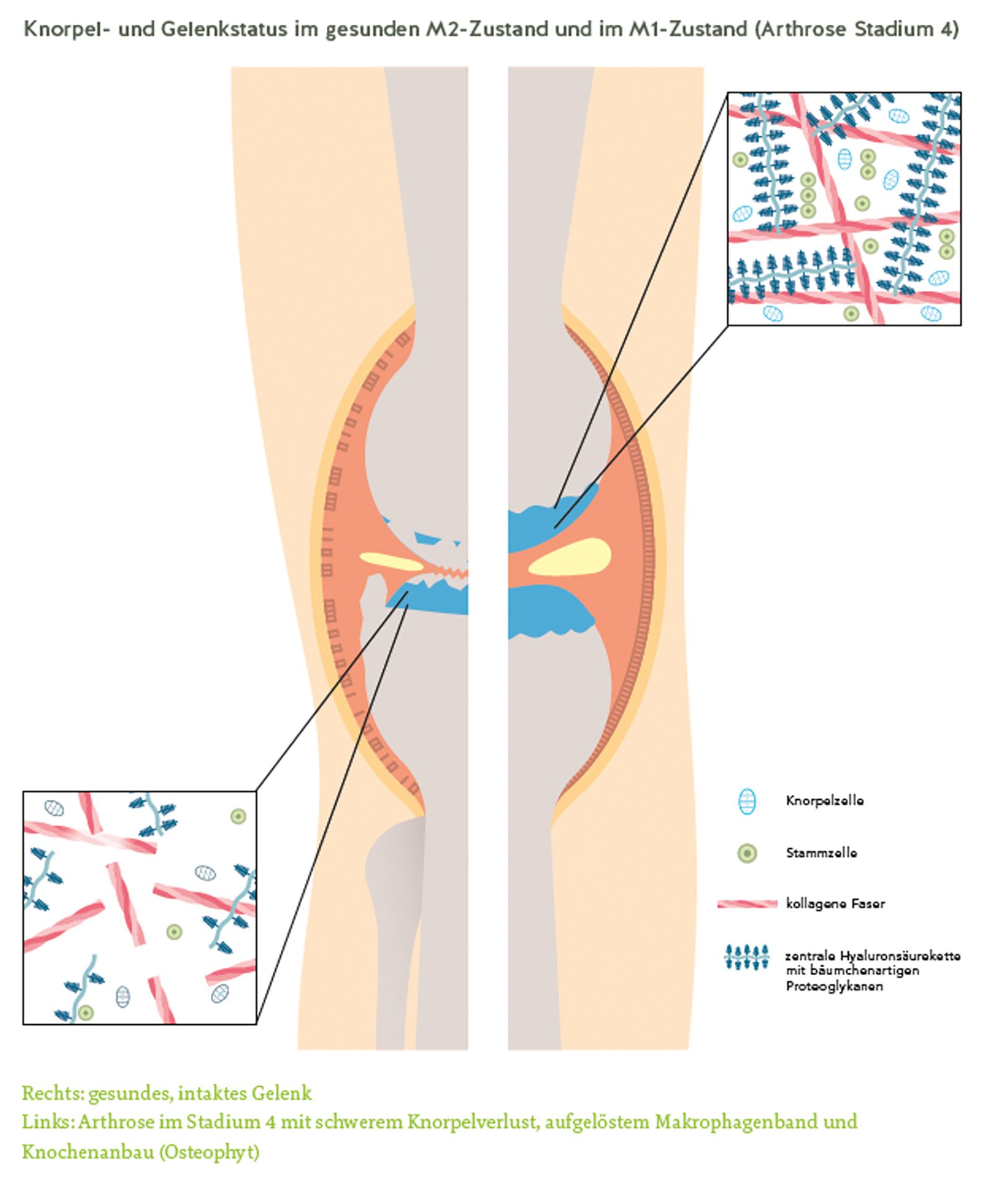
Lange galt Arthrose als reine Verschleißerkrankung, verursacht durch langjährige mechanische Überlastung der Gelenke. Neuere Forschungsergebnisse zeigen jedoch, dass chronisch-entzündliche Prozesse im Sinne einer Low-grade-Inflammation eine Schlüsselrolle in der Pathogenese spielen [2]. Zentrale Akteure sind die synovialen Makrophagen, die je nach Zytokinprofil und Aktivierungszustand proinflammatorische, gewebsdestruktive (M1-Phänotyp) oder anti-inflammatorische, regenerative Eigenschaften (M2-Phänotyp) aufweisen [3]. Im arthrotischen Gelenk verschiebt sich das Gleichgewicht zugunsten des M1-Phänotyps (Tab. 1). Die Lokalisation der Makrophagen liegt hauptsächlich in der Synovialmembran. Beim arthrotischen Gelenk ist die Synovialmembran geschädigt und die Makrophagen liegen im M1-Zustand vor – im gesunden Gelenk ist die Synovialmembran geschlossen und liegt entsprechend im M2- Zustand vor (siehe Abb. 1).
Tabelle 1: Eigenschaften von M1- und M2-Makrophagen
| Eigenschaft | M1-Makrophagen | M2-Makrophagen |
| Aktivierung durch | IFN-γ, LPS, TNF-α | IL-4, IL-13 |
| Sekretion von | IL-1β, IL-6, IL-12, IL-23, TNF-α | IL-10, TGF-β, IL-1RA |
| Wirkung | proinflammatorisch, gewebsdestruktiv | anti-inflammatorisch, regenerativ |
| Marker | iNOS, CD86, HLA-DR | CD163, CD206, Arginase-1 |
Knorpelregeneration: Überzeugende Evidenz
Lange galt Gelenkknorpel aufgrund seiner avaskulären Struktur und der geringen Zelldichte als nicht regenerationsfähig. Aktuelle Studien zeigen jedoch, dass im subchondralen Knochenmark mesenchymale Stammzellen (MSCs) residieren, die prinzipiell in der Lage sind, in geschädigtes Knorpelgewebe einzuwandern, sich zu teilen und zu Chondrozyten zu differenzieren [4]. Dieser endogene Reparaturmechanismus ist bei Arthrose durch die chronische Inflammation und durch eine Verschiebung des Zytokinprofils (Tab. 2) beeinträchtigt bzw. ausgeschaltet. Mesenchymale Stammzellen residieren jedoch auch im Knorpelgewebe selbst. Sie liegen hier häufig im schlafenden Zustand vor und können angeregt durch M2-Botenstoffe zu Knorpelvorläuferzellen, sogenannte Progenitorenzellen, aktiviert werden und sich dann zu voll funktionsfähigen Knorpelzellen differenzieren. Solange die Makrophagen jedoch im entzündungsfördernden M1 Zustand sind, bleiben MSCs im schlafenden Zustand oder sterben sogar ab. Der Anschaltknopf für eine erfolgreiche Knorpelregeneration ist deshalb, die Makrophagen durch vielfältige Maßnahmen nachhaltig in den M2 Zustand zu polarisieren.
Tabelle 2: Pro- und anti-chondrogene Faktoren
| Prochondrogen | Antichondrogen |
| IGF-1 | IL-1β |
| TGF-β | TNF-α |
| BMP-2, BMP-7 | IL-6 |
| FGF-2, FGF-18 | PGE2 |
| Wnt-Signaling | iNOS |
Kausale Arthrosetherapie: Ein multimodaler Ansatz
Ziel einer kausalen Arthrosetherapie muss es sein, die Induktoren der Silent Inflammation zu reduzieren und gleichzeitig regenerative Signalwege zu stimulieren. In unserem Buch „Arthrose endlich heilen“ (GU Verlag, ISBN: 978-3-8338-9184-7) stellen wir dazu ein ganzheitliches Behandlungskonzept vor, das vier Säulen umfasst:
- Entzündungssenkende Ernährung
Eine antiinflammatorische Ernährung bildet die Basis der Arthrosetherapie. Sie sollte reich an Omega-3-Fettsäuren, sekundären Pflanzenstoffen und löslichen Ballaststoffen sein. Ein hohes antiinflammatorisches Potential besitzen Kräuter und Gewürze, weshalb eine hohe Aufnahme dieser Lebensmittel im Rahmen einer entzündungssenkenden Ernährung essenziell ist. Zusätzlich sollten Entzündungspromotoren wie ein Übermaß an kohlenhydrathaltigen Beilagen, an Zucker sowie an Omega-6 und industriellen Transfetten limitiert werden. Studien zeigen, dass eine solche Ernährungsweise den Krankheitsverlauf positiv beeinflusst [5]. - Gelenkaktivierendes Bewegungsprogramm
Regelmäßige körperliche Aktivität ist essenziell für den Erhalt der Gelenkgesundheit. Moderate Belastung fördert die Diffusion von Nährstoffen in den Knorpel und ist notwendig für den Erhalt eines gesunden Knorpels [6a]. Bewegung fördert aber auch zusätzlich die Polarisierung der Makrophagen in den heilenden M2 Zustand [6b] Entscheidend sind Regelmäßigkeit und die richtige Dosierung, um diese M2-Polarisierung zu unterstützen. Empfehlenswert ist eine Kombination aus Koordinations- und funktionellen Kräftigungsübungen, um eine gute allgemeine Grundlage aufzubauen. Ergänzt werden sollten diese Übungen mit weiteren speziellen gelenkmobilsierenden Übungen und mit einem ruhigen Ausdauertraining z.B. Walking, Schwimmen oder Radfahren. - Stressreduktion und Entspannung
Psychischer Stress ist ein unterschätzter Risikofaktor für Arthrose, der individuelle Lösungen braucht. Über die Daueraktivierung der Hypothalamus-Hypophysen-Nebennierenrinden-Achse und eine erhöhte Sympathikusaktivität verstärkt er Entzündungsprozesse, hemmt regenerative Signalwege [7a] und aktiviert die knorpelabbauende Ausrichtung der Makrophagen in den M1 Zustand [7b]. Stressreduktion durch Entspannungstechniken wie Meditation, Yoga, Atemtechniken, progressive Muskelrelaxation oder positives Affirmationstraining sollten daher integraler Bestandteil der Arthrosetherapie sein. - Gezielte Nährstoffversorgung zur Unterstützung der Knorpelregeneration
Eine gezielte Nährstoffversorgung wirkt unterstützend auf den Knorpelstoffwechsel und auf die Polarisierung der Makrophagen in den regenerationsfördernden M2 Zustand. Eine Auswahl der wichtigsten Nährstoffe, ihre Dosierung, Nahrungsquellen und Wirkmechanismen sind in Tabelle 3 zusammengefasst.
Tabelle 3: Nährstoffe zur Unterstützung des Knorpelstoffwechsels und der direkten Polarisierung der Makrophagen in den M2 Zustand. Alle Nährstoffe mit entzündungssenkenden Wirkungen verbessern die Knorpelhomöostase und tragen so indirekt auch zur Polarisierung der M2 Makrophagen bei.
| Nährstoff | Dosierung | Lebensmittel-/Pflanzenquelle | Einfluss auf Arthrose | Skala |
| Glucosaminsulfat | 1500 mg/d | Chitosan, Krustentiere, Nahrungsergänzung | Stimuliert Synthese der Knorpelmatrix | 9 |
| Chondroitinsulfat | 800-1200 mg/d | Knorpel, Knochen, Nahrungsergänzung | Hemmt Matrix-Metalloproteinasen, fördert Proteoglykansynthese | 8 |
| Kollagen-Hydrolysat | 10 g/d | Kollagenreiches Gewebe, Nahrungsergänzung | Liefert Aminosäuren für Knorpelsynthese | 7 |
| natürliche Kieselsäure | >600 mg/d | Ackerschachtelhalm (Equisetum arvense) Brennnessel (Urtica dioica), Nahrungsergänzung |
Fördert Kollagen-Quervernetzung und wirkt entzündungssenkend | 7 |
| Vitamin C | 1000 mg/d | Acerola, Hagebutten, Sanddorn, Vitamin C Pulver | Cofaktor der Kollagensynthese, entzündungssenkend, antioxidativ [8 a,b] | 8 |
| Omega-3-Fettsäuren EPA+DHA | 2-4 g/d | Kaltwasserfische, Nahrungsergänzung in Form von Fischöl- oder Algenölkapseln |
Entzündungssenkend [9 a,b] M2 polarisierend [9 c] |
8 |
| Vitamin D3 | 4000-5000 I.E./d | Angereicherte Pilze, Lebertran, Nahrungsergänzung |
M2 Polarisierung über Hemmung von NF-kB und über Aktivierung des Vitamin D Rezeptors [10] | 7 |
| Curcumin | 500-1000 mg/d | Kurkumawurzel; Nahrungsergänzung |
M2 Polarisierung über Hemmung von NFκB, COX-2 und IL-4 und/ IL-13.[11]; entzündungssenkend, schmerzlindernd |
7 |
| Boswelliasäuren | 600-1200 mg/d | Weihrauch; Nahrungsergänzung |
M2-Polarisierung über Hemmung von TNF-a, IL-1ß und 5-LOX [12]; analgetisch | 7 |
| Vitamin K2 | 200 µg/d | Natto, Käse, Eigelb, Nahrungsergänzung |
Knorpelschutz durch GPX4 Aktivierung [13] | 6 |
| Hyaluronsäure | 200 mg/d | Hahnenkamm, produziert von Bakterien, Nahrungsergänzung | verbessert Viskoelastizität der Synovialflüssigkeit | 6 |
| Quercetin | 500-1000 mg/d | Kapern, Zwiebeln, Äpfel, Nahrungsergänzung |
fördert M2 Polarisierung und IL-10 [14]; entzündungssenkend, Stabilisierung von Mastzellen | 5 |
| Ingwerextrakt | 1000-2000 mg/d | Ingwerwurzel, Nahrungsergänzung |
fördert M2 Polarisierung [15a] entzündungssenkend und analgetisch [15 b-d] | 5 |
| Resveratrol | 150-500 mg/d | Weintrauben, Maulbeeren, Japanischer Staudenknöterich; Nahrungsergänzung |
Fördert M2 Polarisierung [16]; entzündungssenkend | 5 |
| Methionin oder S-Adenosyl-Methionin (SAM-e) | 400-1500 mg/d | als Aminosäure oder als angereicherte Hefe, Nahrungsergänzung |
Methylgruppen-Donor, fördert Reparatur, fördert die Bildung von Proteoglykanen, Hyaluronsäure und Kollagen, entzündungssenkend, Schmerzlinderung | 5 |
| Methylsulfonylmethan (MSM) | 2-6 g/d | Produziert durch Oxidation von DMSO, Nahrungsergänzung |
siehe Methionin- Wirkung | 5
|
| Bor | 3-10 mg/d | Rotwein, Obst, Nüsse, Hülsenfrüchte, Nahrungsergänzung | unterstützt Knochen- und Knorpelstoffwechsel, entzündungssenkend [17] | 4 |
Glucosaminsulfat und Chondroitinsulfat zählen zu den am besten untersuchten Nährstoffen bei Arthrose. In Metaanalysen führte die Kombination zu signifikanter Schmerzreduktion und Verbesserung der Gelenkfunktion [18]. Glucosamin dient als Baustein für die Synthese von Glykosaminoglykanen wie Hyaluronsäure, die essentiell für die Stoßdämpferfunktion des Knorpels sind. Chondroitin hemmt knorpelabbauende Enzyme und fördert die Bildung neuer Knorpelmatrix.
Kollagen-Hydrolysate liefern die Aminosäuren Prolin, Hydroxyprolin und Glycin, die Bausteine für die Kollagensynthese im Knorpel. Studien zeigen, dass die orale Einnahme von Kollagen-Hydrolysaten Gelenkschmerzen lindern und die Knorpeldicke erhöhen kann [19].
Kieselsäure mit dessen Zentralatom Silizium verbessert die Bildung, den Zusammenhalt und die Dichte von Knorpel- und Knochengewebe[10]. Reich an gut bioverfügbarer Kieselsäure sind Ackerschachtelhalm (Equisetum arvense) und Brennnessel (Urtica Dioica). Beide Pflanzen haben darüber hinaus auch eine gut dokumentierte entzündungssenkende bzw. schmerzdämpfende Kapazität [21a-e].
Vitamin C ist als Cofaktor der Prolyl- und Lysylhydroxylase unverzichtbar für die Kollagenbildung. Außerdem wirkt es als Radikalfänger antioxidativ und schützt so die Knorpelmatrix [8 a, b].
Omega-3-Fettsäuren, insbesondere Eicosapentaensäure (EPA) und Docosahexaensäure (DHA), sind potente Entzündungshemmer. Sie reduzieren die Bildung von Prostaglandin E2 und Leukotrienen und fördern die Synthese von entzündungsauflösenden Resolvinen [22].
Vitamin D moduliert das Immunsystem und hat direkte Effekte auf den Knorpelstoffwechsel. Ein niedriger Vitamin-D-Spiegel ist mit einem erhöhten Arthroserisiko und stärkeren Gelenkschmerzen assoziiert [23].
Curcumin, Boswellia und Ingwerextrakt sind pflanzliche Entzündungshemmer mit schmerzlindernden Eigenschaften. Sie greifen auf verschiedenen Ebenen in inflammatorische Signalkaskaden ein, u.a. über die Hemmung von NFκB, COX-2 und 5-LOX [24, 25].
Methionin ist eine schwefelhaltige essentielle Aminosäure, die im Stoffwechsel vielfältige Funktionen erfüllt. Im Kontext der Arthrose ist sie vor allem als Vorstufe von S-Adenosyl-Methionin (SAM-e) bedeutsam, einem wichtigen Methylgruppen-Donor und kann sowohl Schmerzen lindern als auch die Gelenkfunktion verbessern [26]. SAM-e fördert die Synthese von Proteoglykanen und Glykosaminoglykanen wie Hyaluronsäure, die für die Stoßdämpferfunktion des Knorpels essenziell sind [27].
Methylsulfonylmethan (MSM) ist wie Methionin ein Lieferant von organischem Schwefel und wirkt im Knorpelstoffwechsel wie Methionin bzw. SAMe [28]. Aufgrund der breiteren Studienlage und als Baustein für die körpereigene Glutathionbildung empfehlen wir Methionin anstelle von MSM.
Zunehmend Bedeutung für ein gutes Arthrosemanagement erlangt darüber hinaus das Spurenelement Bor bei größeren Dosierungen von täglich mehr als 3 mg [17]. Die täglich behördlich erlaubte Höchstdosierung an Bor über ein Nahrungsergänzungsmittel liegt in der EU bei 10 mg – in den USA bei 20 mg.
Insgesamt zeigt sich, dass eine gezielte Supplementierung sowohl Nährstoffe zur Matrixregeneration als auch entzündungsregulierende, M2-fördernde Substanzen umfassen sollte. Synergistisch kombiniert, tragen sie dazu bei, den Teufelskreis aus Knorpeldestruktion und Inflammation zu durchbrechen und die biologische Knorpelregeneration anzustoßen.
Fallbeispiel: Von der schweren Knieverletzung zum Weltmeister: Der bemerkenswerte Fall von Winfried Heckner
Posttraumatische Knorpelschäden des Grades IV bedeuten oft langfristige Beeinträchtigungen und das Ende sportlicher Karrieren. Die folgende Kasuistik beschreibt die außergewöhnliche Genesung des Leichtathleten Winfried Heckner, der die Dr. Feil Strategie erfolgreich angewendet hat und mit seinem Heilungserfolg zeigt, wie ein moderner nährstoffmedizinischer Ansatz in Kombination mit intensiver Rehabilitation zu bemerkenswerten klinischen Ergebnissen führen kann.
Patienten Hintergrund und initiale Diagnostik
Winfried Heckner, ein Leichtathlet bei den Masters, spezialisiert auf 60 m, 100 m, 200 m und 60 m Hürden, erlitt nach einem Unfall eine schwerwiegende Knieverletzung. Die initiale Diagnostik mittels MRT und klinischer Untersuchung ergab einen posttraumatischen Knorpelschaden der medialen Oberschenkelrolle des linken Kniegelenks (Grad IV), begleitet von einem korrespondierenden Knorpelschaden in der Gelenkfläche des Tibiaplateaus. Diese Befunde implizierten signifikante strukturelle Schäden mit potenziell irreversiblen funktionellen Defiziten.
Therapeutische Entscheidung und Intervention
Auf der Suche nach alternativen Therapieansätzen wurde Heckner auf einen Vortrag von Dr. Wolfgang Feil aufmerksam, der einen integrativen, nährstoffmedizinischen Ansatz zur Knorpelregeneration vorstellte. Basierend auf den Empfehlungen von Dr. Feil entschied sich Heckner für eine umfassende Therapie, die folgende Komponenten beinhaltete:
- Nährstoffmedizinische Intervention:
– Glucosamin- & Chondroitinsulfat, Kollagenhydrolysat, Methionin, Ackerschachtelhalm und Brennnessel: Zur Förderung der Knorpelmatrix-Synthese.
– Umfassende entzündungssenkende Nährstoffe (Omega-3 Fettsäuren, Bor, Kupfer, Zink, Selen, Vitamin C, E, umfassende Pflanzen- und Gewürzextrakte): zur Unterstützung der Polarisierung der Makrophagen in den regenerativen M2 Zustand - Intensive Rehabilitation:
– Physiotherapeutische Maßnahmen: Fokus auf isometrische Übungen zur Muskelstärkung und Verbesserung der Gelenkstabilität – Funktionelles Training: Spezifische Übungen zur Wiederherstellung der biomechanischen Funktionen des Kniegelenks.
Verlauf und klinische Ergebnisse
Nach 12 Monaten zeigte ein erstes medizinisches Gutachten eine signifikante Regeneration des Knorpels. Die kernspintomographischen Aufnahmen belegten die Bildung von Neoknorpel im Bereich des medialen Tibiakopfes und der Hauptbelastungszone des medialen Femurcondylus. Diese Befunde waren klinisch signifikant und bestätigten die Effektivität der nährstoffmedizinischen und rehabilitativen Interventionen.
Nach insgesamt 18 Monaten wurde die Behandlung abgeschlossen. Die abschließenden kernspintomographischen Aufnahmen und klinischen Untersuchungen zeigten, dass keine messbare Beeinträchtigung der Funktionsfähigkeit des linken Beines infolge des erlittenen Unfalls bestand. Das orthopädische Gutachten bestätigte: „Es hat sich wieder frischer, neuer Knorpel gebildet“ und „keine weiteren klinischen Folgen des Unfalls“ waren nachweisbar.
Sportliche Rückkehr und Erfolge
Mit seinem vollständig regenerierten Kniegelenk kehrte Heckner in den Leistungssport zurück und erzielte bemerkenswerte Erfolge: Winfried Heckner ist bis heute aktiv im Wettkampfgeschehen und gewann nach seiner Rückkehr insgesamt 18 Deutsche Meistertitel, zwei Europameistertitel und 5 Vizeweltmeistertitel. Der Höhepunkt seiner sportlichen Laufbahn war der Weltmeistertitel in der 4 x 100 m Staffel der Masters M 70 in Finnland im Jahr 2022.
Schlussfolgerung
Winfried Heckners Fall illustriert eindrucksvoll die Potenziale einer integrativen Therapie bei schweren Knorpelschäden. Die Kombination aus nährstoffmedizinischen Interventionen und intensivem, gezieltem Rehabilitationsprogramm führte nicht nur zu einer vollständigen Regeneration des Knorpels, sondern ermöglichte auch die Rückkehr auf höchstes sportliches Niveau.
Fazit
Die Erkenntnisse der molekularen Gelenkbiologie eröffnen neue Perspektiven für die Arthrosetherapie. Statt Knorpeldegeneration als irreversibel zu betrachten, gilt es, die endogenen Reparaturmechanismen gezielt zu unterstützen. Mit einem ganzheitlichen, antiinflammatorischen und regenerativen Ansatz ist eine Modulation und Ausheilung des Krankheitsverlaufs möglich. Auch ist es wichtig, die Patienten als aktive Partner zu begreifen und zu einem gelenkfreundlichen Lebensstil zu motivieren. Arthrose ist eine komplexe Erkrankung – sie erfordert interdisziplinäre Lösungen. Die neuen Erkenntnisse der Wissenschaft stimmen zuversichtlich: Die Arthrosetherapie der Zukunft ist regenerativ.
Buchtipp

Arthrose endlich heilen: Das neue Dr. Feil Buch „Arthrose endlich heilen“ (GU Verlag, ISBN: 978-3-8338-9184-7) fasst den aktuellen Wissensstand zur Knorpelregeneration zusammen und bietet ein ganzheitliches Therapiekonzept für Arthrose-Patienten. Neben fundierten medizinischen Hintergrundinformationen enthält es praktische Anleitungen zu gelenkfreundlicher Ernährung, Bewegung, Stressbewältigung und Nährstoffversorgung. Ziel ist es, Betroffene zu ermutigen, aktiv zu werden und gemeinsam mit ihrem Behandler eine individuelle, multimodale Strategie gegen Arthrose zu entwickeln.
Literatur
[1] Fuchs J, Rabenberg M, Scheidt-Nave C. Prävalenz ausgewählter muskuloskelettaler Erkrankungen. Bundesgesundheitsblatt-Gesundheitsforschung-Gesundheitsschutz. 2013;56(5-6):678-686.
[2] Robinson WH, Lepus CM, Wang Q, et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nat Rev Rheumatol. 2016;12(10):580-592.
[3] Wang N, Liang H, Zen K. Molecular mechanisms that influence the macrophage M1–M2 polarization balance. Front Immunol. 2014;5:614.
[4] Jiang Y, Tuan RS. Origin and function of cartilage stem/progenitor cells in osteoarthritis. Nat Rev Rheumatol. 2015;11(4):206-212.
[5] Messier SP, Mihalko SL, Legault C, et al. Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial. JAMA. 2013;310(12):1263-1273.
[6a] Sun HB. Mechanical loading, cartilage degradation, and arthritis. Ann N Y Acad Sci. 2010;1211:37-50.
[6b] Callegari, I. O. M., Rocha, G. Z., & Oliveira, A. G. (2023). Physical exercise, health, and disease treatment: The role of macrophages. Frontiers in physiology, 14, 1061353. https://doi.org/10.3389/fphys.2023.1061353
[7a] Tian, R., Hou, G., Li, D., & Yuan, T. F. (2014). A possible change process of inflammatory cytokines in the prolonged chronic stress and its ultimate implications for health. TheScientificWorldJournal, 2014, 780616.
[7b] Slusher, A. L., & Acevedo, E. O. (2023). Stress induced proinflammatory adaptations: Plausible mechanisms for the link between stress and cardiovascular disease. Frontiers in physiology, 14, 1124121. https://doi.org/10.3389/fphys.2023.1124121
[8a] Chiu, P. R., Hu, Y. C., Huang, T. C., Hsieh, B. S., Yeh, J. P., Cheng, H. L., Huang, L. W., & Chang, K. L. (2016). Vitamin C Protects Chondrocytes against Monosodium Iodoacetate-Induced Osteoarthritis by Multiple Pathways. International journal of molecular sciences, 18(1), 38. https://doi.org/10.3390/ijms18010038
[8b] Dunlap B, Patterson GT, Kumar S, Vyavahare S, Mishra S, Isales C, Fulzele S. Vitamin C supplementation for the treatment of osteoarthritis: perspectives on the past, present, and future. Ther Adv Chronic Dis. 2021 Oct 20;12:20406223211047026. doi: 10.1177/20406223211047026. PMID: 34729150; PMCID: PMC8543556.
[9a] Camuesco D, Gálvez J, Nieto A, Comalada M, Rodríguez-Cabezas ME, Concha A, Xaus J, Zarzuelo A. Dietary olive oil supplemented with fish oil, rich in EPA and DHA (n-3) polyunsaturated fatty acids, attenuates colonic inflammation in rats with DSS-induced colitis. J Nutr. 2005 Apr;135(4):687-94. doi: 10.1093/jn/135.4.687. PMID: 15795419.
[9b] Cordingley DM, Cornish SM. Omega-3 Fatty Acids for the Management of Osteoarthritis: A Narrative Review. Nutrients. 2022 Aug 16;14(16):3362. doi: 10.3390/nu14163362. PMID: 36014868; PMCID: PMC9413343.
[9c] Videla LA, Valenzuela R, Del Campo A, Zúñiga-Hernández J. Omega-3 Lipid Mediators: Modulation of the M1/M2 Macrophage Phenotype and Its Protective Role in Chronic Liver Diseases. Int J Mol Sci. 2023 Oct 24;24(21):15528. doi: 10.3390/ijms242115528. PMID: 37958514; PMCID: PMC10647594.
[10] Yin K, You Y, Swier V, Tang L, Radwan MM, Pandya AN, Agrawal DK. Vitamin D Protects Against Atherosclerosis via Regulation of Cholesterol Efflux and Macrophage Polarization in Hypercholesterolemic Swine. Arterioscler Thromb Vasc Biol. 2015 Nov;35(11):2432-42. doi: 10.1161/ATVBAHA.115.306132. Epub 2015 Sep 3. PMID: 26381871; PMCID: PMC4743769.
[11] Gao, S., Zhou, J., Liu, N., Wang, L., Gao, Q., Wu, Y., Zhao, Q., Liu, P., Wang, S., Liu, Y., Guo, N., Shen, Y., Wu, Y., & Yuan, Z. (2015). Curcumin induces M2 macrophage polarization by secretion IL-4 and/or IL-13. Journal of Molecular and Cellular Cardiology, 85, 131–139. https://doi.org/10.1016/j.yjmcc.2015.04.025
[12] Ammon HP. Modulation of the immune system by Boswellia serrata extracts and boswellic acids. Phytomedicine. 2010 Sep;17(11):862-7. doi: 10.1016/j.phymed.2010.03.003. Epub 2010 Aug 8. PMID: 20696559.
[13] He Q, Lin Y, Chen B, Chen C, Zeng J, Dou X, Cai D, Zhou C, Wang H. Vitamin K2 ameliorates osteoarthritis by suppressing ferroptosis and extracellular matrix degradation through activation GPX4’s dual functions. Biomed Pharmacother. 2024 May 16;175:116697. doi: 10.1016/j.biopha.2024.116697. Epub ahead of print. PMID: 38759289
[14] Tsai CF, Chen GW, Chen YC, Shen CK, Lu DY, Yang LY, Chen JH, Yeh WL. Regulatory Effects of Quercetin on M1/M2 Macrophage Polarization and Oxidative/Antioxidative Balance. Nutrients. 2021 Dec 24;14(1):67. doi: 10.3390/nu14010067. PMID: 35010945; PMCID: PMC8746507
[15a] Tripathi S, Bruch D, Kittur DS. Ginger extract inhibits LPS induced macrophage activation and function. BMC Complement Altern Med. 2008 Jan 3;8:1. doi: 10.1186/1472-6882-8-1. PMID: 18173849; PMCID: PMC2234390.
[15b] Altmann, R.D., Marcussen, K.C. (2001): Effects of Ginger extract on knee pain in patients with osteoarthritis. Arthritis Rheum.44(11):2531–2538. ‑ Altern, J. (2005): Ginger extract components suppress induction of chemokine expression in human synoviocytes. Complement Med.; 11; (1); 149–154.[15c] Grzanna, R. et al. (2005): Ginger – an herbal medicinal product with broad anti-inflammatory actions. J Med Food; 8 (2): 125–32.
[15d] Wigler, I. et al. (2003): The effects of Zintona (a ginger extract) on symptomatic gonarthritis. Osteoarthritis Cartilage, 11 (11); 783–9. [16] Ding, Y., Yang, P., Li, S., Zhang, H., Ding, X., & Tan, Q. (2022). Resveratrol accelerates wound healing by inducing M2 macrophage polarisation in diabetic mice. Pharmaceutical Biology, 60(1), 2328–2337. https://doi.org/10.1080/13880209.2022.2149821
[17] Pizzorno L. Nothing Boring About Boron. Integr Med (Encinitas). 2015 Aug;14(4):35-48. PMID: 26770156; PMCID: PMC4712861.
[18] Zhu, X., Sang, L., Wu, D., Rong, J., & Jiang, L. (2018). Effectiveness and safety of glucosamine and chondroitin for the treatment of osteoarthritis: a meta-analysis of randomized controlled trials. Journal of orthopaedic surgery and research, 13(1), 170. https://doi.org/10.1186/s13018-018-0871-5
[19] García-Coronado, J. M., Martínez-Olvera, L., Elizondo-Omaña, R. E., Acosta-Olivo, C. A., Vilchez-Cavazos, F., Simental-Mendía, L. E., & Simental-Mendía, M. (2019). Effect of collagen supplementation on osteoarthritis symptoms: a meta-analysis of randomized placebo-controlled trials. International orthopaedics, 43(3), 531–538. https://doi.org/10.1007/s00264-018-4211-5
[20] Saudelli G, Tinti L, Suffritti G (2018) A Review on the Treatment of Osteoporosis with Equisetum arvense. Gen Med (Los Angeles) 6: 313. doi:10.4172/2327-5146.1000313
[21a] Jiang X., Qu Q., Li M., Miao S., Li X., Cai W. Horsetail mixture on rheumatoid arthritis and its regulation on TNF-αand IL-10. Pak. J. Pharm. Sci. 2014;27:201
[21b] Gründemann, C., Lengen, K., Sauer, B., Garcia-Käufer, M., Zehl, M., & Huber, R. (2014). Equisetum arvense (common horsetail) modulates the function of inflammatory immunocompetent cells. BMC complementary and alternative medicine, 14, 283. https://doi.org/10.1186/1472- 6882-14-283
[21c] Klingelhöfer, S, u.a. (1999): Antirheumatic effect of IDS 23, a stinging nettle leaf extract, on in vitro expression of T helper cytokines. J Rheumatol. 26(12):2517-22.
[21d] Schulze-Tanzil, G. u.a. (2002): Effects of the antirheumatic remedy hox alpha–a new stinging nettle leaf extract–on matrix metalloproteinases in human chondrocytes in vitro. Histol Histopathol. 17(2):477-85.
[21e] Randall, C. u.a. (2000): Randomized controlled trial of nettle sting for treatment of base-of-thumb- pain. J R Soc Med; 93; 305-09.
[22] Boe C, Vangsness CT. Fish oil and osteoarthritis: current evidence. Am J Orthop (Belle Mead NJ). 2015;44(7):302-305.
[23] Hussain, S., Singh, A., Akhtar, M., & Najmi, A. K. (2017). Vitamin D supplementation for the management of knee osteoarthritis: a systematic review of randomized controlled trials. Rheumatology international, 37(9), 1489–1498. https://doi.org/10.1007/s00296-017-3719-0
[24] Perkins, K., Sahy, W., & Beckett, R. D. (2017). Efficacy of Curcuma for Treatment of Osteoarthritis. Journal of evidence-based complementary & alternative medicine, 22(1), 156–165. https://doi.org/10.1177/2156587216636747
[25] Yu, G., Xiang, W., Zhang, T., Zeng, L., Yang, K., & Li, J. (2020). Effectiveness of Boswellia and Boswellia extract for osteoarthritis patients: a systematic review and meta-analysis. BMC complementary medicine and therapies, 20(1), 225. https://doi.org/10.1186/s12906-020-02985-6
[26] Najm, W.I., Reinsch, S., Hoehler, F. et al. S-Adenosyl methionine (SAMe) versus celecoxib for the treatment of osteoarthritis symptoms: A double-blind cross-over trial. [ISRCTN36233495]. BMC Musculoskelet Disord 5, 6 (2004). https://doi.org/10.1186/1471-2474-5-6
[27] Najm, W. I., Reinsch, S., Hoehler, F., Tobis, J. S., & Harvey, P. W. (2004). S-adenosyl methionine (SAMe) versus celecoxib for the treatment of osteoarthritis symptoms: a double-blind cross-over trial. [ISRCTN36233495]. BMC musculoskeletal disorders, 5, 6. https://doi.org/10.1186/1471-2474-5-6
[28] Butawan, M., Benjamin, R. L., & Bloomer, R. J. (2017). Methylsulfonylmethane: Applications and Safety of a Novel Dietary Supplement. Nutrients, 9(3), 290. https://doi.org/10.3390/nu9030290
Autoren
ist Biologe und Sportwissenschaftler. 1994 gründete er in Tübingen die Forschungsgruppe Dr. Feil, die inzwischen international ausgerichtet und in den USA ansässig ist. In Ernährungsfragen beriet Dr. Feil die Bundesliagvereine TSG Hoffenheim, Werder Bremen, die Rhein-Neckar-Löwen und Frisch-Auf Göppingen, ebenso Leistungssportler wie den Triathleten Jan Frodeno und den mehrfachen Ringerweltmeister Frank Stäbler.
ist Heilpraktiker für Physiotherapie und Sportphysiotherapeut. Er ist Inhaber der der THerapie.Welt in München. Außerdem ist Tobias Homburg Physiotherapeut der dt. Biathlon Nationalmannschaft sowie Dozent der Forschungsgruppe Dr. Feil und kPNI Akademie für „intermittend living“.