Der systemische Einsatz von nicht-steroidalen Antiphlogistika (NSAID) ist im Profisport eine gängige und mittlerweile alltägliche Praxis. Jeder dritte Fußballprofi nimmt vor wichtigen Spielen Präparate wie Ibuprofen, Diclofenac oder andere Schmerzmittel ein. Dies geht aus einer Studie der FIFA im British Journal of Sports Medicine 2012 hervor. Bei der Fußball WM 2010 nahmen über 60 % aller Spieler regelhaft Schmerzmittel ein [1].
Diese besorgniserregende Praxis beschränkt sich aber leider nicht nur auf den Spitzensport, da auch Hobby- und Breitensportler vor sportlichen Belastungen gerne zu Schmerzmitteln greifen. Die potenziellen Nebenwirkungen von NSAID, wie gastro-intestinale Erosionen der Mukosa, gastro-duodenale Ulcera, kardiovaskuläre Komplikationen und Niereninsuffizienz, sind seit Jahrzehnten belegt [2, 3]. Insbesondere der dauerhafte Einsatz von nicht selektiven Hemmstoffen der Cyclooxigenasen (COX 1 und COX 2), wie Ibuprofen, ist gerade in Verbindung mit Leistungssport problematisch für die Nieren [4]. Der Elektrolyt- und Wasserverlust bei körperlicher Hochleistung gemeinsam mit der vermehrten Belastung der Nieren durch Muskelabbauprodukte kann zu irreversiblen Nierenschädigungen führen, da die Analgetika zu einer Reduktion der entsprechenden protektiven Prostaglandine führen.
Obwohl Ärzte und Patienten sich über die möglichen Folgen einer regelmäßigen Einnahme von Schmerzmitteln bewusst sein sollten, haben bisher leider selbst dramatische Fallbeispiele, wie die mehrfache Nierentransplantation des ehemaligen Fußball-Profis Ivan Klasnic, nicht zu einem Paradigmenwechsel im Umgang mit Schmerzmitteln im Sport geführt. Alleine in den USA werden jährlich über 30 Milliarden Tabletten NSAID verkauft. Zudem gibt es Berichte von über 2,5 Millionen Schmerzmittel-induzierten Nierenerkrankungen pro Jahr [5]. Daher erscheint der Bedarf an nebenwirkungsfreien Alternativen zu NSAID-Präparaten ungebrochen.
Polyphenole: Eine natürliche Alternative
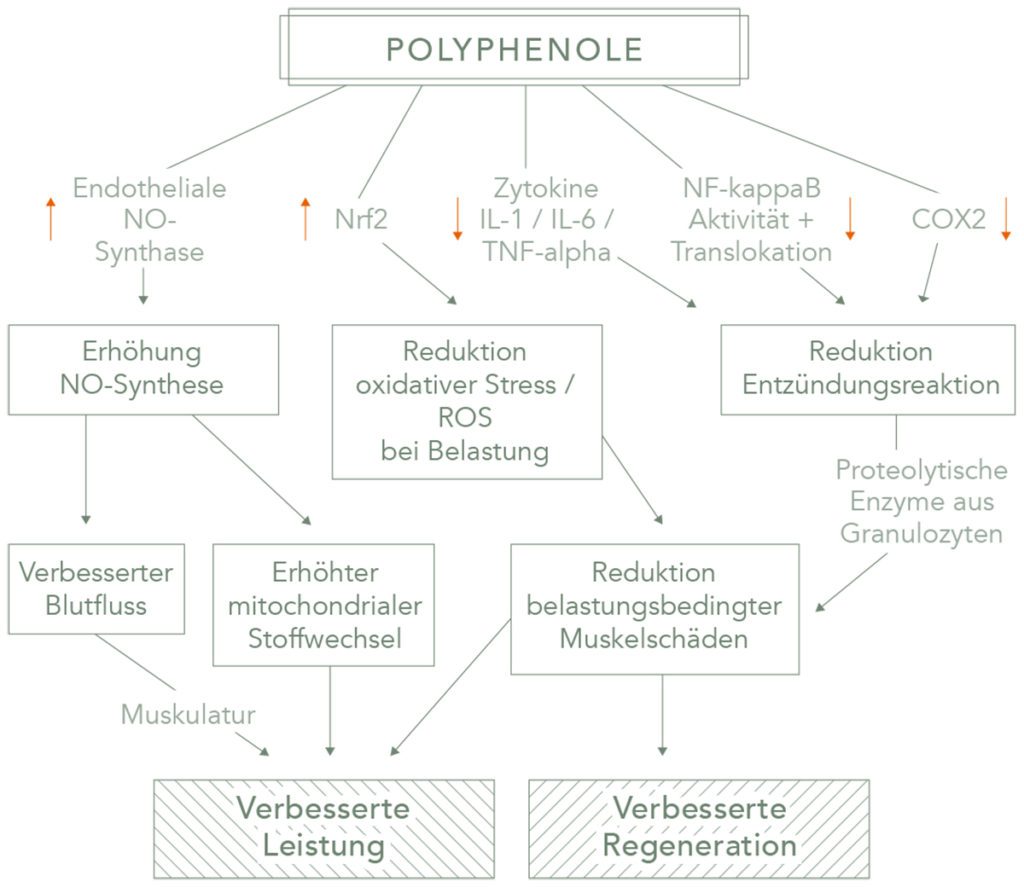
Polyphenole zählen zu den sekundären Pflanzenstoffen und werden aufgrund ihrer chemischen Struktur in Flavonoide und Nonflavonoide eingeteilt. Sie umfassen über 8000 verschiedene Substanzen, die in Pflanzen als bioaktive Farb-, Geschmacks- und Gerbstoffe vorkommen. Sie schützen Pflanzen vor Pathogenen und Krankheiten. Zu den medizinisch relevantesten Polyphenolen zählen z. B. Flavonoide und Anthocyane aus dunklen Beeren sowie das Curcumin aus der Gelbwurzel Kurkuma. Die entzündungshemmende, immun-modulatorische, anti-oxidative, kardiovaskulär-protektive und anti-kanzerogene bzw. zellschützende Wirkung von Polyphenolen wurde durch eine Vielzahl von Studien belegt [6 – 8]. Diese Vielfalt von positiven Eigenschaften basiert auf der Tatsache, dass Polyphenole eine potenzielle Wirkung auf verschiedene entzündungshemmende Mechanismen besitzen. Sie regulieren Populationen von Immunzellen (T-Helferzellen, Makrophagen), die Aktivität von Signal-Transkriptionsfaktoren (NF-kappaB) sowie Proteinkinasen (MAPK). Ferner inhibieren sie pro-inflammatorische Enzyme (COX 2) sowie die Produktion von pro-inflamatorischen Zytokinen (IL 1, IL 6, TNF-alpha) [9]. Zudem reduzieren sie oxidativen Stress, verursacht durch freie Sauerstoffradikale, durch ihren Effekt auf NRF2 (Nuclear Factor (erythroid-derived 2)-like 2), dem Hauptregulator des körpereigenen Schutzmechanismus vor freien Sauerstoffradikalen [10, 11].
Die entzündungshemmende Wirkung von Polyphenolen, wie Anthocyanen aus Kirschen und Beeren oder Curcumin, ist mit der von NSAID vergleichbar [12 – 14]. Einige Studien belegen sogar eine überlegene Wirkung der Polyphenole bei deutlich weniger Nebenwirkungen. Die schmerz- und entzündungshemmende Wirkung NSAID beruht vor allem auf der Hemmung der Cyclooxigenase 2. Montmorency-Kirschen zeigten in vitro eine Hemmung des COX-2-Enzyms von 84 – 91 % [15] und damit eine signifikant bessere COX-2-Inhibierung als Ibuprofen und Naproxen. In vivo zeigte sich eine deutliche Schmerzreduktion [16] sowie eine Reduktion von proinflamatorischen Zytokinen (IL-1, IL-6, IL-8, TNF α) und Entzündungsmarkern (CRP) (Connoly et al. 2006, Howatson et al. 2010) nach Polyphenolgabe [17, 18]. Curcumin zeigte in aktuellen klinischen Studien eine gleichwertige Schmerzreduktion wie 100 mg Diclofenac bzw. 200 mg Celecoxib bei Patienten mit Arthrose, ohne relevante Nebenwirkungen [19, 20]. Die Einnahme von 1000 mg Curcuma in Kombination mit Boswelia serrata zeigte eine bessere entzündungshemmende Wirkung des COX-2-Enzyms als 200 mg Celecoxib, ohne dass relevante Nebenwirkungen auftraten [20]. Eine entzündungshemmende Wirkung durch Reduktion der NF-kappaB-Aktivität und durch Erhöhung der anti-oxidativen Kapazität konnte auch nach Supplementierung mit Polyphenolen aus Blaubeeren, schwarzen Johannisbeeren [21, 22] und Granatapfel [23] nachgewiesen werden.
Polyphenole und Regeneration
NSAID werden nicht nur zur Schmerzreduktion, sondern häufig auch mit der Intention eingesetzt, die Regeneration zu verbessern. Sie können kurzfristig Schmerzen nach belastungsinduzierten Muskelschäden reduzieren [24], haben aber einen negativen Effekt auf die Regeneration, da sie die Proteinbiosynthese hemmen [25]. Sportbedingte Muskelschäden entstehen durch mechanische sowie biochemische Einflüsse. Bei intensiver Belastung entstehen übermäßig viele freie Sauerstoffradikale, die zusammen mit proinflammatorischen Zytokinen eine potente Entzündungsreaktion auslösen. Bei einer sehr ausgeprägten Entzündungsreaktion können von Granulozyten freigesetzte proteolytische Enzyme und Sauerstoffradikale den initialen Muskelschaden noch verstärken und die Regenerationszeit verlängern [26]. Sekundäre Pflanzenstoffe können Schmerzen ähnlich effektiv lindern wie NSAID-Präparate. Im Gegensatz zu NSAID können Polyphenole durch ihren umfangreichen Einfluss auf unterschiedliche entzündungshemmende (COX 2, NFKb), antioxidative (NRF2) und vasodilatorische (eNOS) Mechanismen die Regeneration nach belastungsinduzierten Muskelschäden verbessern. Polyphenole neutralisieren Sauerstoffradikale nicht durch direkte Bindung, sondern durch Erhöhung der endogenen NRF2-Aktivität und haben somit keinen negativen Einfluss auf den gewünschten Adaptionsprozess der Muskulatur auf Trainingsreize [27, 28]. Eine Meta-Analyse aus dem Sports Medicine Journal 2019 kam zu dem Schluss, dass eine akute Einnahme von 300 mg Polyphenole vor sportlicher Belastung durch verbesserte Muskelperfusion ergogen wirkt. Zudem führt eine regelmäßige Gabe von ca. 1000 mg Polyphenole zu einer deutlich schnelleren Regeneration nach sportlicher Belastung, da durch eine Verminderung des Entzündungsprozesses und der Sauerstoffradikale der muskuläre Schaden begrenzt bleibt [29].

Fazit und Praxisrelevanz
Polyphenole sind in der Lage, Schmerzen und Entzündungsprozesse ohne nachteilige Wirkung zu reduzieren. Neben des gesundheitsfördernden Potenzials, sind diese positiven Eigenschaften in der Sportmedizin einsetzbar, um die Regeneration zu verbessern und die Leistung zu optimieren. In der klinischen Praxis sind die limitierenden Faktoren die Verfügbarkeit und die benötigte Dosierung. Der Polyphenolgehalt von Früchten ist stark von Faktoren wie Kultivierung, Zubereitung und Konservierung abhängig. Beim Kochen gehen rund 50 % der Polyphenole verloren. Zudem enthalten die hier im Supermarkt erhältlichen kultivierten Blaubeeren im Vergleich zu den natürlich vorkommenden wilden Blaubeeren (Bilberries) kaum noch Polyphenole in nennenswerten Dosierungen und sind somit für den therapeutischen Einsatz ungeeignet. Zur Verbesserung der Regeneration ist ein täglicher Verzehr von ca. 450 g wilden Blaubeeren, 300 g süßen Kirschen und 120 g schwarze Johannisbeeren nötig [30], um einen nachweisbaren Effekt zu erzielen. Langfristig lassen sich solche Dosierungen durch den Verzehr von kultivierten Früchten nur schwer realisieren und sind fast nur durch den gezielten Einsatz von Nahrungsergänzungen zu erreichen. Innovative, gefriergetrocknete Extrakte aus verschiedenen Polyphenol-Quellen wie Montmorency-Kirschen, Billberries, schwarzen Johannisbeeren und Kurkuma ermöglichen eine einfache Aufnahme entsprechender therapeutischer Dosierungen und damit einen praktikablen Einsatz in der Schmerztherapie und Sportmedizin.
Literatur
[1] Tscholl PM, Dvorak J. Abuse of medication during international football competition in 2010 – lesson not learned; Br J Sports Med. 2012 Dec;46(16):1140-1
[2] Sengupta K, Alluri KV, Satish AR, Mishra S, Golakoti T, Sarma KV, et al. A double blind, randomized, placebo controlled study of the efficacy and safety of 5-Loxin for treatment of osteoarthritis of the knee. Arthritis Res Ther. 2008;10:R85.
[3] Devi RS, Narayan S, Vani G, Shyamala Devi CS. Gastroprotective effect of Terminalia arjuna bark on diclofenac sodium induced gastric ulcer. Chem Biol Interact. 2007;167:71–83.
[4] Brune, K., Niederweis, U., Krämieer, B. (2008). Sport und Schmerzmittel: Unheilige Allianz zum Schaden der Niere. Dtsch Arztebl 105(37), A-1894/B-1630/C-1594.
[5] Sandhu, G.K.; Heyneman, C.A. Nephrotoxic potential of selective cyclooxygenase-2 inhibitors. Ann. Pharmacother.2004, 38, 700–704.
[6] Yoon, J.H.; Baek, S.J. Molecular Targets of Dietary Polyphenols with Anti-Inflammatory Properties. Yonsei Med. J. 2005, 46, 585–596.
[7] Scalbert, A.; Manach, C.; Morand, C.; Rémésy, C.; Jiménez, L. Dietary Polyphenols and the Prevention of Diseases. Crit. Rev. Food Sci. Nutr. 2005, 45, 287–306.
[8] Bengmark, S. Acute and “Chronic” Phase Reaction-a Mother of Disease. Clin. Nutr. 2004, 23, 1256–1266.
[9] Peluso I, Raguzzini A, Serafini M. Effect of flavonoids on circulating levels of TNF- and IL-6 in humans: a systematic review and meta-analysis. Mol Nutr Food Res. 2013;57(5):784–801.
[10] Ramirez-Sanchez I, Taub PR, Ciaraldi TP, Nogueira L, Coe T, Perkins G, et al. (-)-Epicatechin rich cocoa mediated modulation of oxidative stress regulators in skeletal muscle of heart failure and type 2 diabetes patients. Int J Cardiol. 2013;168(4):3982–90.
[11] Itoh K, Chiba T, Takahashi S, Ishii T, Igarashi K, Katoh Y, et al. An Nrf2 small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response ele- ments. Biochem Biophys Res Commun. 1997;236(2):313–22.
[12] Seeram, N. P.; Momin, R. A.; Bourquin, L. D.; Nair, M. G. Cycloozygenase and antioxidant cyaniding glycosides in cherries and berries. Phytomedicine 2001, 8, 362–369.
[13] Wang, H.; Nair, M. G.; Strasburg, G. M.; Change, Y.-C.; Booren, A. M.; Gray, J. I.; DeWitt, D. L. Cyclo-oxygenase active bioflavonoids from Balaton tart cherry and their structure activity relationships. Phytomedicine 2000, 7, 15–19.
[14] Kuptniratsaikul V, Thanakhumtorn S, Chinswangwatanakul P, Wattanamongkonsil L, Thamlikitkul V. Efficacy and safety of Curcuma domestica extracts in patients with knee osteoarthritis. J Altern Complement Med. 2009;15:891–7.
[15] Mulagabal V, Lang, GA, DeWitt DL, Dalavoy SS, Nair MG; Anthocyanin Content, Lipid Peroxidation and Cyclooxygenase Enzyme Inhibitory Activities of Sweet and Sour Cherries. J. Agric. Food Chem. 2009, 57, 1239-1246
[16] Kuehl KS, Perrier ET, Elliot DL, Chesnutt JC. Efficacy of tart cherry juice in reducing muscle pain during running: a randomized control trial. J Int Soc Sports Nutr 2010;7:17.
[17] Connolly DA, McHugh MP, Padilla-Zakour OI. Efficacy of a tart cherry juice blend in preventing the symptoms of muscle damage. Br J Sports Med 2006;40:679-683.
[18] Howaston G, McHugh MP, Hill JA, et al. Influence of tart cherry juice on indices of recovery following marathon running. Scand J Med Sci Sports 2010;20:843-852.
[19] Shep D, Khanwelkar C, Gade P, Karad S. Safety and efficacy of curcumin versus diclofenac in knee osteoarthritis: a randomized open-label parallel-arm study. Trials (2019)20:214
[20] Kizhakkedath R. Clinical evaluation of a formulation containing Curcuma longa and Boswelia serrata extracts in the management of knee osteoarthritis. Mol Med Rep. 2013 Nov;8(5):1542-8
[21] Karlsen A, Paur I, Bohn SK, Sakhi AK, Borge GI, Serafini M, et al. Bilberry juice modulates plasma concentration of NF-kappa B related inflammatory markers in subjects at increased risk of CVD. Eur J Nutr. 2010;49(6):345–55
[22] Hutchison AT, Flieller EB, Dillon KJ, Leverett BD. Blackcur- rant nectar reduces muscle damage and inflammation follow- ing a bout of high-intensity eccentric contractions. J Diet Suppl. 2016;13:1–15.
[23] Sohrab G, Nasrollahzadeh J, Zand H, Amiri ZU, Tohidi M, Kimiagar M. Effects of pomegranate juice consumption on inflammatory markers in patients with type 2 diabetes: A randomized, placebo-controlled trial. J Res Med Sci. 2014 Mar;19(3):215-20.
[24] Morelli KM, Brown LB, Warren GL: Effect of NSAIDs on Recovery from acute skeletal muscle injury. A systematic review and meta-analysis. Am J Sports Med. 2018 Jan; 46(1):224-233
[25] Trappe TA, White F, Lambert CP, Cesar D, Hellerstein M, Evans WJ: Effect of Ibuprofen and Acetaminophen on postexercise muscle protein synthesis. Am J Physiol Endocrinol Metab. 2002 Mar;282 (3): E551-6
[26] Zerria K, Jerbi E, Hammami S, Maaroufi A, Boubaker S, Xiong JP, et al. Recombinant integrin CD11b A-domain blocks polymorphonuclear cells recruitment and protects against skeletal muscle inflammatory injury in the rat. Immunology. 2006;119(4):431–40.
[27] Gliemann L, Olesen J, Bienso RS, Schmidt JF, Akerstrom T, Nyberg M, et al. Resveratrol modulates the angiogenic response to exercise training in skeletal muscles of aged men. Am J Phys- iol. 2014;307(8):H1111–9.
[28] Scribbans TD, Ma JK, Edgett BA, Vorobej KA, Mitchell AS, Zelt JGE, et al. Resveratrol supplementation does not augment performance adaptations or fibre-type-specific responses to high- intensity interval training in humans. Appl Physiol Nutr Metab. 2014;39(11):1305–13.
[29] Bowtell J, Kelly V; Fruit-Derived Polyphenol Supplementation for Athlete Recovery and Performance; Sports Medicine (2019) 49 (1): S3-23
[30] Rothwell JA, Medina-Remon A, Perez-Jimenez J, Neveu V, Knaze V, Slimani N, et al. Effects of food processing on poly- phenol contents: a systematic analysis using Phenol-Explorer data. Mol Nutr Food Res. 2015;59(1):160–70.
Autoren
(M.D.)(USA), ist Facharzt für Orthopädie/Unfallchirurgie und Sportmedizin. Seit September 2013 ist er Leitender Arzt in der Klinik am Ring (Orthopädie und Sporttraumatologie) und u.a. Mannschaftsarzt des VFL Gummersbach (Handball Bundesliga), Rot-Weiß Köln (Hockey Bundesliga) und der deutschen Hockey-Nationalmannschaft der Damen.




