Negativempfehlung zur Hyaluronsäureinjektion (IAHS) bei Knie- und Hüftarthrose (19.8.2025). Diese Veröffentlichung des IGeL-Monitors als Instrument des Medizinischen Dienstes des Bund in der Rechtsnachfolge des «Medizinischen Dienstes des Spitzenverbandes Bund der Krankenkassen» (MDS) erfordert einen Widerspruch.
Schon in der Formulierung des Hintergrundes der Studiengrundlage für die Evidenz der Hyaluronsäureinjektion bei der Arthrosebehandlung wird ausdrücklich darauf hingewiesen, die Hyaluronsäure im Allgemeinen und nicht bezüglich einzelner Produktvorteile zu behandeln [1]. Genau diese Unschärfe in der Beurteilung von Hyaluronsäuren führt doch zu einer Fehleinschätzung der Wirksamkeit und Sicherheit der Arthrosetherapie durch unterschiedlichste Hyaluronsäurepräparationen, die im Übrigen stehts mit den von den gesetzlichen Krankenkassen bezahlten Maßnahmen [1] flankiert sein sollten.
Welche Produkteigenschaften der Hyaluronsäure sind also maßgeblich in der Beurteilung der Wirksamkeit der Substanz.
- Molekularität und Vernetzung
- Viskosität
- Konzentration
- Biofermentative Herstellung vs. tierische Produktgrundlage (aviane Proteine)
- Injektionsintervall [(1.-5.) 20]
Ferner ist es von Bedeutung, welches Applikationsprotokoll der Arthrosetherapie mit IAHS zugrunde gelegt wird. So ist das Risiko häufiger Injektionen sicher höher einzuschätzen als die wiederholte Gabe in großen Zeitabständen (bis zu 6 Monaten).
- Bildgestützte Injektion
Auch ist die Art der Injektion von eminenter Bedeutung, so ist es immer noch verbreitete Praxis ohne bildgestütztes Verfahren die IAHS im Gelenk zu platzieren, obwohl in verlässlichen Studien die Ungenauigkeit der „Freihandinjektionen“ nachgewiesen wurde. Ultraschall-gestützte Verfahren bieten größtmögliche Treffsicherheit und haben den Vorteil der Strahlenfreiheit [2].
- Leitlinien
Letztlich ist die Indikation zur intraartikulären Injektion mit Hyaluronsäure bei Gonarthrose klar in der deutschen Sk2 Leitlinie zur Gonarthrosetherapie geregelt und angelehnt an andere große internationale Gesellschaften, die zunehmend den therapeutischen Nutzen der Substanz würdigen [3].In der S3 LL(2024) heißt es: „es kann aufgrund der widersprüchlichen Evidenz keine Empfehlung zum Einsatz von intraartikulärer Hyaluronsäure-Injektion abgegeben werden“ analoge Empfehlungen gibt es für die Anwendung von Eigenblutderivaten(PRP). Andere europäische Empfehlungen wurden sinngemäß positiver formuliert [4]
Im Wesentlichen hat der BVOU in einer Stellungnahme der Negativbeurteilung widersprochen [5].
Diskussion
Hyaluronsäure als Überbegriff verschiedener sehr heterogener Subgruppen mit unterschiedlichsten Wirkqualitäten und Risikoprofilen wird wissenschaftlich ganz überwiegend als Gesamtheit einer Grundstruktur gesehen und in relevanten Metaanalysen ohne Trennschärfe analysiert. Dies ist die Grundlage für seine diskrepante Beurteilung in der Literatur (RCT´s/MA´s). Wenige Autoren stellen trotz dieser konflikthaften Darstellung Hyaluronsäure im Gesamten in den Verdacht der Unwirksamkeit mit relevanten Nebenwirkungen (SAE) [6]. Dennoch erlangten HA´s wegen ihres potentiellen Nutzen bei Versagen von konventionellen oralen Medikationen (NSAR/ Opioide) oder deren höherem Risikoprofils positive Erwähnung in eine großen Anzahl von internationalen und nationalen Leitlinien [7]. Maheu [8] stellte eindeutig in seiner Übersicht anhand ernstzunehmender MA´s und RCT’s die Sicherheit der Anwendung der IAHS dar. Im Kontrast dazu ergeben sich hohe Risiken der Leitlinien- empfohlenen NSAR und Opioide sowie Steroidinjektionen.
Die Wirksamkeit von HA ergab sich eindeutig aus RCT´s und der Bestimmung der sog. „effect sizes“ (ES) im Vergleich zu oralen und i.a. Therapiealternativen sowie Plazeboanwendungen (n. Bannuru et al. 2015;1111) [9].
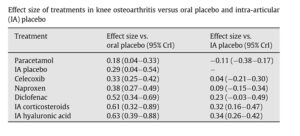
Filippo Migliorini publizierte 2025 mit Level I Evidenz die Überlegenheit bei der Schmerzlinderung zwischen 1-6 Monaten von UHMWHS und HMWHS gegenüber anderen (MMWHS, LMWHS) [10]. Der Effekt der Vernetzung zeigt in der klinischen Erfahrung bessere Ergebnisse als einfach-kettige Struktur der HS, der wissenschaftliche Nachweis steht noch aus. Kombinationsanwendungen von (U-)HMWHS und PRP scheint den klinischen Effekt noch zu verstärken. Zu Viskosität und Konzentrationen der HS-Anwendungen bestehen inkonklusive Positionen. Nachweislich entfalten LMWHS katabole Effekte auf Knorpelzellen bei intraartikulärer Anwendung, im Kontrast dazu wirken (U-HMWHS) antikatabol [11]. Altman sprach sich für die Verwendung fermentativ hergestellter HS vs. avianen Produkten bei geringeren Nebenwirkungen aus [12], Schiltenwolf betonte dieses in publikatorischen Organen der Ärztekammer [13].
Langzeitstudien zu HS – Injektionen zeigten positive Wirkung bei 80% der Patienten über einen 3-Jahre Zeitraum [14]. Auch zeigte sich eine hohe Anwendungssicherheit bei wiederholter Anwendung der IAHS über 6-18 Monate mit einer SAE-Rate von 0.008 (95% CI: 0.001 0.055) [15]. Darüber hinaus gibt eine große retrospektive Datenanalyse Hinweise für verbessertes Patienten Outcome durch klinische Verzögerung einer Knieendoprothesenimplantation (KTEP) zwischen 2.2-3,6 Jahren bei 5 oder mehr Behandlungszyklen mit IAHS [16,17]. Letztlich sei das niedrigere Risiko einer perioperativen Protheseninfektion nach IAHS vs. IACS zu bemerken.
Fazit
Eine generelle Ablehnung der IAHS ist nicht haltbar. Es gibt belastbare Daten für die Bevorzugung ultrahoch- und hochmolekularer IAHS. Diese können wirksam mit geringem Risiko vor allem bei Grad 2-3 Osteoarthrosen eingesetzt werden. Auch Mittel- bis hochmolekulare IAHA haben ihren Platz in der Osteoarthrosetherapie, haben jedoch bei kürzeren Injektionsintervallen ein höheres Infektionsrisiko. Mittelmolekulare nicht-vernetzte HA können initial alternativ zu IACS bei aktivierten Gonarthrosen zum Einsatz gelangen. Bei der Applikation ist auf bildgestützte Verfahren (bevorzugt Ultraschall) zurückzugreifen. Wiederholte Injektionszyklen sollten maßgeschneidert und patientenorientiert angewandt werden [20]. Eine Synergie in der konsekutiven kombinierten Anwendung von IA(U-)HMWHS und PRP wird beschrieben. Nachweislich verzögert sich die Zeit bis zur Endoprothesenimplantation ohne die für IACS beschriebene Risikoerhöhung von perioperativen Infektionen. Es gibt bei starker Nachfrage durch Patienten mit guter Therapieerfahrung weiter einen Platz für Hyaluronsäure in der Therapie der Osteoarthrose.
Literatur
2 Saha, Prasenjit, Matthew Smith, and Khalid Hasan. „Accuracy of intraarticular injections: blind vs. image guided techniques—a review of literature.“ Journal of Functional Morphology and Kinesiology 8.3 (2023): 93.
3 AWMF Leitlinienregister https://register.awmf.org/leitlinien/detail/187-050
4 Pesare, Elisa, et al. „Italian Orthopaedic and Traumatology Society (SIOT) position statement on the non-surgical management of knee osteoarthritis.“ Journal of Orthopaedics and Traumatology 24.1 (2023): 47.
5 https://www.bvou.net/Stellungnahme des BVOU zur Kritik an IGeL-Leistungen in der Orthopädie und Unfallchirurgie – BVOU-Netzwerk
6 Pereira, Tiago V., et al. „Viscosupplementation for knee osteoarthritis: systematic review and meta-analysis.“ bmj 378 (2022).
7 Migliore, Alberto, et al. „What we should expect from an innovative intra-articular hyaluronic acid product: expert opinion based on a comprehensive review of the literature.“ Journal of clinical medicine 12.23 (2023): 7422.
8 Maheu, Emmanuel, et al. „Why we should definitely include intra-articular hyaluronic acid as a therapeutic option in the management of knee osteoarthritis: results of an extensive critical literature review.“ Seminars in arthritis and rheumatism. Vol. 48. No. 4. WB Saunders, 2019.
9 Bannuru R.R. et al. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: A systematic review and network meta-analysis Annals of Internal Medicine Volume: 162 Issue: 1(2015) Pages: 46 – 54
10 Migliorini, Filippo, et al. „Comparison of different molecular weights of Intra-Articular hyaluronic acid injections for knee osteoarthritis: A level I bayesian network Meta-Analysis.“ Biomedicines 13.1 (2025): 175.
11 Rayahin, J.E.; Buhrman, J.S.; Zhang, Y.; Koh, T.J.; Gemeinhart, R.A. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater. Sci. Eng. 2015, 1, 481–493.
12 Altman, R.D.; Bedi, A.; Karlsson, J.; Sancheti, P.; Schemitsch, E. Product differences in intra-articular hyaluronic acids for osteoarthritis of the knee. Am. J. Sports Med. 2016, 44, 2158–2165.
13 Schiltenwolf, M. „Hyaluronsäure in der Behandlung der schmerzhaften Arthrose der Extremitätengelenke.“ AVP 44.4 (2017): 183-185.
14 Bannuru, Raveendhara R., et al. „Safety of repeated injections of sodium hyaluronate (SUPARTZ) for knee osteoarthritis: a systematic review and meta-analysis.“ Cartilage 7.4 (2016): 322-332.
15 Navarro-Sarabia, F., et al. „A 40-month multicentre, randomised placebo-controlled study to assess the efficacy and carry-over effect of repeated intra-articular injections of hyaluronic acid in knee osteoarthritis: the AMELIA project.“ Annals of the rheumatic diseases 70.11 (2011): 1957-1962.
16 Maia, P.A.V.; Cossich, V.R.A.; Salles-Neto, J.I.; Aguiar, D.P.; de Sousa, E.B. Viscosupplementation improves pain, function and muscle strength, but not proprioception, in patients with knee osteoarthritis: A prospective randomized trial. Clinics 2019, 74, e1207.
17 Richardson, C.; Plaas, A.; Block, J.A. Intra-articular Hyaluronan Therapy for Symptomatic Knee Osteoarthritis. Rheum. Dis. Clin. North. Am. 2019, 45, 439–451.
18 Rayahin, J.E.; Buhrman, J.S.; Zhang, Y.; Koh, T.J.; Gemeinhart, R.A. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater. Sci. Eng. 2015, 1, 481–493.
19 Hashizume, M.; Mihara, M. High molecular weight hyaluronic acid inhibits IL-6-induced MMP production from human chondrocytes by up-regulating the ERK inhibitor, MKP-1. Biochem. Biophys. Res. Commun. 2010, 403, 184–189.
20 Wieber J. et al. SÄZ 1/2021
Autoren
ist Facharzt für Orthopädie und Unfallchirurgie sowie Allgemeinchirurgie und leitet die Orthopädische Praxis Hannover/Kleefeld. Er ist seit Jahren als Referent im Rahmen der Sportmedizin tätig und widmet sich mit Schwerpunkt in der Betreuung von Freizeit und Leistungstänzern einem besonders interessanten Gebiet der Sportmedizin.


