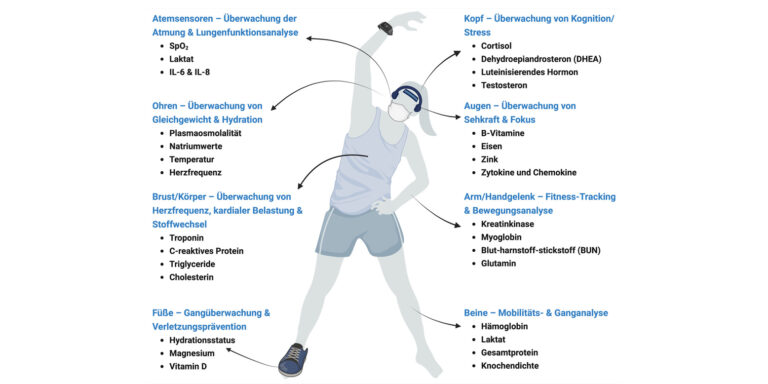
Tragbare Technologien, sogenannte „Wearables“, zur kontinuierlichen Messung unterschiedlicher vital Parameter oder Biomarker positionieren sich aktuell als wegweisend in Sportmedizin und Gesundheitsversorgung. Von Fitness-Trackern bis hin zu Schweißsensoren erweitern diese Geräte die Grenzen der nicht-invasiven Gesundheitsüberwachung.
Innerhalb weniger Jahren haben sich Wearables von einfachen Werkzeugen zu ausgefeilten Geräten entwickelt, die biochemische und physiologische Veränderungen nahezu in Echtzeit erkennen können [1, 2]. Smartwatches überwachen Herzfrequenz und Sauerstoffsättigung (Wearables der ersten Generation für die physikalischen Parameter), während Biosensor-Patches Glukose, Laktat und Elektrolyte in Körperflüssigkeiten wie Schweiß oder interstitielle Flüssigkeit messen.
Wearables der zweiten Generation, wie Hautpflaster, Tattoos und sogar Atemschutz-Masken, analysieren nicht-invasive Bioflüssigkeiten und können Stoffwechsel- und Krankheitsmarker nach-
weisen [1, 2]. Vor allem die Atemanalyse erlangt gerade zunehmend Aufmerksamkeit: Mit über 3.000 flüchtigen organischen Verbindungen ermöglicht die ausgeatmete Luft einzigartige Einblicke in Stoffwechsel- und Krankheitsprozesse und ist dabei vollständig nicht-invasiv analysierbar. Entsprechend gehen Forschungs- und Entwicklungstrends in Richtung tragbare, benutzerfreundliche Analysegeräte, die idealerweise nahtlos in den Alltag der Patienten integriert werden können. Im Gegensatz zu Schweiß- oder Speichelmessungen umgeht die Atemgasanalyse von Analyten komplexe Transportmechanismen und spiegelt somit direkter die Analytkonzentrationen im Blut wider.
Vielversprechendes Feld der Atemanalyse
2019 entwickelte unsere Forschungsgruppe einen, in eine Standard OP-Maske integrierten, papierbasierten, elektrochemischen Sensor, zum Nachweis von Wasserstoffperoxid (H2O2 ist ein wichtiger Biomarker für Atemwegserkrankungen wie Asthma und chronisch obstruktive Lungenerkrankung [3]) im ausgeatmeten Atem. Derzeit arbeitet unser Team an einer Smart-Maske für Diabetiker, die eine nutzerfreundliche, nicht-invasive Glukoseüberwachung als Alternative zu herkömmlichen Bluttests oder minimal-invasiven Mikroinjektionsnadeln für tragbare Glukoseüberwachung ermöglichen soll. Die Maske nutzt enzymbasierte Sensoren, um den Glukoseanteil im Atem zu messen. Dieselbe Technologie eignet sich auch hervorragend zum Monitoring von Laktat, einem Biomarker, der potenziell Rückschlüsse auf Fettverbrennung und Ausdauer bei Sportlern zulässt. Diese Technologie befindet sich zurzeit noch in der Entwicklung und erfordert weitere Forschung und Optimierung, aber erste Tests mit gesunden Freiwilligen zeigen vielversprechende Ergebnisse.
Ein weiteres interessantes Forschungsfeld ist die Atemanalyse im Rahmen der therapeutischen Medikations-Überwachung (Therapeutic Drug Monitoring, TDM). In unserer derzeitigen Forschung konzipieren und entwickeln wir Biosensoren für das Vor-Ort-TDM von Antibiotika in verschiedenen Biofluiden, mit Schwerpunkt auf Atemanalyse [4]. Antibiotika- bzw. Antimikrobielle Resistenz (AMR) stellt ein globales Gesundheitsrisiko dar, das Sterblichkeitsraten erhöht, Krankenhausaufenthalte verlängert und Kosten für Gesundheitssysteme verursacht. TDM mithilfe von Blutanalysen bietet eine vielversprechende, kostengünstige und effektive Strategie zur Bekämpfung von AMR, indem eine personalisierte und somit optimale Einstellung der Antibiose ermöglicht wird, wodurch ihre Toxizität reduziert und möglicherweise die Verbreitung resistenter Stämme eingedämmt werden kann. Das blutbasierte TDM ist allerdings invasiv, ressourcenintensiv und möglicherweise ungenau in der Reflexion von Medikamentenkonzentrationen an Infektionsherden. Das wäre besonders problematisch für kritisch oder chronisch kranke Patienten mit Lungeninfektionen, bei denen die Aufnahme von ß-Lactam-basierten Antibiotika in das Gewebe variiert und zu einer unwirksamen Behandlung führen kann. In unserer aktuellen Forschung konnten wir eine starke Korrelation zwischen Antibiotikakonzentrationen im Atem und im Plasma beobachten. In weiteren Untersuchungen führten wir Studien an lungengeschädigten Tieren durch, um zu analysieren, wie pathologische Veränderungen die Antibiotika Clearance im Atem beeinflussen und wie unterschiedliche Lungenzustände die Pharmakokinetik von Antibiotika beeinflussen. Eine, durch Wearables ermöglichte, kontinuierliche Echtzeitüberwachung des Medikamentenspiegels hat somit das Potenzial, Therapeutisches Medikamenten-Monitoring, insbesondere für die Atemanalyse, zu revolutionieren. Besonders für Patienten mit chronischen Erkrankungen, die auf eine konstante Medikamentenverwaltung angewiesen sind, könnten Wearables, die nicht-invasive, kontinuierliche Überwachung ermöglichen, häufige Krankenhausbesuche oder Blutentnahmen reduzieren und somit die Compliance erhöhen sowie Behandlungsergebnisse verbessern.
Obwohl die tragbare Bioflüssigkeitsanalyse enormes Potenzial birgt, bleiben Herausforderungen bestehen. Beispielsweise muss u. a. die Empfindlichkeit und Selektivität der Sensoren so weit verbessert werden, dass Biomarker in klinisch relevanten Konzentrationen präzise nachgewiesen werden können. Schon bald könnten Sportler und Patienten zusätzlich zu etablierten Wearables wie Smartwatches oder Ringen, routinemäßig auf atembasierte Geräte wie Smart-Masken oder unter der Nase getragene Patches [6] und Biosensoren zurückgreifen, um relevante physiologische Parameter bequem zu überwachen. Solche Innovationen haben nicht nur das Potenzial (Abbildung), Trainings- und Regenerationseffizienz zu steigern, sondern auch Krankheiten frühzeitig zu erkennen und damit eine neue Ära der präventiven und personalisierten Gesundheitsversorgung einzuläuten.
Literatur
- Brasier, N. et al. Applied body-fluid analysis by wearable devices. Nature 2024 636:8041 636, 57–68 (2024).
- Ates, H. C. et al. End-to-end design of wearable sensors. Nat Rev Mater 7, 887–907 (2022).
- Maier, D. et al. Toward Continuous Monitoring of Breath Biochemistry: A Paper-Based Wearable Sensor for Real-Time Hydrogen Peroxide Measurement in Simulated Breath. ACS Sens 4, 2945–2951 (2019).
- Ates, H. C. et al. Biosensor-Enabled Multiplexed On-Site Therapeutic Drug Monitoring of Antibiotics. Advanced Materials 34, 2104555 (2022).
- Brasier, N. et al. A three-level model for therapeutic drug monitoring of antimicrobials at the site of infection. Lancet Infect Dis (2023) doi:10.1016/S1473-3099(23)00215-3.
- Ates, H. C. & Dincer, C. Wearable breath analysis. Nature Reviews Bioengineering 2023 1:2 1, 80–82 (2023).
Autoren
ist seit Oktober 2024 Associate Professor für „Sensors and Wearables for Healthcare“ an der TU München. Der Forschungsschwerpunkt seiner Arbeitsgruppe liegt in der Entwicklung bioanalytischer Materialien, Sensoren und Mikrosysteme sowie deren Kombination mit Datenwissenschaft und künstlicher Intelligenz für One-Health: Gesundheit von Menschen und Tieren sowie deren gemeinsamen Umwelt. Der Fokus liegt auf Einweg Sensorensysteme für Point-of-Need-Tests und tragbare Anwendungen.
ist Postdoktorandin in der Forschungsgruppe "Sensors and Wearables for Healthcare" an der TU München. Ihr Fachgebiet umfasst die Entwicklung bioanalytischer Geräte für Vor-Ort-Diagnostik und das Therapeutische Medikamenten-Monitoring sowie das Design tragbarer Technologien für verschiedene Anwendungen im Gesundheitswesen. Während ihrer Promotion entwickelte sie eine kostengünstige Sensorplattform, um das personalisierte Management der Antibiotikatherapie zu verbessern.