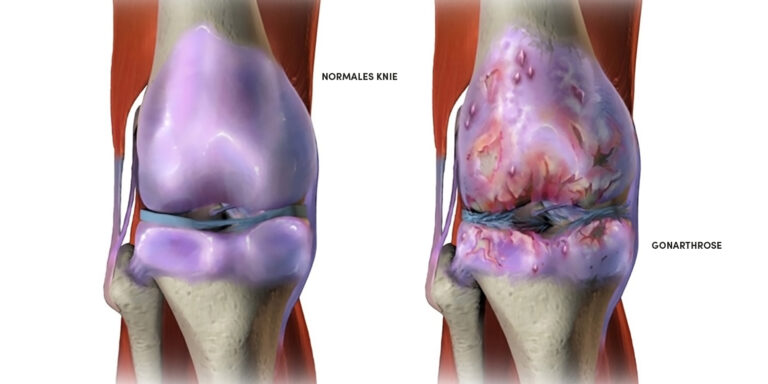
Kniearthrose (Gonarthrose) ist eine der häufigsten degenerativen Gelenkerkrankungen und ein zentrales Thema in der sportorthopädischen Praxis. Neben medikamentösen Therapien und Bewegungstherapie werden zunehmend Nahrungsergänzungsmittel (NEM) zur Unterstützung der Gelenkfunktion eingesetzt. Besonders im Fokus stehen Kollagen-Hydrolysate auf der einen Seite und Enzyme mit entzündungshemmender Wirkung auf der anderen Seite.
Doch wie wirken diese Stoffe tatsächlich? Werden sie resorbiert, gelangen sie systemisch in das Gelenk – und wenn ja, in welcher Form und bei welchen Mechanismen? Dieser Beitrag fasst den aktuellen Forschungsstand zusammen und zieht eine kritische Bilanz aus Perspektive der Stoffwechselbiochemie: Was kommt im Knie wirklich an?
Kollagen zur Unterstützung der Knorpelstruktur
Grundlagen: Kollagen ist das am häufigsten vorkommende Strukturprotein im menschlichen Körper (25 % der Gesamtproteinmasse). Es bildet eine Familie nah verwandter aber genetisch eigenständiger Faserproteine, wobei Typ I das bei weitem häufigste ist. Im Knorpel kommt aber vor allem Typ II Kollagen vor. Um beurteilen zu können, inwieweit oral aufgenommenes Kollagen einen Beitrag zum strukturellen Aufbau des Knorpels leisten kann, ist es wichtig, hier ein wenig ins Detail zu gehen. Kollagene bestehen aus drei etwa 1.000 Aminosäuren langen helikalen Peptidketten, die sich wiederum zu einer Tripelhelix umeinanderwinden: das Prokollagen. Die ersten Schritte der Kollagensynthese finden intrazellulär statt, im Knorpel ist dafür der Chondrozyt (die Knorpelzelle) verantwortlich. Chondrozyten bilden im hyalinen Knorpel (dieser Knorpeltyp bildet die Gelenkflächen) Gruppen, die Chondrone. Sie sind eingebettet in die kollagen- und chondroitinsulfatreiche Matrix, die sie selber synthetisieren [1]. Nach Sekretion des tripelhelikalen Prokollagens werden extrazellulär beide Enden gekappt, so entsteht Tropokollagen, das sich dann zur Kollagenfibrille quervernetzt – hier spielen Lysine und Hydroxylysine an den Enden eine wichtige Rolle. Diese Fibrillen lagern sich zu Kollagenfasern zusammen. Jede 1.000 Aminosäure lange Peptidkette wird im Chondrozyten am rauen ER synthetisiert: über 300 Wiederholungen des Motivs: Glycin-X-Y, wobei X oft ein Prolin und Y oft ein Hydroxyprolin ist. Hydroxyprolin ist jedoch keine eigenständige proteinogene Aminosäure sondern entsteht intrazellulär durch Hydroxylierung von Prolin in der Peptidkette. Durch die zusätzliche OH-Gruppe kann Hydroxyprolin Wasserstoffbrücken zu einem anderen Strang knüpfen, sodass die stabile Tripelhelix entstehen kann. Die Vielzahl dieser Wasserstoffbrücken ist für die enorme Zugstabilität von Kollagen verantwortlich, die größer als die von Stahl ist. Diese Hydroxylierung ist Vitamin C abhängig. Bei Vitamin C Mangel (z. B. Skorbut) kommt es daher zu mangelnder Stabilisierung des neu gebildeten Kollagens mit u. a. gestörter Wundheilung, Blutungen der Mundschleimhaut und anderen Symptomen [2].
Was kommt im Knie an?
Wenn wir nun unserem Knorpel etwas Gutes tun wollen und Kollagen zu uns nehmen, was kommt davon im Knie an? Die Kollagenuntereinheit Tropokollagen hat schon etwa 3.000 Aminosäuren, etwa 1.000 Tropokollagen-Untereinheiten bilden eine Kollagenfibrille, d. h. eine Fibrille hat dann mindestens 3 Millionen Aminosäuren. Eine ganze Kollagenfaser besteht aus zwischen 10 und 300 Fibrillen – hier wird schnell klar, dass weder Kollagenfibrillen, die sich an andere Fibrillen anlagern könnten, noch die Untereinheiten Tropokollagen, die sich mit anderen Tropokollagenen vernetzen könnte, eine Chance haben, intakt (als Helix) den Magen mit dem proteinspaltenden Pepsin und der denaturierenden Magensäure zu überleben. Selbst wenn, gibt es im Dünndarm noch weitere Proteasen und der Transport aus dem Darm ins Blut kann nur über Transporter erfolgen, die maximal wenige Aminosäure große Peptide transportieren. Der Frage, was denn eigentlich im Knie ankommt, haben sich einige Untersuchungen gewidmet: Man konnte belegen, dass kleine Kollagenfragmente nach oraler Aufnahme im Blut erscheinen und gezielt in Knorpelgewebe akkumulieren [7, 5]. Oesser et al. (1999) zeigten in tierexperimentellen Studien, dass radiomarkierte Gelatinehydrolysate bevorzugt im Gelenkknorpel gespeichert werden [7]. In Nahrungsergänzungsmitteln wird daher meist hydrolysiertes Kollagen verwendet – kurze Peptidketten, die durch enzymatische Spaltung gut löslich gemacht wurden.

Strukturelle Unterstützung des Knorpels
Präklinische Studien legen nahe, dass die Zufuhr von Kollagenpeptiden die biomechanische Integrität des Knorpels unterstützt und degenerativen Prozessen entgegenwirkt [8, 9, 12]. Sind also Kollagenpeptide eine direkte Substratquelle der Chondrozyten für die Kollagensynthese? Da die Proteinsynthese an den Ribosomen generell immer nur eine Aminosäure nach der anderen einbaut – es gibt keine tRNA für Oligopeptide – ist dies nur als indirekter Effekt möglich: Die hohe Konzentration an genau den Aminosäuren (aus gespaltenen Kollagenpeptiden), die für Kollagensynthese gebraucht werden, sorgt für erhöhte Syntheseleistung. Für Hydroxyprolin gibt es auch keine tRNA, sodass jedes Hydroxyprolin aus den Kollagenpeptiden in der Zelle wieder zu Prolin wird, um dann im rauen ER Vitamin C-abhängig zu Hydroxyprolin hydroxyliert zu werden. Aus dieser Perspektive bringt die Einnahme von Hydroxyprolin keine Vorteile vor Prolin. Fassen wir zusammen: auf struktureller Ebene geht es bei allen Kollagenpräparaten nur um die Konzentrations-Erhöhung der spezifisch für Kollagen benötigten Aminosäuren. Spannend ist jedoch, dass die Kollagenpeptide auch eine Signalwirkung zu haben scheinen.
Biochemische Signalwege und anabole Effekte
Über die bloße Aminosäureversorgung hinaus aktivieren bestimmte Kollagenpeptide biochemische Signalwege in Chondrozyten. Studien belegen, dass das Kollagenpeptid Prolin-Hydroxyprolin beispielsweise die Synthese von Hyaluronsäure durch Synovialzellen steigern kann – ein zentraler Faktor für die Gelenkschmierung und viskoelastischen Schutz des Knorpels [4]. Weitere Untersuchungen deuten darauf hin, dass Kollagenpeptide anti-inflammatorische Effekte über die Hemmung des NF-κB-Signalwegs vermitteln [6, 8], wodurch die Freisetzung knorpelabbauender Enzyme wie MMP-13 reduziert werden kann [3, 6, 8]. Darüber hinaus gibt es Hinweise, dass anabole Signalwege beteiligt sind, insbesondere PI3K/Akt/mTOR und TGF-β1, die die Synthese von Typ-II-Kollagen und Proteoglykanen fördern – zentrale Bestandteile der extrazellulären Matrix (ECM) des Knorpels [3, 4, 8,18]. In Tiermodellen wurde eine gesteigerte Expression von ECM-Komponenten bei gleichzeitiger Reduktion pro-inflammatorischer Zytokine wie IL-1β und TNF-α beobachtet [6, 8].
Klinische Studienlage beim Menschen
In menschlichen Studien liegt der Fokus bislang vornehmlich auf klinischen Endpunkten wie Schmerz (z. B. VAS-Score), Gelenkfunktion (WOMAC, KOOS) und Lebensqualität bei Kniearthrose. Kumar et al. (2015) zeigten in einer randomisierten Doppelblindstudie mit Patienten, dass Kollagenpeptid-Supplementierung signifikante Verbesserungen in diesen Parametern gegenüber Placebo erreichte [13]. Ähnliche Befunde wurden in einer weiteren Studie mit 99 Patienten bestätigt, die zusätzlich zu Bewegungstherapie Kollagenhydrolysat einnahmen [14]. Allerdings bleibt hier der Nachweis eines strukturellen oder molekularbiologischen Mechanismus beim Menschen häufig aus.
Proteolytische Enzyme – Entzündungskontrolle durch systemische Enzymtherapie?
Die häufigsten Enzyme in Nahrungsergänzungsmitteln zur Arthrosebehandlung sind:
- Bromelain: Cysteinprotease aus Ananasstämmen
- Trypsin: Serinprotease aus dem Pankreas
- Rutosid (ein Flavonoid): oft in Kombinationspräparaten (z. B. Wobenzym®)
Auch bei der Enzymtherapie stellt sich die Frage, was im Knie ankommt: Enzyme sind Proteine, die eine definierte 3D-Struktur haben, die Voraussetzung ist, dass sie ihre Funktion wahrnehmen können. Proteasen (wie Bromelain und Trypsin) erkennen z. B. ganz spezifisch Proteine, um sie zu spalten. Die Passung zwischen Enzym und Substrat ist so genau wie bei Schlüssel und Schloss und daher führt eine Denaturierung der Enzyme, also der Verlust ihrer 3D-Struktur zu einem Funktionsverlust. Genau das passiert aber durch die Salzsäure und das proteinspaltende Pepsin im Magen. Studien erwähnen den Einsatz magensaftresistenter Tabletten oder liposomaler Verkapselung, um eine Passage in den Dünndarm zu ermöglichen [19] Allerdings gibt es auch im Dünndarm Proteasen und auch hier ist der Transport ins Blut für so große Moleküle normalerweise nicht vorgesehen. Einige Hinweise deuten darauf hin, dass aktive Fragmente oder Peptid-Komplexe ins Blut gelangen und dort immunmodulatorisch wirken – meist jedoch indirekt belegt. Trotzdem zeigen zahlreiche Studien Wirkung von Enzympräparaten bei Kniearthrose, primär in Vergleich zu NSAR: Wobenzym (Trypsin-Bromelain-Rutosid Kombination) war in mehreren Studien klinisch nicht unterlegen zu Diclofenac in Schmerz- und Funktionsparametern [20, 22]. Patientenberichtete Nebenwirkungen waren geringer – insbesondere weniger gastrointestinale Beschwerden. In systematischen Reviews [23] wurde Bromelain mit direkten entzündungshemmenden Effekten auf die Gelenksymptomatik assoziiert, teils vergleichbar mit NSAR. Einige Studien, z. B. [21] fanden aber auch keine statistisch signifikanten Effekte vs. Placebo.
Die anti-inflammatorisch wirkenden Mechanismen werden so beschrieben, es gibt hierzu jedoch keine Publikationen in medizinischen Standardjournalen:
- Reduktion proinflammatorischer Zytokine: TNF-α, IL-1β, IL-6 werden durch Hemmung von Signalwegen wie NF-κB und MAPK reguliert [24, 25]
- Fibrinolytische Effekte: Besonders Bromelain und Serratiopeptidase lösen Fibrin und vermeiden Gefäßverengung in Mikrozirkulation – potenziell wichtig bei chronischer Entzündung
- Chondroprotektion: Hemmung knorpelabbauender Enzyme (z. B. MMPs), Förderung der Knorpelzellviabilität
(präklinisch gezeigt in [24])
Bedeutung und Relevanz von NEM wie Kollagen und Enzyme
Sicherheit und Langzeitanwendung: Beide Substanzgruppen – Kollagene und Enzyme – weisen laut den Studien eine gute Verträglichkeit auf. Insbesondere gegenüber NSAR sind gastrointestinale Nebenwirkungen seltener. Bei Enzymtherapie: selten Übelkeit, Durchfall oder allergische Reaktionen. Bei Kollagen: gut verträglich, vereinzelt leichte GI-Symptome berichtet. Langzeitdaten zur strukturellen Gelenkerhaltung sind begrenzt – insbesondere bei Enzymen.
Indikationen: Frühe Kniearthrosegrade (Kellgren-Lawrence I–II), insbesondere symptomatische Patienten mit Kontraindikationen für NSAR (z. B. GI-Ulzera), Athleten oder sportlich Aktive, die prophylaktisch ihre Gelenkfunktion unterstützen möchten
Limitationen: Individuelle Response-Variabilität, u. a. abhängig vom Alter, Metabolismus oder Darmmikrobiom. Regulatorischer Graubereich bei Nahrungsergänzungen: Dosierungen und Qualität sind nicht standardisiert wie bei Arzneimitteln.
Fazit
Sowohl hydrolysierte Kollagenpeptide als auch systemisch wirksame Enzyme zeigen in Studien positive Effekte auf Schmerzen und Funktion bei Kniearthrose – teils vergleichbar mit NSAR, aber mit besserer Verträglichkeit. Die wissenschaftliche Evidenz ist insbesondere beim Kollagen zwar in vielen Punkten vielversprechend, aber auch noch nicht vollständig geklärt. Künftig werden bessere Daten zur Bioverfügbarkeit, Langzeitwirkung und individualisierten Anwendung notwendig sein.
Literatur
[1] Welsch, U. (2022) Histologie – Lehrbuch und Atlas, 6. Auflage, Elsevier
[2] Fluhrer und Hampe (2023), Biochemie hoch2, 2. Auflage, Elsevier
[3] Isaka S et al. (2017) Evaluation of the effect of oral administration of collagen peptides on an experimental rat osteoarthritis model Experimental and Therapeutic Medicine 13 (6), 2699-2706
[4] Ohara H et al. (2010) Effects of Pro-Hyp, a collagen hydrolysate-derived peptide, on hyaluronic acid synthesis using in vitro cultured synovium cells and oral ingestion of collagen hydrolysates in a guinea pig model of osteoarthritis Bioscience, Biotechnology, and Biochemistry 74 (10), 2096-2099
[5]Iwai et al. (2005) Identification of food-derived collagen peptides in human blood after oral ingestion of gelatin hydrolysates Journal of Agricultural and Food Chemistry 53 (16), 6531-6536
[6]Felim J et al. (2022) Effect of Different Collagen on Anterior Cruciate Ligament Transection and Medial Meniscectomy-Induced Osteoarthritis in Male Rats Frontiers in Bioengineering and Biotechnology 10, 917474
[7]Oesser S et al. (1999) Oral administration of (14)C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL) The Journal of Nutrition 129 (10), 1891-1895
[8] Lee MH et al. (2021) Low-Molecular-Weight Collagen Peptide Ameliorates Osteoarthritis Progression through Promoting Extracellular Matrix Synthesis by Chondrocytes in a Rabbit Anterior Cruciate Ligament Transection Model Journal of Microbiology and Biotechnology 31 (10), 1401-1410
[9] Dar QA et al. (2017) Daily oral consumption of hydrolyzed type 1 collagen is chondroprotective and anti-inflammatory in murine posttraumatic osteoarthritis PLOS ONE 12 (4), e0174705
[10] Schadow S et al. (2017) Metabolic Response of Human Osteoarthritic Cartilage to Biochemically Characterized Collagen Hydrolysates International Journal of Molecular Sciences 18 (1), 207
[11] Nakatani S et al. (2009) Chondroprotective effect of the bioactive peptide prolyl-hydroxyproline in mouse articular cartilage in vitro and in vivo Osteoarthritis and Cartilage 17 (12), 1620-1627
[12] Sudirman S et al. (2023) Fermented jellyfish (Rhopilema esculentum) collagen enhances antioxidant activity and cartilage protection on surgically induced osteoarthritis in obese rats Frontiers in Pharmacology 14, 1095665
[13] Kumar S et al. (2015) A double-blind, placebo-controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis Journal of the Science of Food and Agriculture, 95(14):2767–2772
[14] Repetyuk AD et al. (2023) Effectiveness of a novel hydrolysate collagen formulation in the complex treatment and rehabilitation of patients with symptomatic knee osteoarthritis Medical and Social Expert Evaluation and Rehabilitation 26(1):1–10
[15] Ohnishi A et al. (2013) Evaluation of the chondroprotective effects of glucosamine and fish collagen peptide on a rabbit ACLT model using serum biomarkers The Journal of Veterinary Medical Science 75(4):555–561
[16] Schadow S et al. (2013) Collagen Metabolism of Human Osteoarthritic Articular Cartilage as Modulated by Bovine Collagen Hydrolysates PLOS ONE 8(1):e53955
[17] Schunck M et al. (2017) The Effectiveness of Specific Collagen Peptides on Osteoarthritis in Dogs-Impact on Metabolic Processes in Canine Chondrocytes Open Journal of Animal Sciences 7(3):254–266
[18] Geahchan et al. (2022) Marine Collagen: A Promising Biomaterial for Wound Healing, Skin Anti-Aging, and Bone Regeneration. Marine Drugs. 10;20(1):61.
[19] Kulkarni, A. & Bendrey, H.A. (2021) Systemic enzyme therapy with trypsin, bromelain and rutoside in the management of arthritis: an overview. International Journal of Research in Orthopaedics. 7(5):1062-1069
[20] Bolten, W., Glade, M.J., Raum, S., Ritz, B., & others. (2015) The Safety and Efficacy of an Enzyme Combination in Managing Knee Osteoarthritis Pain in Adults: A Randomized, Double-Blind, Placebo-Controlled Trial. Arthritis. 2015:251521
[21] Brien, S., Prescott, P., Lewith, H., Walker, A., & Bundy, R. (2006) Bromelain as an adjunctive treatment for moderate-to-severe osteoarthritis of the knee: a randomized placebo-controlled pilot study. QJM: An International Journal of Medicine 99 (12), 841-850.
[22] Ueberall, M., Maier, C., Schuler, M., Essner, U., & Bonninger, K. (2016) Efficacy, tolerability, and safety of an oral enzyme combination vs diclofenac in osteoarthritis of the knee: results of an individual patient-level pooled reanalysis of data from six randomized controlled trials. Journal of Pain Research 9, 877–885.
[23] Savadjani, S.A., Jahanbani-Ardakani, H., Seyednozadi, S., & Khaghani, A. (2023) The effects of bromelain on osteoarthritis symptoms: A systematic review. Journal of Shahrekord University of Medical Sciences 25(2), 55-65.
[24] Pothacharoen, P., Kongtawelert, P., Phitak, T., Suttisansanee, U., Teanpaisan, R., & Vaithanomsat, P. (2021) Bromelain Extract Exerts Antiarthritic Effects via Chondroprotection and the Suppression of TNF-α–Induced NF-κB and MAPK Signaling. Plants 10 (7), 1385.
[25] Nobre, T.A., Costa, R.d.C., Cavalcante, R.V., Lima, L.F., da Silva, G.S., & Torres–Leal, F.L. (2024) Bromelain as a natural anti-inflammatory drug: a systematic review. Natural Product Research 38 (4), 1855-1865.
Autoren
ist Dozentin der Stoffwechsel-Biochemie an der LMU in München. Ihr Schwerpunkt sind die klinischen Bezüge im Stoffwechsel: Ernährung und Nahrungsergänzungsmittel (NEM) sind hier Kernthema. Als Autorin des Biochemie hoch2 Buchs von Elsevier hat sie unzählige klinische Fallbeispiele verfasst. Aktuell arbeitet sie an einer sportmedizinischen Publikation für die Vorklinik, bei der Ernährung und NEM bei verschiedenen Sportarten beleuchtet werden.