Vom Schmerz zur Biologie: Über Jahrzehnte folgte die Behandlung der Gonarthrose einem linearen Schema: Entzündung dämpfen, Schmerz lindern, Belastung reduzieren. Nicht selten lautete die Trias: Ibuprofen, Sportpause und Cortisonspritze. Dieses Vorgehen brachte kurzfristige Erleichterung, führte aber seltener zu nachhaltiger Verbesserung.
Heute wissen wir: Arthrose ist keine reine „Verschleißerkrankung“, sondern eine systemisch-entzündliche, metabolische, teils mechanisch getriebene und biologisch regulierbare Erkrankung des gesamten Gelenkorgans. Knorpel, Subchondralknochen, Synovium, Bänder, Menisken / Labrum, Sehnen und Fettkörper bilden ein interaktives System, das auf Belastung, Stoffwechsel und Zellkommunikation reagiert [1, 2]. Ein moderner Ansatz bedeutet, das Gelenk nicht zu betäuben, sondern biologisch zu modulieren – und den Menschen als Ganzes in die Heilung einzubeziehen. In diesem Paradigmenwechsel steht das plättchenreiche Plasma (PRP) exemplarisch für den Übergang von symptomatischer Therapie hin zu regenerativer Medizin. Parallel verändern sich auch die konservativen Pfeiler: Bewegung ersetzt Ruhigstellung, Ernährungssteuerung ersetzt Dauer-NSAR und bildgestützte Präzision ersetzt das „Spritzen nach Landmarken“.
Warum das alte Modell an Grenzen stößt
Nicht-steroidale Antirheumatika (NSAR) sind nach wie vor erste Anlaufstelle bei Arthroseschmerz, doch sie greifen nicht in den Krankheitsprozess ein. Meta-Analysen belegen, dass NSAR zwar kurzfristig Symptome lindern, langfristig jedoch keinen Einfluss auf Krankheitsprogression oder Knorpelerhalt zeigen [3]. Zudem bergen gastrointestinale, kardiale und renale Nebenwirkungen schwerwiegende gesundheitliche Konsequenzen [4]. Auch intraartikuläre Kortikosteroid-Injektionen haben ihren Preis. Während sie kurzfristig Schmerzen und Entzündung dämpfen können, ist inzwischen gut belegt, dass wiederholte Injektionen alle drei Monate über zwei Jahre die Knorpelhomöostase stören und Knorpelvolumenverlust beschleunigen, ohne anhaltenden Schmerzvorteil [5].
Diese Beobachtung wurde seither durch mehrere systematische Reviews bestätigt [6]. Die aktuellen S3-Leitlinien Gonarthrose (2024 / 25) und die englischen NICE-Guidelines (2022) empfehlen daher Kortison nur noch kurzzeitig (ca. 2 – 10 Wochen) und nicht wiederholt [7, 8]. Auch Hyaluronsäure-Injektionen werden kontrovers diskutiert: Der IGeL-Monitor bewertete sie 2025 als „negativ“ – eine Einschätzung, die sich primär auf uneinheitliche Datenlage und Kosten-Nutzen-Abwägung bezieht [9]. Die aktuelle Literatur erlaubt jedoch eine differenziertere Betrachtung: Im richtigen Kontext – etwa in Kombination mit PRP oder bei mechanischem Phänotyp – kann Hyaluronsäure klinisch wertvoll bleiben, insbesondere wenn Patienten und Ärzte realistische Ziele und multimodale Strategien, z. B. in Kombination mit Bewegung und Ernährung definieren [10 – 12].
Der neue rote Faden: Biologisches Denken, präzises Handeln
Der Paradigmenwechsel in der Arthrosebehandlung bedeutet: weg von der Symptombekämpfung, hin zur biologischen Modulation. Das Gelenk wird als funktionelle Einheit verstanden, die auf drei Ebenen adressiert werden muss:
- Biologisch – durch regenerative Injektionen (PRP, ACS, ggf. Zelltherapie)
- Mechanisch – durch Belastungssteuerung, Beinachsentraining und gezielte Bewegung
- Systemisch – durch Ernährung, Entzündungsmodulation, Stoffwechseloptimierung und bio-psychosozialem Approach
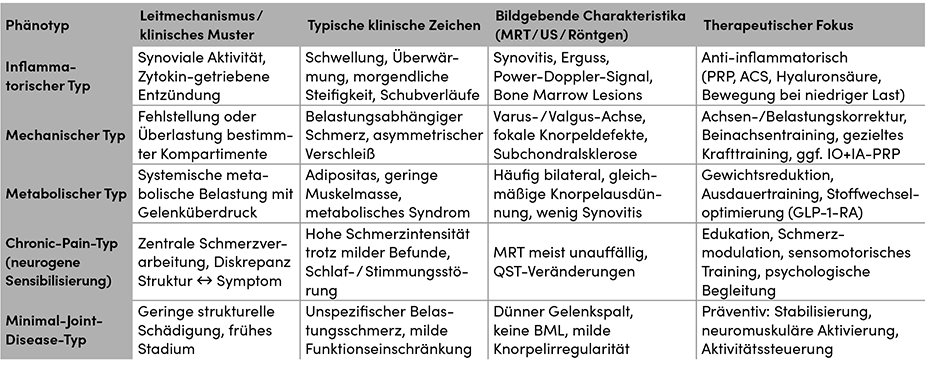
Hierbei kann die Phänotypisierung der Arthrose die Grundlage für individualisierte Therapieentscheidungen bilden. In der klinischen Praxis lässt sich die Phänotypisierung der Gonarthrose zunehmend aus bild- und funktionsbezogenen Parametern ableiten. Während laborbasierte Biomarker bislang vorwiegend Forschungszwecken dienen, ermöglichen klinisch-morphologische Muster bereits eine verlässliche Differenzierung zwischen inflammatorisch, mechanisch, metabolisch und neurogen dominierten Verlaufsformen. Diese Einteilung folgt den Konzepten von Dell’Isola et al., die sechs klinische Phänotypen beschrieben und wird durch neuere bildgebende und funktionelle Ansätze weiter gestützt [1, 2]. Ergänzend zeigen Mantripragada et al., dass sich diese klinischen Typen durch biologische Marker wie die Dichte und Verteilung von Connective Tissue Progenitor Cells (CTPs) in Knorpel, Synovium und Fettkörper weiter differenzieren lassen – ein möglicher Schritt hin zu einer kombinierten, klinisch-biologischen Phänotypisierung [3].
Diese klinisch-morphologische Phänotypisierung kann primär aus Anamnese, körperlicher Untersuchung, Sonographie und MRT abgeleitet werden – ohne Laborparameter. Sie bietet damit eine praktikable Grundlage für ein präzisionsmedizinisches Vorgehen im Praxisalltag, bei dem die Behandlung an den dominierenden Mechanismus angepasst wird: Entzündung, Mechanik, Metabolik oder Sensibilisierung (Tab.).
PRP – Hauptpfeiler des regenerativen Ansatzes
Die größte Evidenz im Bereich biologischer Injektionen besitzt das plättchenreiche Plasma (PRP). In mehreren Metaanalysen und Leitlinien wurde PRP als wirksam, sicher und langfristig überlegen gegenüber Hyaluronsäure und Kortikosteroiden bestätigt [13 – 17]. Eine aktuelle Meta-Analyse von Bensa et al. aus 2024 zeigte, dass PRP signifikant bessere klinische Ergebnisse erzielt als Kortison und Hyaluronsäure, während Kortison lediglich kurzfristige Linderung bewirkt [18]. Eine Langzeit-RCT von Chu et al. aus 2022 zeigte eine anhaltende klinische Verbesserung über bis zu 24 Monate, die über die Placebogruppe hinaus anhielt [19]. Der Wirkmechanismus von PRP ist multifaktoriell: Wachstumsfaktoren (PDGF, TGF-β, IGF-1, VEGF) fördern Matrix-Synthese und Zellproliferation, während antientzündliche Mediatoren (IL-4, IL-10) das synoviale Milieu modulieren [20]. In vitro zeigt PRP eine Steigerung der Autophagie, eine Hemmung der Apoptose in chondralen Zellen und eine M1 zu M2-Polarisierung von Makrophagen – ein Mechanismus, der auch klinisch in Form längerer Remissionen plausibel ist [21, 22]. Entscheidend für die Wirksamkeit sind Quantität und Dosis. Die Datenlage spricht klar für dosisabhängige Effekte: eine ausreichend hohe Dosis PRP führt zu besseren klinischen Ergebnissen [23 – 26], wobei eine Dosis-Wirkungs-Beziehung erkannt werden kann: während eine mittlere Gesamtdosis das Schmerzempfinden signifikant verbessern kann, sorgt eine Hochdosis-Zusammensetzung darüber hinaus auch für eine klinisch signifikante Verbesserung der funktionellen Scores.
Wichtige Benchmarks für das PRP-Kit:
- ausreichende Ausgangs-Blutmenge (> 40 ml)
- Double-Spin-Zentrifugation oder Single-Spin-Systeme mit hoher Recovery-Rate
- Erreichen einer Mindest-Gesamtdosis von ca. 10 Milliarden (10 x 10⁹) Plättchen
Ob die 10 Milliarden als einmalige Superdosis aus 90-120 ml Blut oder als 2-3-4-Injektionen im kurzfristigen Abstand verabreicht werden soll, beide Strategien zeigen klinische Wirksamkeit. Wichtig sind die standardisierte Aufbereitung und Dokumentation. Eine lokale Zellzahlbestimmung (Plättchen, Leukozyten, Erythrozyten, u. a.) vor und nach Herstellung erlaubt eine Qualitätskontrolle und Register-Datenbasis für zukünftige Real-World-Evidence (RWE)-Analysen. Eigene RWE-Register sind die Methodik der Zukunft, um in der klinischen Routine die wirksamsten Therapieformen, Dosierungen und Patient-Phänotypen zu identifizieren, zu vergleichen und kontinuierlich zu optimieren. Eine genauere Differenzierung der PRP-Zusammensetzung und Qualitätsbestimmung der beinhalteten Wachstumsfaktoren, Proteine und Vesikel ist Gegenstand aktueller wissenschaftlicher Analysen und im klinischen Setting noch schwer umsetzbar.
Hyaluronsäure – nicht verteufeln, sondern kontextualisieren
Hyaluronsäure (HA) ist kein Widerspruch zur Biologie, sondern ein möglicher Partner. Während Leitlinien (NICE, S3) keinen signifikanten Nutzen erkennen, zeigen kombinierte Strategien (PRP + HA) additive Effekte – z. B. in der Metaanalyse von Du & Liang aus 2025 mit signifikant besseren WOMAC-Scores gegenüber PRP allein [10, 27, 28]. Bei mechanischem Phänotyp oder „trockenen“ Gelenken kann die gezielte Anwendung von HA-Bioformulationen sinnvoll sein.
ACS / IRAP – wenn Entzündung dominiert
Beim inflammatorischen Phänotyp ist autologes konditioniertes Serum (ACS) oder IRAP eine bewährte Option. Während PRP Wachstumsfaktoren liefert, bringt ACS einen hohen Gehalt an IL-1-Rezeptor-Antagonist (IL-1RA), der das proinflammatorische Zytokin IL-1β kompetitiv hemmt [29]. Klinische Studien zeigen, dass ACS Schmerzen und Funktion bei OA verbessern kann [28]. Ob ACS speziell bei synovial-betonten Arthroseformen gegenüber Steroiden länger wirksam ist und ob es bei mechanisch dominanten Phänotypen eine geringere Effektstärke als PRP hat, ist derzeit nicht durch belastbare Studiendaten belegt [28]. Eine potente Alternative zu ACS bietet „bone marrow aspirate-concentrate“ (BMAC) mit höheren IL-1RA-Spiegel als inkubiertes ACS und bietet zusätzlich Zell- und Wachstumsfaktorkomponenten – damit potenziell ein „funktionell überlegener“, sofort einsetzbarer orthobiologischer Ansatz [29], welches bei intraartikulärer Gabe jedoch in Deutschland strengen regulatorischen Auflagen unterliegt.
Wohin spritzen? – „Organ Gelenk“ unter Ultraschall
Das Gelenk als Organ zu begreifen bedeutet, auch die Injektion topographisch zu denken. Nicht jede Gonarthrose ist allein intraartikulär: Meniskus-Peripherie, MCL/LCL/VKB/HKB, Gelenkkapsel, Patellasehne und Hoffa-Fettkörper sind häufig Mitspieler. Hierbei erhöht die Ultraschallführung die Trefferquote (≈ 90 – 100 % vs. 70 – 85 % bei Landmarken) und reduziert Fehlplatzierungen [24 – 26]. Der Ultraschall ist damit nicht nur Diagnostik-, sondern Therapiewerkzeug – und erlaubt eine adaptive Phänotyp-Erfassung (Synovitis, Erguss, Hoffa-Vaskularisierung, BML-Surrogatzeichen). Auch Kosteneffizienz und Outcome profitieren: Patienten benötigen weniger Wiederholungsinjektionen und berichten über schnellere Besserung nach Ultraschallgesteuerten Injektionen [26]. Subchondrale Knochenödeme (BMLs) sind heute als eigene Schmerzquelle bekannt. Studien zeigen, dass eine Kombination aus intraartikulärer und intraossärer PRP-Applikation (IA + IO) nachhaltiger wirken kann als IA allein [23]. So wird die Therapie adaptiv: weniger „Routine-Injektion“, mehr zielgerichtete Organbehandlung.
Ausblick Cell-based Therapies (BMA / BMC, SVF, MFAT) – was ORBIT 2 sagt
Der zweite Teil des ESSKA-ORBIT-Konsensus von 2025 widmet sich zellbasierten Therapien [30]. Knochenmarkaspirat-Konzentrate (BMA / BMC) und stromale vaskuläre Fraktionen (SVF) gelten als nächste Entwicklungsstufe biologischer Arthrosetherapien. In vitro zeigen beide Verfahren krankheitsmodifizierende Effekte, insbesondere auf subchondrale Knochen- und Synovialzell-Homöostase [29]. Klinisch sind die Ergebnisse vielversprechend, aber heterogen: kleinere Kohorten zeigen Funktionsverbesserungen über 24 – 36 Monate.
Der Konsensus fasst zusammen: BMC / SVF können in erfahrenen Zentren als Add-on bei refraktären Arthrosen erwogen werden, sollten aber nicht als Routine gelten, bis methodische Standardisierung erreicht ist. In der aktuellen Praxis bleibt adäquat dosiertes und verabreichtes PRP das Erstlinien-Orthobiologikum in der Arthrosebehandlung.
Ernährung, Supplemente, Training – das Terrain vorbereiten
Das biologische Umfeld des Körpers – geprägt durch Ernährung, Stoffwechsel und Aktivität – entscheidet maßgeblich darüber, wie gut orthobiologische Injektionstherapien ansprechen. Ein entzündungsarmes, nährstoffreiches Milieu unterstützt zelluläre Regeneration und die Balance zwischen katabolen und anabolen Signalwegen. Die Ernährung bildet dabei die Basis. Ein mediterran orientiertes Muster, reich an Omega-3-Fettsäuren, Phytonährstoffen, bestehend aus u. a. Polyphenolen und pflanzlichen Antioxidantien, senkt nachweislich systemische Entzündungsmarker und Gelenkschmerzintensität [31 – 33]. Omega-3-Fettsäuren – insbesondere EPA und DHA – modulieren die Bildung pro-resolutiver Lipidmediatoren (Resolvine, Protectine, Maresine) und können so das entzündliche Milieu in Gelenken und Sehnen positiv beeinflussen. Auch Mikronährstoffe spielen eine Rolle: Eine adäquate Vitamin-D-Versorgung verbessert Muskelkraft, Immunbalance und Heilungsprozesse; eine aktuelle Nutrients-Übersicht von Grant et al. hebt die Bedeutung kombinierter Supplementierung hervor [34]. Bewegung bleibt jedoch der effektivste natürliche Entzündungsmodulator. Regelmäßiges Kraft- und Ausdauertraining fördert synoviale Durchblutung, moduliert Myokin-abhängige Anti-Inflammation und verbessert die Gewebeperfusion. Besonders interessant für PRP-Therapien: Eine intensive, aber kurze Intervalleinheit kurz vor der Blutabnahme für die PRP-Herstellung kann die biologische Qualität des Plasmas steigern. Arbeiten von Baria et al. zeigten, dass akute körperliche Belastung die Expression regenerativer Wachstumsfaktoren (PDGF-AB, VEGF) und die Thrombozytenaktivierung moderat erhöht [35]. Praktisch bedeutet das: kein erschöpfendes Training, aber ein 10–15-minütiges Intervall auf Rad oder Ergometer kurz vor der Blutabnahme kann die Potenz des PRP verbessern. Schließlich haben auch Stoffwechselmodulatoren wie GLP-1-Rezeptoragonisten in bestimmten metabolischen Phänotypen ihren Platz – allerdings mit Bedacht. In klinischen Studien kann sich primär die Fettmasse reduzieren, jedoch kann 20 – 40 % des Gewichtsverlusts auf fettfreie Masse entfallen. Klinisch entscheidend: ausreichende Proteinzufuhr (1,2 – 1,6 g / kg KG / Tag) und progressives Krafttraining sind obligat, um Muskelmasse und ganzheitliche Therapieeffekte zu erhalten [36 – 38].
Fazit – vom „Schmerzmanager“ zum Organ-Therapeuten
Wir behandeln keine Gelenke mehr nach dem gleichen Schema, sondern Menschen mit einem biologisch ansprechbaren Organ. Die Gegenwart der Arthrosetherapie ist integriert und präzise:
- PRP als zentrales Tool – hochdosiert und standardisiert
- Ultraschall-geführt am gesamten Organ appliziert, auf den Phänotyp abgestimmt
- ACS / IRAP als Option bei Entzündlichem Phänotyp
- HA als selektives Add-on
- SVF / BMA / BMC additiv bei fortgeschrittenen Fällen u /o Knochenödem
- und flankierend: Bewegung, Ernährung, epigenetische Modulation
Wer Arthrose heute behandelt, moduliert nicht nur Knorpel, sondern das biologische System Mensch. Und genau hier liegt die Chance: vom „Schmerzmanager“ zum ganzheitlichen Organ-Therapeuten zu werden.
Literatur
- Dell’Isola A, Allan R, Smith SL, Marreiros SSP, Steultjens M. Identification of clinical phenotypes in knee osteoarthritis: a systematic review of the literature. BMC Musculoskelet Disord. 2016;17:425.
- van der Esch M, Knoop J, van der Leeden M, Roorda LD, Lems WF, Knol DL, et al. Clinical phenotypes in patients with knee osteoarthritis: a study in the Amsterdam osteoarthritis cohort. Osteoarthritis Cartilage. 2015;23(4):544–9.
- Bannuru RR, Osani MC, Vaysbrot EE, Arden NK, Bennell K, Bierma-Zeinstra SMA, et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage. 2019;27(11):1578–89. doi:10.1016/j.joca.2019.06.011.
- Wan EYF, Yu EYT, Chan L, Mok AHY, Wang Y, Chan EWY, et al. Comparative risks of nonsteroidal anti-inflammatory drugs on CKD. Clin J Am Soc Nephrol. 2021;16(6):898–907. doi:10.2215/CJN.18501120.
- McAlindon TE, LaValley MP, Harvey WF, Price LL, Driban JB, Zhang M, et al. Effect of intra-articular triamcinolone vs saline on knee cartilage volume and pain in knee osteoarthritis: a randomized clinical trial. JAMA. 2017;317(19):1967–75.
- Qiao X, Cheng H, Yan Y, Han Y, Li F, Guo Q, et al. Efficacy and safety of corticosteroids, hyaluronic acid, platelet-rich plasma and PRP+HA injections for knee osteoarthritis: a network meta-analysis. Front Pharmacol. 2023;14:1128896.
- Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). S3-Leitlinie Gonarthrose – Prävention, Diagnostik, Therapie. Version 2024/2025.
- National Institute for Health and Care Excellence (NICE). Osteoarthritis in over 16s: diagnosis and management (NG226). London: NICE; 2022.
- Medizinischer Dienst. IGeL-Monitor: Hyaluronsäure bei Gonarthrose – Bewertung „negativ“. Berlin; 2025.
- Du Z, Liang Y. Meta-analysis and systematic review of the clinical efficacy and safety of platelet-rich plasma combined with hyaluronic acid versus PRP monotherapy for knee osteoarthritis. J Orthop Surg Res. 2025;20:57.
- Gao N, Xu W, Chen Z, He Y, Li W, Zhang J, et al. Combined platelet-rich plasma and hyaluronic acid injections for knee osteoarthritis: a systematic review and meta-analysis. Eur Radiol. 2024;34:6912–26.
- Liu S, Wang Z, Zhou Q, Zhang Y, Li H. Efficacy of PRP combined with hyaluronic acid versus PRP alone for knee osteoarthritis: an updated meta-analysis. PLoS One. 2025;20(6):e0303176.
- Kim S, Kim J, Lee H, Kim E, Park Y, Lee Y, et al. Comparative effectiveness of platelet-rich plasma versus corticosteroid or hyaluronic acid injections for knee osteoarthritis: a systematic review and meta-analysis. Am J Sports Med. 2023;51(2):513–25.
- Laver L, Sánchez M, Anitua E, Filardo G, Kon E, Mandelbaum B, et al. ESSKA-ORBIT consensus part 1: platelet-rich plasma in knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2024;32(3):942–63.
- Kon E, Filardo G, Drobnič M, Di Matteo B, Andriolo L, Zaffagnini S, et al. ESSKA-ICRS appropriateness and effectiveness of platelet-rich plasma in musculoskeletal disorders. Knee Surg Sports Traumatol Arthrosc. 2024;32(2):521–37.
- Bensa A, Sangiorgio A, Boffa A, Salerno M, Moraca G, Filardo G. Corticosteroid injections for knee osteoarthritis offer clinical benefits similar to hyaluronic acid and lower than platelet-rich plasma: a systematic review and meta-analysis. EFORT Open Rev. 2024;9(9):883–95. doi:10.1530/EOR-23-0198.
- Chu J, Duan W, Yu Z, Tao T, Xu J, Ma Q, Zhao L, Guo JJ. Intra-articular injections of platelet-rich plasma decrease pain and improve functional outcomes compared with sham saline in patients with knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2022;30(12):4063–71. doi:10.1007/s00167-022-06887-7.
- Everts P, Onishi K, Jayaram P, Lana JFSD, Mautner K. Platelet-rich plasma: new insights for injection and cell therapy in orthopedics. Int J Mol Sci. 2020;21(21):7958.
- Yin W, Xu H, Sheng J, Zhang J, Xie X, Zhang C. Platelet-rich plasma promotes chondrocyte proliferation via activation of the Wnt/β-catenin pathway and ameliorates osteoarthritis. Cell Physiol Biochem.2017;41(6):2482–96.
- Berrigan WA, Gosens T, et al. Platelet dose and outcomes after platelet-rich plasma therapy: a systematic review. Arthroscopy. 2025;41(2):443–53.
- Boffa A, Andriolo L, Di Matteo B, Kon E, Filardo G. Platelet concentration influences clinical outcomes of platelet-rich plasma in knee osteoarthritis: a multicenter study. Am J Sports Med. 2024;52(6):1491–1502.
- Magalon J, Bausset O, Serratrice N, Giraudo L, Aboudou H, Veran J, et al. Characterization and classification of platelet concentrates (DEPA classification). Muscles Ligaments Tendons J.2016;6(3):351–7.
- Sánchez M, Delgado D, Sánchez P, Fiz N, Azofra J, Orive G, et al. Combination of intra-articular and intraosseous injections of platelet-rich plasma for severe knee osteoarthritis: a pilot study. Biomed Res Int. 2016;2016:4868613.
- Fang W-H, Liu H, Liao Y-J, Chen L-Y, Huang Y-P, Chang C-J, et al. Ultrasound-guided versus blind injections for knee osteoarthritis: a systematic review and meta-analysis. J Orthop Surg Res. 2021;16:65.
- Oo W-M, Liu Y, Hunter DJ. Accuracy and safety of ultrasound-guided injections in musculoskeletal disorders: a systematic review. Ther Adv Musculoskelet Dis. 2024;16:1759720X241210370.
- Sibbitt WL Jr, Band PA, Chavez-Chiang NR, DeLea SL, Norton HE, Bankhurst AD. A randomized controlled trial of the cost-effectiveness of ultrasound-guided intra-articular injection in inflammatory arthritis. J Rheumatol. 2011;38(2):252–63.
- Wehling P, Moser C, Frisbie D, McIlwraith CW, Kawcak CE, Krauspe R, et al. Autologous conditioned serum in the treatment of musculoskeletal diseases. Curr Drug Targets. 2007;8(10):1137–47.
- Raeissadat SA, Rayegani SM, Sohrabi MR, Jafarian N, Bahrami MN. Effectiveness of intra-articular autologous-conditioned serum injection in knee osteoarthritis: a meta-analysis. Future Sci OA.2021;7(9):FSO759.
- Cassano JM, Kennedy JG, Ross KA, Fraser EJ, Goodale MB, Fortier LA. Bone marrow concentrate and platelet-rich plasma differ in cell distribution and interleukin-1 receptor antagonist protein concentration. Knee Surg Sports Traumatol Arthrosc. 2018;26(1):333–42. (Epub 2016).
- de Girolamo L, Kon E, Andriolo L, Di Matteo B, Filardo G, Drobnič M, et al. ESSKA-ORBIT consensus part 2: cell-based therapies in knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc.2025;33(11):4079–95.
- Veronese N, Stubbs B, Noale M, Solmi M, Rizzoli R, Smith L, et al. Mediterranean diet and osteoarthritis: evidence and mechanisms. Nutrients. 2023;15(8):1760.
- de Miranda JS, Morand C, et al. Anti-inflammatory nutraceuticals in osteoarthritis management: a systematic review. Nutrients. 2024;16(5):880.
- Uchio Y, Nishikawa M, Shirasawa S, et al. Efficacy of Curcuma longa and Boswellia serrata in knee osteoarthritis: a randomized controlled trial. Nutrients. 2023;15(12):2785.
- Grant WB, Boucher BJ, et al. Vitamin D supplementation and musculoskeletal health: an updated review. Nutrients. 2025;17(2):277.
- Baria MR, Sellon JL, Smith J, LaPrade RF. Acute exercise increases platelet growth factors (PDGF-AB, VEGF) and activation markers: implications for PRP preparation. PM&R. 2020;12(9):898–905.
- Neeland IJ, Marso SP, Ayers CR, Packer M, Klein S, et al. Changes in body composition with GLP-1 receptor agonists in adults with obesity: a systematic review and meta-analysis. Diabetes Obes Metab.2024;26(5):1173–82.
- Look M, Frias JP, et al. Tirzepatide-associated weight loss and lean-mass changes: results from the SURPASS trials. Diabetes Obes Metab. 2025;27(3):441–50.
- Ryan DH, Lingvay I, Colhoun HM, Deanfield J, Emerson SS, Kahn SE, et al. Semaglutide once weekly for treatment of obesity. N Engl J Med. 2021;384(11):989–1002.
Autoren
» Facharzt für Orthopädie und Unfallchirurgie, Zusatzbezeichnung Spezielle orthopädische Chirurgie, Sportmedizin, Manuelle Medizin sowie Sportosteopathie DO.
» Chefarzt der Paracelsus Sportmedizin & Prävention Bremen im Weserstadion
» offizieller Medical Partner des SV Werder Bremen und
Mannschaftsarzt Fischtown Pinguins Eishockey Bremerhaven


