Mit dem Herbst hält auch die Erkältungssaison Einzug. Gerade für Sportler ist im Infektgeschehen ein umsichtiges Zusammenspiel aus Belastungssteuerung und der richtigen Ernährung essenziell, um Ausfallzeiten zu verkürzen und Komplikationen zu vermeiden.
Erregerspektrum
Atemwegsinfekte werden in der Mehrzahl der Fälle von Viren verursacht (insbesondere Rhino-, Adeno-, Influenza- sowie Coronaviren). Seltener sind bakterielle (Super-) Infektionen, etwa durch Streptokokken, Staphylokokken oder Pneumokokken, bedingen jedoch schwerere Krankheitsverläufe [1].
Diagnostik
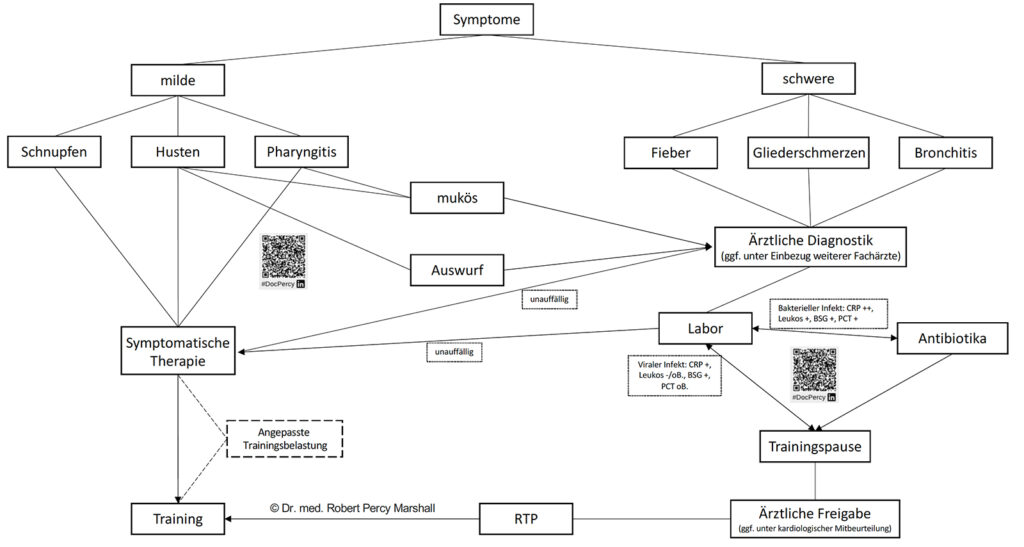
Neben eben einer gründlichen Anamnese sollte gerade bei schwereren Infektzeichen auch eine körperliche Untersuchung insbesondere mit kardialer und pulmonaler Auskultation erfolgen. Im Einzelfall muss je nach Symptomschwere über eine ergänzende laborchemische Diagnostik (u. a. Blutbild, Inflammationsparameter) entschieden werden [2] (Abb. 1).
Symptome
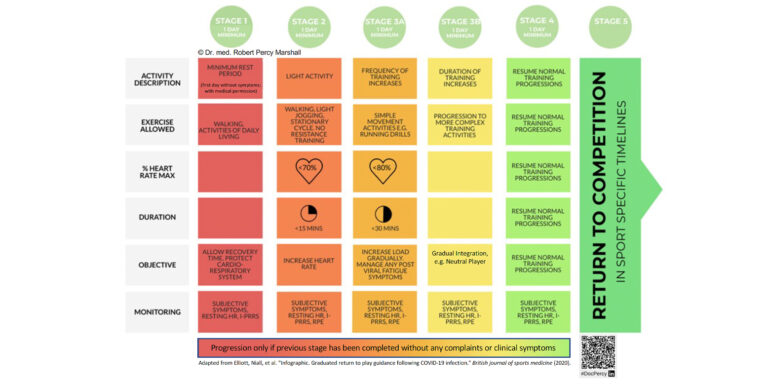
Eine pragmatische Einteilung kann zudem je nach Lokalisation der Hauptsymptomatik erfolgen: vom Hals aus betrachtet „aufwärts“ oder „abwärts“. Die oberen Atemwegsinfektionen präsentieren sich zumeist mit milderem Krankheitsbild, klassischerweise im Sinne einer Rhinitis („laufende Nase“) oder Sinusitis. In den meisten Fällen ist hier eine angepasste Belastung weiterhin möglich. Untere Atemwegsinfektionen, also führende Symptomatik auf Höhe des Halses sowie davon betrachtet abwärts (Tonsillitis, Laryngitis, Bronchitis) gehen gehäuft mit systemischen Beschwerden wie Lymphadenopathie, Fieber oder Myalgien und konsekutiv stärkerem Krankheitsgefühl einher [3]. Diese Entitäten sollten eine Belastungspause zur Folge haben, um etwaige Komplikationen wie das Auftreten einer Myokarditis zu vermeiden. Bei etwa 5 – 10 % aller viraler Atemwegsinfektionen -bei Infektionen mit SARS-CoV-2 gar noch häufiger- wird eine myokardiale Beteiligung angenommen. Diese verläuft in den meisten Fällen klinisch inapparent, kann durch fortgeführte körperliche Belastung jedoch aggraviert werden. Körperliche Schonung hingegen reduziert nachweislich die infektinduzierte entzündliche Aktivität im Myokard [4, 5]. Das Procedere hinsichtlich eines möglichen return to sports Protokoll lässt sich in Abb. 2 nachvollziehen.
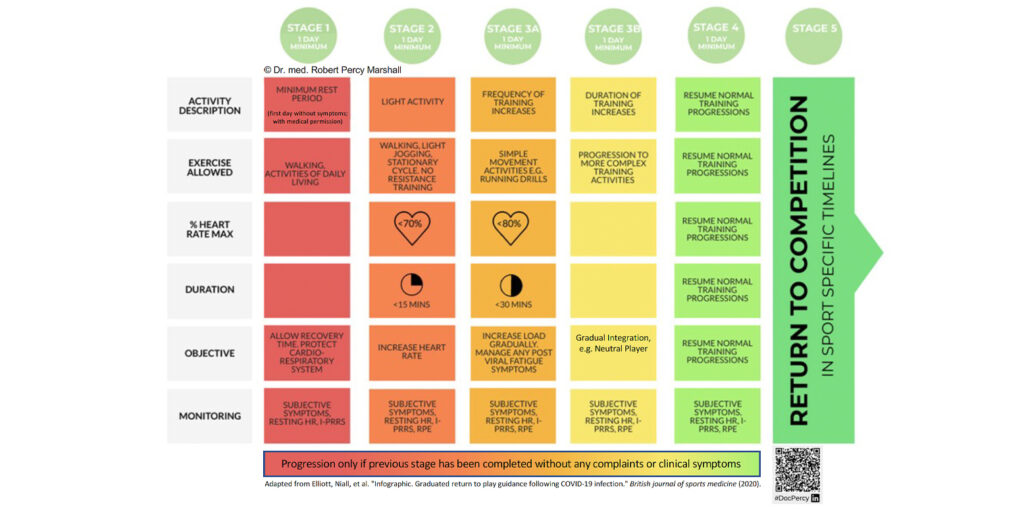
Therapie
Neben der bereits erwähnten infektassoziierten Belastungssteuerung unterscheiden sich ferner die weiteren therapeutischen Allgemeinmaßnahmen nicht unwesentlich von denen der nicht (leistungs)sportbetreibenden Normalbevölkerung. Selbstredend spielt ein ausreichender Schlaf (mindestens 7 – 8 Stunden) eine gewichtige Rolle für die Genesung, damit der ungestörte Ablauf der körpereigenen Reparaturprozesse gewährleistet ist. An dieser Stelle ist an eine vernünftige Schlafhygiene zu appellieren (rechtzeitige Ruhephasen am Abend, angenehme Umgebung im gelüfteten Schlafzimmer, bestenfalls kein Koffeinkonsum ab dem Nachmittag, wenig „Screentime“ / blaues UV-Licht am Abend. Das Schlafzimmer ist zum Schlafen da!). Auch die Ernährung kann einer guten Schlafqualität zuträglich sein (s. u.) [6]. Weiterhin ist insbesondere beim fiebernden Patienten aufgrund zu erwartender Flüssigkeitsverluste auf eine ausreichende Flüssigkeitszufuhr zu achten. Je nach Symptomen kann zudem antipyretisch, analgetisch oder antiphlogistisch behandelt werden (beispielsweise NSAR, Metamizol, Paracetamol). Eine antibiotische Therapie sollte nur beim Vorliegen bakterieller (Super)Infektionen erwogen werden. Im Falle bronchitischer Beschwerden können inhalative Maßnahmen (beispielsweise Emsersalz) supportiv bei der Expektoration wirken [7]. Die Wirksamkeit von Mukolytika wie Acetylcystein (ACC) wird seit jeher diskutiert und scheint zumindest gemäß aktueller Datenlage nicht über die einer gesteigerten Flüssigkeitszufuhr hinauszugehen [8]. Eine Supplementation von Zink bereits in einer frühen Phase des Infekts scheint die Dauer des selbigen offenbar verkürzen zu können [9]. Zudem sollte ein etwaiger Vitamin D Mangel substituiert werden [10, 11].
Prävention
Durch Optimierung gewisser präventiver Stellschrauben können Infektlast und gerade beim Sportler hiermit einhergehende Ausfallzeiten reduziert werden. Grundpfeiler einer sinnvollen Belastungssteuerung ist eine umsichtige Regeneration, um die im Training gesetzten Reize verarbeiten zu können. Die immense Rolle der Schlafqualität wurde bereits herausgestellt (s. o.). Als ergänzendes Tool können hier Wearables zum Einsatz kommen, die über verschiedene Parameter (z. B. die HRV) Rückschlüsse auf den Erholungszustand zulassen. Ferner kann beispielsweise eine erhöhte morgendliche Ruheherzfrequenz hinweisend für einen aufkommenden Infekt sein [12, 13]. Untrennbar mit dem Begriff der Prävention verknüpft ist ferner das Thema Impfungen. Neben der Aktualisierung des Impfpasses gemäß der STIKO Empfehlungen empfiehlt es sich zudem, die Immunisierung gegen saisonale Influenza, COVID-19 und (je nach Altersgruppe) Pneumokokken und Zoster zu diskutieren [14].
Ernährung als Symbiose von Prävention und Therapie
„Wenn wir jedem Einzelnen die richtige Menge an Nahrung und Bewegung geben könnten, nicht zu wenig und nicht zu viel, hätten wir den sichersten Weg zur Gesundheit gefunden.“ (Hippokrates)
Die Grundpfeiler einer gesunden Ernährung sind dem Sportler meistens gut bekannt. Es sollte eine vollwertige, pflanzenbasierte Diät basierend auf komplexen Kohlenhydraten, hochwertigen Proteinen sowie Fetten mit hohem Anteil ungesättigter Fettsäuren eingehalten werden. Weiterhin sollte auf eine ausreichende Zufuhr von Ballaststoffen (30 g/d) geachtet werden. Eine derart gestaltete Ernährung gewährleistet in der Regel eine ausreichende Versorgung mit allen essentiellen Makro- und Mikronährstoffen (und somit auch Vitaminen), sodass eine zusätzliche (insbesondere „blinde“) Supplementation nicht notwendig ist und unterbleiben sollte. Ausnahmen stellen spezielle Ernährungsformen (beispielsweise Veganismus mit häufig defizitärem Vitamin B12) oder laborchemisch nachgewiesene Mängel (z. B. Eisen, Vitamin D) dar.
Generell spielt an die Belastung angepasste ausreichende Kalorienzufuhr sowohl in der Vermeidung (Stichwort Übertraining) wie auch im eingetretenen Infekt selbst eine wichtige Rolle, da dem Körper in beiden Fällen schlichtweg genug Energiereserven bereitgestellt werden müssen. In diesem Zuge ist insbesondere die ausreichende Versorgung mit Proteinen essenziell, da diese unter anderem als Baustoffe zur Produktion von Immunglobulinen und Akute-Phase-Proteinen benötigt werden.
Aktuell gehen die Empfehlungen der Fachgesellschaften dahin, in Abhängigkeit von Trainingszustand und Trainingsziel ca. 1,2 – 2,0 g/kg KG/Tag, verteilt auf 3 – 4 Mahlzeiten, zu empfehlen. Vereinzelte Arbeiten sahen potentiell einen Benefit in einer höheren Dosierung bei Extremsportlern im Ausdauer- und Kraftbereich, jedoch lässt die derzeit noch geringe Datenlage hier keine generelle Empfehlung zu. Eine in den letzten Jahren passager postulierte „Übersubstitution“ von Proteinen ist daher nicht notwendig. Als Quelle sollten idealerweise Lebensmittel mit unterschiedlicher Zusammensetzung herangezogen werden, bestenfalls pflanzlichen Ursprungs (beispielsweise Quinoa, Hirse, Soja, Hülsenfrüchte) [15]. Sollte der Tagesbedarf an Protein hierdurch allein nicht zu decken sein, können ergänzend Proteinsupplemente (beispielsweise in Form von Shakes) zum Einsatz kommen, wobei hier auf eine hohe Qualität des Proteins geachtet werden sollte [16].
Generell sollte die letzte Mahlzeit am Abend bestenfalls vier Stunden vor der Schlafenszeit stattfinden. Das Bevorzugen besonders tryptophanreicher Kost (wie Käse, Eier, Hülsenfrüchte, Fisch, Nüsse) war in der Vergangenheit häufig mit einer verbesserten Schlafqualität assoziiert, da Tryptophan als Vorstufe von Serotonin (und somit auch Melatonin) eine entspannende und schlafanstoßende Wirkung ausüben kann [17].
Ferner sollte der Genuss von Alkohol weitestgehend eingeschränkt werden oder bestenfalls ganz unterbleiben. Erst kürzlich hatte sich die WHO klar positioniert, dass keine unschädliche Menge an Alkohol existiert und etwaige in den letzten Jahren immer wieder diskutierte gesundheitsförderliche Effekte von Alkohol schlichtweg nicht zu beschreiben sind [18].
Eine auf den oben beschriebenen Grundsätzen aufgebaute Ernährung gewährleistet zumeist eine ausreichende Versorgung mit allen wichtigen Makro- und Mikronährstoffen. Insbesondere im Infektgeschehen oder zur Prävention eines solchen (beispielsweise Erkältungszeit, harter Trainings- oder Wettkampfblock – Cave: open window) kann es dennoch klug sein, vermehrt auf solche Lebensmittel zurückzugreifen, deren vermuteter immunprotektiver Effekt im Folgenden herausgestellt sei:
- Vitamin C u. a. Zitrusfrüchte, rote Paprika, Sauerkraut [19]
- Polyphenole u. a. Brokkoli, Trauben, dunkle Schokolade [20], Curcuma [21, 22]
- Flavonoide – Subgruppe der Polyphenole (s. o.) u. a. Äpfel, Zwiebeln (Quercetin [23]), Spinat (Kaempferol [24]), rote Beeren (Anthocyane [25])
- Omega-3-Fettsäuren – DHA/EPA u. a. fetter Seefisch, Leinsamen, Walnüsse [26]
- Beta-Glucan u. a. Hafer, Gerste, Vollkornprodukte, Pilze [27]
- Zink u. a. Hülsenfrüchte, Kürbiskerne [9]
- Allicin: u. a. Knoblauch, Zwiebeln [28]
- Gingerol und Shogaol frischer oder getrockneter Ingwer [29]
- Präbiotische Lebensmittel u. a. Kefir, Kimchi, stichfester Joghurt [30]
Vorschläge zur praktischen Umsetzung nach dem „Baukastenprinzip“ lassen sich in den Abbildungen 3 und 4 nachvollziehen. Herausgestellt sind die führenden Makro- und Mikronährstoffe der jeweiligen Lebensmittel.
Fazit
Eine vorausschauende Belastungssteuerung im Zusammenspiel mit präventiven Maßnahmen ist wichtig, um Infekte zu minimieren sowie etwaige Komplikationen zu vermeiden. Der Fokus auf eine gute Schlafqualität und eine vollwertige, ausgewogene Ernährung ist hierbei essenziell, da sich beide Ressourcen gleichsam leicht zugänglich wie auch extrem effektiv in Prävention und Therapie erwiesen haben. Diese Ressourcen sollten wir nutzen, um die von uns betreuten Sportler bestmöglichst durch die Erkältungssaison zu begleiten. Um erneut Hippokrates zu zitieren: „Lass die Nahrung deine Medizin sein und Medizin deine Nahrung“.
Literatur
- Robert Koch Institut (RKI). 2024. Verfügbar unter: https://www.rki.de/SharedDocs/FAQ/ARE-Surveillance/ARE_gesamt.html
- Auckenthaler R. [Common cold: diagnostic steps? Antibiotics?]. Ther Umsch. April 1992;49(4):211–5.
- Kirkpatrick GL. The common cold. Prim Care. Dezember 1996;23(4):657–75.
- Gatmaitan BG, Chason JL, Lerner AM. Augmentation of the virulence of murine coxsackie-virus B-3 myocardiopathy by exercise. J Exp Med. 1. Juni 1970;131(6):1121–36.
- Hosenpud JD, Campbell SM, Niles NR, Lee J, Mendelson D, Hart MV. Exercise induced augmentation of cellular and humoral autoimmunity associated with increased cardiac dilatation in experimental autoimmune myocarditis. Cardiovasc Res. März 1987;21(3):217–22.
- Besedovsky L, Lange T, Born J. Sleep and immune function. Pflugers Arch. Januar 2012;463(1):121–37.
- Treating the Common Cold in Adults. Am Fam Physician. 1. September 2019;100(5):Online.
- Rubin BK. Mucolytics, expectorants, and mucokinetic medications. Respir Care. Juli 2007;52(7):859–65.
- Read SA, Obeid S, Ahlenstiel C, Ahlenstiel G. The Role of Zinc in Antiviral Immunity. Adv Nutr. 1. Juli 2019;10(4):696–710.
- Prietl B, Treiber G, Pieber TR, Amrein K. Vitamin D and immune function. Nutrients. 5. Juli 2013;5(7):2502–21.
- Subramanian K, Bergman P, Henriques-Normark B. Vitamin D Promotes Pneumococcal Killing and Modulates Inflammatory Responses in Primary Human Neutrophils. J Innate Immun. 2017;9(4):375–86.
- Hottenrott L, Gronwald T, Hottenrott K, Wiewelhove T, Ferrauti A. Utilizing Heart Rate Variability for Coaching Athletes During and After Viral Infection: A Case Report in an Elite Endurance Athlete. Front Sports Act Living. 2021;3:612782.
- Mayer C, Tyler J, Fang Y, Flora C, Frank E, Tewari M, u. a. Consumer-grade wearables identify changes in multiple physiological systems during COVID-19 disease progression. Cell Rep Med. 19. April 2022;3(4):100601.
- STIKO. Empfehlungen der Ständigen Impfkommission [Internet]. 2024. Verfügbar unter: https://www.rki.de/DE/Content/Kommissionen/STIKO/Empfehlungen/Impfempfehlungen_node.html
- Daniel König, Anja Carlsohn, Hans Braun, Mareike Großhauser, Alfonso Lampen, Stephanie Mosler, Andreas Nieß, Klaus Schäbethal, Alexandra Schek, Kiran Virmani, Rainer Ziegenhagen, Helmut Heseker.
- Deutsche Gesellschaft für Ernährungsmedizin (DGE), Deutsche Gesellschaft für Ernährung e.V. (DGE). Verfügbar unter: https://www.dge.de/gesunde-ernaehrung/gut-essen-und-trinken/dge-empfehlungen/
- Jenkins TA, Nguyen JCD, Polglaze KE, Bertrand PP. Influence of Tryptophan and Serotonin on Mood and Cognition with a Possible Role of the Gut-Brain Axis. Nutrients. 20. Januar 2016;8(1):56.
- World Health Organization (WHO). No level of alcohol consumption is safe for our health. [Internet]. 2023. Verfügbar unter: https://www.who.int/europe/news/item/04-01-2023-no-level-of-alcohol-consumption-is-safe-for-our-health
- Carr AC, Maggini S. Vitamin C and Immune Function. Nutrients. 3. November 2017;9(11):1211.
- Zou D, Xie A. Influence of polyphenol-plasma protein interaction on the antioxidant properties of polyphenols. Curr Drug Metab. Mai 2013;14(4):451–5.
- Dehzad MJ, Ghalandari H, Nouri M, Askarpour M. Antioxidant and anti-inflammatory effects of curcumin/turmeric supplementation in adults: A GRADE-assessed systematic review and dose-response meta-analysis of randomized controlled trials. Cytokine. April 2023;164:156144.
- Mollazadeh H, Cicero AFG, Blesso CN, Pirro M, Majeed M, Sahebkar A. Immune modulation by curcumin: The role of interleukin-10. Crit Rev Food Sci Nutr. 2019;59(1):89–101.
- Li Y, Yao J, Han C, Yang J, Chaudhry MT, Wang S, u. a. Quercetin, Inflammation and Immunity. Nutrients. 15. März 2016;8(3):167.
- Jia Z, Chen A, Wang C, He M, Xu J, Fu H, u. a. Amelioration effects of Kaempferol on immune response following chronic intermittent cold-stress. Res Vet Sci. August 2019;125:390–6.
- Blesso CN. Dietary Anthocyanins and Human Health. Nutrients. 5. September 2019;11(9):2107.
- Gutiérrez S, Svahn SL, Johansson ME. Effects of Omega-3 Fatty Acids on Immune Cells. Int J Mol Sci. 11. Oktober 2019;20(20):5028.
- Stier H, Ebbeskotte V, Gruenwald J. Immune-modulatory effects of dietary Yeast Beta-1,3/1,6-D-glucan. Nutr J. 28. April 2014;13:38.
- Borlinghaus J, Albrecht F, Gruhlke MCH, Nwachukwu ID, Slusarenko AJ. Allicin: chemistry and biological properties. Molecules. 19. August 2014;19(8):12591–618.
- Yücel Ç, Karatoprak GŞ, Açıkara ÖB, Akkol EK, Barak TH, Sobarzo-Sánchez E, u. a. Immunomodulatory and anti-inflammatory therapeutic potential of gingerols and their nanoformulations. Front Pharmacol. 2022;13:902551.
- Liu Y, Wang J, Wu C. Modulation of Gut Microbiota and Immune System by Probiotics, Pre-biotics, and Post-biotics. Front Nutr. 2021;8:634897.
- Dr. med. Robert Percy Marshall. Infekt-Algorithmus; Return to play nach einer Erkältung. 2023.
- generiert mit Chat-GPT Open AI [Internet]. 2024. Verfügbar unter: https://chatopenai.de
Autoren
ist als Fachärztin für Innere Medizin mit Zusatzbezeichnung Sportmedizin und Notfallmedizin im Lanserhof Tegernsee tätig. Sie absolviert derzeit die Weiterbildung Ernährungsmedizin. Außerdem fungiert sie als Anti-Doping-Beauftragte des Saarländischen Leichtathletikbundes.